大鼠脊髓损伤后形态学观察和LIMK1表达的研究
2016-02-05李广贤王日光姜洪丰刘金榜牛云峰
李广贤 王日光 姜洪丰 刘金榜 牛云峰
大鼠脊髓损伤后形态学观察和LIMK1表达的研究
李广贤 王日光 姜洪丰 刘金榜 牛云峰
目的通过监测大鼠脊髓损伤后其形态学和LIMK1、GFAP蛋白表达水平的动态改变,对脊髓损伤后LIMKL1是否参与胶质瘢痕的形成及调控进行初步研究。方法Wistar成年大鼠54只,随机分为3组:对照组、假伤组和SCI组,SCI组采用改良Allen's致伤装置制作大鼠脊髓损伤模型,采用BBB运动功能评分法观察大鼠后肢功能恢复情况。分别于术后1、2、3、4周取材,通过HE染色、免疫组化、免疫荧光等方法,观察伤后不同时期脊髓的病理变化及LIMK1、GFAP的表达情况。结果SCI组死亡率33%,BBB评分示SCI组术后2周后肢运动功能有明显恢复(P<0.01)。LIMK1、GFAP的免疫组化和激光共聚焦显微镜分析结果基本一致,两者蛋白水平表达均于伤后1周增高。GFAP表达于3周达峰值,4周时开始下降;LIMK1在伤后1周时出现峰值,2周开始波动下降,3周时达峰值,4周开始下降。结论大鼠脊髓损伤后,LIMK1和GFAP表达密切相关,结合LIMK1蛋白表达谱,提示LIMK1通路参与胶质瘢痕的形成和调控。
脊髓损伤LIM结构域激酶1胶质纤维酸性蛋白
脊髓损伤(Spinal cord injury,SCI)的修复一直是临床研究的热点和难点[1]。本研究试图寻求一种在分子水平可以调控胶质瘢痕,并促进神经再生的作用靶点,为最大可能控制及恢复脊髓神经细胞的功能提供理论基础。
1 材料与方法
1.1 实验动物及分组
成年健康Wistar大鼠54只,体质量200~220 g(佳木斯大学实验动物中心),随机分成对照组、假伤组和SCI组(按损伤时间分1、2、3、4周4个亚组)。
1.2 主要试剂与仪器
兔抗大鼠单丝氨酸蛋白激酶1(LIMK1)多克隆抗体、兔抗大鼠胶质纤维酸性蛋白(GFAP)多克隆抗体、FITC标记的荧光二抗(北京博奥森生物技术有限公司);即用型SP-9001 HistostainTM-Plus Kits免疫组化检测试剂盒(北京中杉金桥生物技术有限公司)。
ECLIPSE E100光学显微镜(日本NIKON公司);LS-3050A全自动生物组织脱水机(沈阳市龙首电子仪器有限公司);激光共聚焦显微镜(日本Olympus公司)。
1.3 大鼠脊髓损伤模型制备
大鼠常规饲养,观察健康状况及四肢活动无异常7 d后开始手术。对照组:不作特殊处理;假伤组:用10%水合氯醛(40 mg/Kg)腹腔注射麻醉后,俯卧位固定,背部剃毛,常规消毒铺巾,以T10棘突为中心作长约2~3 cm的后正中切口,逐层切开皮肤及皮下组织,剥离椎旁肌肉并暴露棘突与椎板,咬除T9到T11的棘突与椎板,骨窗大小约为4 mm×8 mm,不损伤硬膜及脊髓;SCI组:在上述操作基础上,模仿Allen's法[2],用重10 g、直径4 mm的重锤自7 cm处沿瞄准器垂直落下,通过半径3 mm的圆形垫片(与脊髓直径大小相吻合)造成该段脊髓后正中部的冲击伤,止血,局部使用适量青霉素,逐层关闭伤口。术后8 h内使用保温器维持模型大鼠体温于37℃左右(可最大限度避免术后低体温死亡)。每只大鼠术毕每日肌注青霉素钠5万U,观察皮肤有无压疮或感染、下肢有无溃烂,必要时继续注射青霉素。术后每天两次定时人工膀胱排尿,直至建立反射性膀胱排空(约在术后1周)。
1.4 大鼠SCI组伤后神经功能评估
采用BBB(Basso,Beattie,and Bresnahan Locomotor Rating Scale)运动功能评分法[3]。0分:无可见的自发活动;0~7分:后肢有不同程度的关节活动;8~12分:后肢无负重或部分负重着地;13~16分:动物持续负重并能行走;17~20分:接近正常的活动,但遗留轻度功能缺陷;21分:运动功能正常。
1.5 取材及标本制作
分别于伤后1、2、3、4周取材。腹腔麻醉后,以损伤区为中心切开创口,从其头尾两端向致伤处咬开椎板,仔细剥离黏连组织,取出脊髓(长约1.5 cm),包含损伤区及上下段脊髓,置于中性甲醛中固定48 h。充分漂洗过夜,标本在全自动生物组织脱水机内脱水48 h,脱水、石蜡包埋后切片(以距离脊髓直接损伤边缘处约1 mm部位开始切片,厚度5 μm),分别行HE染色、Nissl染色、SP免疫组化染色及免疫荧光检测。HE染色后光镜下观察脊髓组织损伤情况;Nissl染色后光镜下观察脊髓损伤后神经元细胞、尼氏小体的改变;SP免疫组化染色动态检测LIMK1及GFAP表达情况;选取损伤中心切片,进一步行免疫荧光染色,采用激光共聚焦显微镜(孔径130 nm)对LIMK1及GFAP的表达进行定量分析,每张切片随机取6个完整而不重叠的高倍视野,用激光共聚焦显微镜自带系统(Olmpus-FV1000)测量每个视野下的光密度,取6个视野的平均光密度值。
1.6 图像数据处理和统计学分析
SP免疫组化染色后,每个时间点平均取3张切片,每张切片随机选取4个视野(100倍),计算每组平均阳性细胞数;通过激光共聚焦显微镜计算机自动分析系统,计量LIMK1和GFAP相对荧光密度值。应用SPSS17.0统计软件进行统计学分析,数据采用(x±s)表示,组间比较采用t检验,P<0.05表示有显著性差异。
2 结果
2.1 脊髓损伤大鼠一般情况和运动功能评价
SCI组大鼠死亡率为33%,原因可能是低体温、腹胀、下肢褥疮、自食肢体合并感染、呼吸或泌尿系统感染。正常组和假手术组未发现明显特殊变化,亦未见死亡情况出现。
术后3 d时剔除5只对BBB评分偏离较大的模型大鼠。对照组和假伤组大鼠三项评分均为21分,SCI组伤后1 d大鼠的后肢BBB评分均为0分,伤后1周功能恢复较快,伤后2周功能恢复显著,后期功能恢复较前两周明显减弱,呈缓慢恢复状态。SCI组2周和3周、3周和4周之间的BBB评分差异无统计学意义,但2周和4周之间有差异明显(P<0.05)(表1)。

表1 各组BBB评分结果(n=6)Table 1BBB score in each group(n=6)
2.2 SCI后组织病理学变化特点
HE染色观察发现,对照组和假伤组脊髓组织细胞形态完整,神经元数量较多,排列整齐,神经纤维结构正常;SCI组伤后l周,髓内可见散在的尚未完全吸收的出血、水肿,损伤区神经细胞坏死,神经元数目减少;SCI组2周时,以损伤区为中心,神经元数目明显减少,囊腔形成,周围有炎细胞浸润,但与周围尚不完全清楚;SCI组3、4周时,神经细胞明显减少,部分神经元结构不清,变性坏死,囊腔周围可见有致密的胶质瘫痕增生(图1)。

图1 脊髓组织HE染色Fig.1HE staining of spinal cord tissue
尼氏染色观察发现,对照组和假伤组Nissl染色神经元胞体内尼氏小体丰富,无空泡,核膜完整。SCI组术后2周、4周时,可见神经元数目减少、边界模糊,尼氏小体减少,核周有深紫色团块状染色质,核膜破裂,胞浆嗜酸性改变并可见核膜完整的凋亡细胞及坏死细胞(图2)。

图2 脊髓组织Nissl染色Fig.2Nissl staining of spinal cord tissue
2.3 LIMK1、GFAP免疫组织化学染色观察
正常LIMK1主要表达在细胞质中,SCI组1周时,阳性细胞表达明显增强,达峰值;伤后2周表达下降,阳性细胞明显减少,且低于正常值;3、4周时又开始升高,并且在伤后3周时形成一个峰值(表2)。
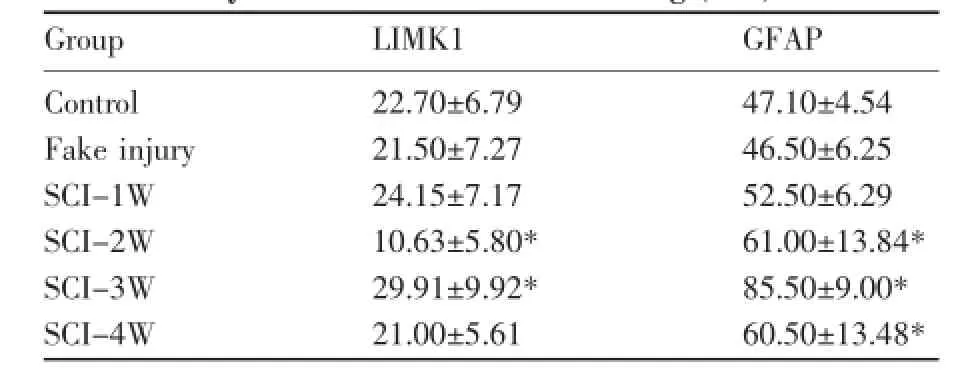
表2 免疫组化染色观察各组LIMK1和GFAP表达(n=6)Table 2The expression of LIMK1 and GFAP in each group by immunohistochemical staining(n=6)
SCI组1周时,GFAP表达略有增强,其边缘胶质细胞胞体稍有肥大;伤后2周,损伤处GFAP在星形胶质细胞胞体和突起的表达增强,数量增多,囊腔开始形成,边界不清;3、4周时,损伤区囊腔边界清晰,周围形成胶质瘢痕,瘢痕内星形胶质细胞胞体肥大,突起增多、增粗、变长,细胞排列紧密且阳性细胞数明显增多,以靠近囊腔处最为密集(图3、4)。

图3 LIMK1免疫组织化学染色观察Fig.3Immunohistochemical staining of LIMK1

图4 GFAP免疫组织化学染色观察Fig.4Immunohistochemical staining of GFAP
2.4 激光共聚焦显微镜
免疫荧光标记后,激光共聚焦显微镜观察发现,SCI组1周时,LIMK1荧光强度明显高于正常及假伤组,2周后下降,3周后再次上升并达峰值,4周时略有下降,但仍高于正常(表3)。GFAP免疫荧光标记显示,SCI组1周时荧光密度略有增强,于3周后达峰值,形态变化同IHC所述(图5、6)。

表3 免疫荧光观察各组LIMK1和GFAP表达(n=6)Table 3The expression of LIMK1 and GFAP in each groupby immunofluorescence assay(n=6)

图5 LIMK1免疫荧光观察(100×)Fig.5Immunofluorescence assay of LIMK1(100×)

图6 GFAP免疫荧光观察(100×)Fig.6Immunofluorescence assay of GFAP(100×)
3 讨论
GFAP构成星形胶质细胞的主要细胞骨架,其表达的高低可反应星形胶质细胞的功能状态与胶质化程度[4]。脊髓创伤性损伤后,星形胶质细胞发生明显的迅速反应,形成反应性胶质化增生或胶质瘢痕。本实验观察到在大鼠SCI组损伤1周时,细胞胞体肥大,突起增粗延长,即典型的反应性胶质化特征。
研究表明,SCI组损伤后星形胶质细胞的反应性胶质化具有双重作用,即幼稚期的诱导作用和成熟期的阻抑作用[5]。我们观察到大鼠脊髓损伤后2周,在损伤区形成囊腔,4周后在囊腔周围可见有胞体肥大增生的突起,并相互交织形成致密的胶质瘢痕,而此时囊腔内未见GFAP的表达,可见胶质瘢痕在损伤区对于神经轴突再生具有机械性阻抑作用。
此外,研究证实胶质瘢痕还能分泌多种神经生长抑制分子,后者在损伤区抑制轴突的生长,在神经轴突再生过程中形成另一不可逾越的化学屏障[6]。
在损伤区胶质瘢痕中分泌的抑制分子包括MAG、Tenascin-R、CSPGs[7]和多种蛋白多糖。体内与体外实验充分证明,上述抑制分子中的髓磷脂相关抑制分子(CSPGs等)主要是通过Rho-ROCKⅡ信号途径传递抑制信号,即均与受体Nogo-66receptor、NgR特异性结合后,形成P75NTR/NgR、P75NT/NgR/ Lingo-1复合物,传递胞外抑制信号至质膜内,作用于细胞内小鸟苷三磷酸酶(GTP酶)-Rho,依次激活下游底物,产生级联瀑布信号传递,使生长锥内的肌球蛋白和肌动蛋白丝收缩,抑制actin结合蛋白的解聚能力,影响微管的动态平衡,使神经轴突生长锥始终处以被抑制状态,生长锥塌陷[8]。
LIMK1是ROCK下游底物,主要定位于胞浆内。LIMK能够被ROCK以及PAK4磷酸化而激活,LIMK1激活后磷酸化Cofilin使之失活,继而抑制纤丝状actin的解聚,参与actin细胞骨架的重组[9]。Arber等[10]报道,活化的小分子GTP酶Rac(RacV12)和LIMK-1产生协同效应,能促进LIMK-1和Cofilin的磷酸化,使得共转染的细胞中纤丝状肌动蛋白纤维变粗。Nakayama等[11]通过体外实验证实,细胞骨架与其收缩有关,细胞骨架中微丝的主要结构成份是actin,与肌球蛋白、细胞内游离Ca2+及相关蛋白形成一个成纤维细胞内收缩系统,当病理性因素持久存在时,促进actin的聚合,使收缩系统发生强烈而持久的收缩,最终导致胶质瘢痕和瘢痕挛缩的发生。
我们通过免疫组化染色和免疫荧光的方法,动态观察LIMK1和GFAP蛋白表达的变化,发现LIMK1在脊髓损伤后1周,蛋白表达明显升高;2周时蛋白表达下降;但是到伤后3周又出现一峰值,相对荧光密度和阳性细胞数分别为(3547.16±484.26)和(29.91±9.92);4周时蛋白表达开始下降。GFAP从伤后1周,其表达就开始逐渐升高,在3周时达峰值。我们发现,LIMK1和GFAP在脊髓损伤后3周均达峰值,提示LIMK1与胶质瘢痕的形成存在相关性,即LIMK1可能参与胶质瘢痕的形成。
但是实验发现,LIMK1在伤后2周时表达明显下降,甚至低于正常值。我们推测,可能与该时间段SSH负反馈于LIMK1,去磷酸化恢复Cofilin解聚肌动蛋白的活性有关[12]。
综上所述,脊髓损伤后胶质瘢痕成为神经再生的机械和化学屏障,肌动蛋白细胞骨架的动力机制在瘢痕形成中的作用已得到肯定,因而LIMK-1作为肌动蛋白细胞骨架的调控子,在瘢痕防治中的意义值得探讨,这将为脊髓损伤后抑制胶质瘢痕,促进神经再生的分子治疗,提供一个潜在的作用靶点。
4 存在的问题和展望
目前,对脊髓损伤的研究多集中在如何促进神经细胞及轴突再生方面,而对胶质瘢痕形成及其调控方面的研究甚少。本实验发现LIMK1通路参与胶质瘢痕的形成,可作为调控胶质瘢痕的一个作用靶点,但是,脊髓损伤后LIMK1和Slingshot在信号传导网络中是如何相互制约的?LIMK1的活性表达是如何在时间和空间上被精准控制的?这些都是本研究领域中需要进一步解决的问题。
对脊髓损伤后调控胶质瘢痕,促进轴突再生的研究,尚期待新的突破,全面而系统地对LIMK1通路中各因子变化进行研究,将为有效抑制胶质瘢痕形成并彻底治疗脊髓损伤指明方向。
[1]Guiraud D,Azevedo Coste C,Benoussaad M,et al.Implanted functional electrical stimulation:case report of a paraplegic patient with complete SCI after 9 years[J].J Neuroeng Rehabil, 2014,11:15.
[2]Allen AR.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column:a preliminary report[J].J Am Med Assoc,1911,57(11):878-880.
[3]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion using the NYU weight-drop device versus transaction[J].Exp Neurol,1996,139 (2):244-256.
[4]Ozawa A,Kadowaki E,Haga Y,et al.Acetylcholine esterase is a regulator of GFAP expression and a target of dichlorvos in astrocytic differentiation of rat glioma C6 cells[J].Brain Res,2013,1537: 37-45.
[5]Nagatani M,Yamakawa S,Saito T,et al.GFAP-positive neoplastic astrocytes in spontaneous oligodendrogliomas and mixed gliomas of rats[J].Toxicol Pathol,2013,41(4):653-661.
[6]Romero-Aleman MM,Monzon-Mayor M,Yanes C,et al.Radial glial cells,proliferating periventricular cells,and microglia might contribute to successful structural repair in the cerebral cortex of the lizard Gallotia galloti[J].Exp Neurol,2004,188(1):74-85.
[7]Zhou FQ,W alzer M,Wu YH,et al.Neurotrophins support regenerative axon assembly over CSPGs by an ECM-integrinindependent mechanism[J].J Cell Sci,2006,119(Pt 13):2787-2796.
[8]Murali A,Rajalingam K.Small Rho GTPases in the control of cell shape and mobility[J].Cell Mol Life Sci,2014,71(9):1703-1721.
[9]Lin T,Zeng L,Liu Y,et al.Rho-ROCK-LIMK-cofilin pathway regulates shear stress activation of sterol regulatory element binding proteins[J].Circ Res,2003,92(12):1296-1304.
[10]Arber S,Barbayannis FA,Hanser H,et al.Regulation of actin dynamics through phosphorylation of cofilin by LIM-kinase[J]. Nature,1998,393(6687):805-809.
[11]Nakayama Y,Komuro R,Yamamoto A,et al.RhoA induces expression of inflammatory cytokine in adipocytes[J].Biochem Biophys Res Commun,2009,379(2):288-292.
[12]Ohta Y,Kousaka K,Nagata-Ohashi K,et al.Differential activities, subcellular distribution and tissue expression patterns of three members of Slingshot family phosphatases that dephosphorylate cofilin[J].Genes to Cells,2003,8(10):811-824.
Research on Histological Changes and Expression of LIMK1 after Spinal Cord Injury in Rats
LI Guangxian1,WANG Riguang2,JIANG Hongfeng3,LIU Jinbang1,NIU Yunfeng1.1 Anyang Area Hospital,Anyang 455000,China;2 First Hospital Affiliated to Jiamusi University,Jiamusi 154000,China;3 Tianjin Hospital,Tianjin 300000,China.
ObjectiveTo observe the expression of LIMK1,GFAP and the histological changes after SCI,and to explore whether LIMK1 participate in the formation and control of pathological glial scar.MethodsFifty-four adult Wistar rats were randomly divided into 3 groups:one group was made as control group,one group only accepted the pseudo-operation, the others were made as spinal cord injury(SCI)model by the modified Allen's impact device.Locomotor capacity was assessed according to the 21-point Basso,Beanie and Bresnahan score;The lesions were observed with light microscopy and confocal laser scanning microscope at 1,2,3 and 4 weeks after SCI.The LIMK1 and GFAP were also observed by immunohistochemistry(IHC)and immunofluorescence assay.ResultsThe mortality rate of SCI group was 33%.BBB scale of hind limb movements showed significant recovery of motor function after SCI in rats(P<0.01).There is a high degree of concordance between IHC and laser scanning confocal analysis for LIMK1 and GFAP.Both of the protein expression level increased at 1 week after SCI.The expression of GFAP reached the peak at 3 weeks after injury,and began to fail at 4 weeks.The peak of LIMK1 showed immediately at 1 week,then dropped at 2 weeks.But another peak was formed at 3 weeks and began to fail at 4 weeks.ConclusionAfter spinal cord injury,the expression of LIMK1 and GFAP are closely related.The expression profile of LIMK1 suggests that LIMK1 may play an important role in the glial scar development.
Spinal cord injury;LIM domain kinase 1;Glial fibrillry acidic protein
R744
A
1673-0364(2016)06-0353-05
10.3969/j.issn.1673-0364.2016.06.006
2016年8月13日;
2016年10月21日)
455000河南省安阳市河南省安阳地区医院(李广贤,刘金榜,牛云峰);154000黑龙江省佳木斯市佳木斯大学第一附属医院(王日光);300000天津市天津医院(姜洪丰)。
