TNF-α和IL-6在鼻咽血管纤维瘤中的表达及意义
2016-02-04吴贤敏叶凡武鹏陈晓云林昶廖志苏
吴贤敏,叶凡,武鹏,陈晓云,林昶,廖志苏
(1.温州医科大学附属第一医院 耳鼻咽喉-头颈外科,浙江 温州 325015;2.福建医科大学附属第一医院 耳鼻咽喉-头颈外科,福建 福州 350004)
・论 著・
TNF-α和IL-6在鼻咽血管纤维瘤中的表达及意义
吴贤敏1,叶凡1,武鹏1,陈晓云1,林昶2,廖志苏1
(1.温州医科大学附属第一医院 耳鼻咽喉-头颈外科,浙江 温州 325015;2.福建医科大学附属第一医院 耳鼻咽喉-头颈外科,福建 福州 350004)
目的:检测肿瘤坏死因子α(TNF-α)和白细胞介素-6(IL-6)在鼻咽血管纤维瘤(JNA)中的表达水平,并探讨TNF-α和IL-6在JNA骨质破坏机制中的作用。方法:应用免疫组织化学法检测TNF-α和IL-6在20例JNA患者和10例正常下鼻甲组织中的表达。结果:TNF-α和IL-6蛋白在JNA中的阳性表达率均为90.0%,明显高于TNF-α和IL-6蛋白在下鼻甲组织中的阳性表达率(均为20.0%)(均P<0.01)。TNF-α和IL-6蛋白的表达与JNA临床分期无关(均P>0.05)。结论:TNF-α和IL-6在JNA组织中表达增高,可能是参与JNA骨质破坏的影响因素。
肿瘤坏死因子α;白细胞介素-6;鼻咽血管纤维瘤
鼻咽血管纤维瘤(juvenile nasopharyngeal angiofibroma,JNA)为鼻咽部最常见的良性肿瘤,与一般纤维瘤不同,它由致密结缔组织、大量的弹性纤维及血管组成,常发生于10~25岁的青年男性,又称“男性青春期出血性JNA”。Liang等[1]研究发现其本质是血管错构瘤。虽然JNA是良性肿瘤,但其向邻近组织扩张生长,破坏周围骨质,可引起严重的并发症。JNA的骨质破坏机制尚未明确。最近在研究病理性骨质破坏性疾病中发现肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)和白细胞介素-6(interleukin 6,IL-6)与中耳胆脂瘤骨
质破坏密切相关[2-3]。JNA与胆脂瘤在骨质破坏过程中有许多相似之处,虽然它们都是良性肿瘤,但都会破坏周围骨质向邻近组织扩张性生长。本研究采用免疫组织化学法检测JNA组织中TNF-α和IL-6的表达情况,探讨其在JNA骨质破坏机制中的作用。
1 资料和方法
1.1 一般资料 20例JNA标本来自2000至2012年福建医科大学附属第一医院病理科,福建省耳鼻喉研究所石蜡包埋存档蜡块。JNA组:JNA患者标本共20例,术后病理诊断均为JNA,患者年龄范围11~35岁,平均18.5岁,其中男20例,女0例。对照组10例下鼻甲组织术后诊断为下鼻甲慢性炎症,患者年龄范围18~40岁,平均25.0岁,其中男5例,女5例。标本来自2015年3月至6月温州医科大学附属第一医院耳鼻咽喉科,在内窥镜下取鼻中隔偏曲伴下鼻甲肥大患者的下鼻甲组织。标本都是24 h内取材,用4%多聚甲醛固定,常规石蜡包埋,4 μm厚连续切片。
1.2 免疫组织化学染色 所用一抗浓度均为1∶100,操作严格按照说明书进行,步骤如下:①烤片,60 ℃,20 min;②常规二甲苯脱蜡,梯度乙醇脱水;二甲苯I 20 min,二甲苯I I 20 min,100%乙醇I 10 min,100%乙醇I I 10 min,95%乙醇5 min,80%乙醇5 min,70%乙醇5 min;③阻断灭活内源性过氧化物酶:3% H2O237 ℃孵育10 min,PBS冲洗3×5 min;④抗原修复:置0.01 mmol/L枸橼酸缓冲液(pH=6.0)中煮沸(95 ℃,15~20 min),自然冷却20 min以上,再用冷水冲洗缸子,加快冷却至室温,PBS冲洗3×5 min;⑤正常羊血清工作液封闭,37 ℃ 10 min,倾去勿洗;⑥滴加一抗4 ℃冰箱孵育过夜,PBS冲洗3×5 min(用PBS代替一抗作阴性对照);滴加生物素标记二抗,37 ℃孵育30 min,PBS冲洗3×5 min;⑦滴加辣根过氧化物酶标记的链霉素卵白素工作液,37 ℃孵育30 min,PBS冲洗3×5 min;⑧DAB/H2O2反应染色,自来水充分冲洗后,苏木素复染,常规脱水,透明,干燥,封片。用PBS代替一抗作为阴性对照,用已知阳性片做阳性对照。免疫组织化学染色结果判断[4]:TNF-α和IL-6的阳性染色者细胞胞浆有棕黄色颗粒沉着;阳性细胞数:0分为无阳性细胞,1分为阳性细胞数<25%,2分为阳性细胞数占25%~50%,3分为阳性细胞数占51%~75%,4分为阳性细胞数>75%;染色强度:0分为无染色,1分为弱染色,2分为中等强度染色,3分为强染色。计算各抗体的阳性细胞数和染色强度得分,以3~7分为阳性。兔抗人TNF-α多克隆抗体和兔抗人IL-6多克隆抗体均购自北京博奥森生物技术有限公司。
1.3 统计学处理方法 应用SPSS13.0统计软件进行分析,TNF-α和IL-6的阳性表达率比较采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 TNF-α和IL-6在2组中的表达 TNF-α和IL-6的阳性表达颗粒主要位于JNA血管壁内皮细胞和基质成纤维细胞的胞浆中,呈棕黄色。TNF-α和IL-6在下鼻甲组织中呈弱表达或无表达,弱表达颗粒主要位于成纤维细胞胞浆、血管内皮细胞胞浆和浆液性腺体中,着色强度不一,见图1。分别对JNA组和下鼻甲组的TNF-α和IL-6阳性表达率进行比较,JNA组中的IL-6、TNF-α表达水平明显高于下鼻甲组,差异均有统计学意义(均P<0.01)。见表1。
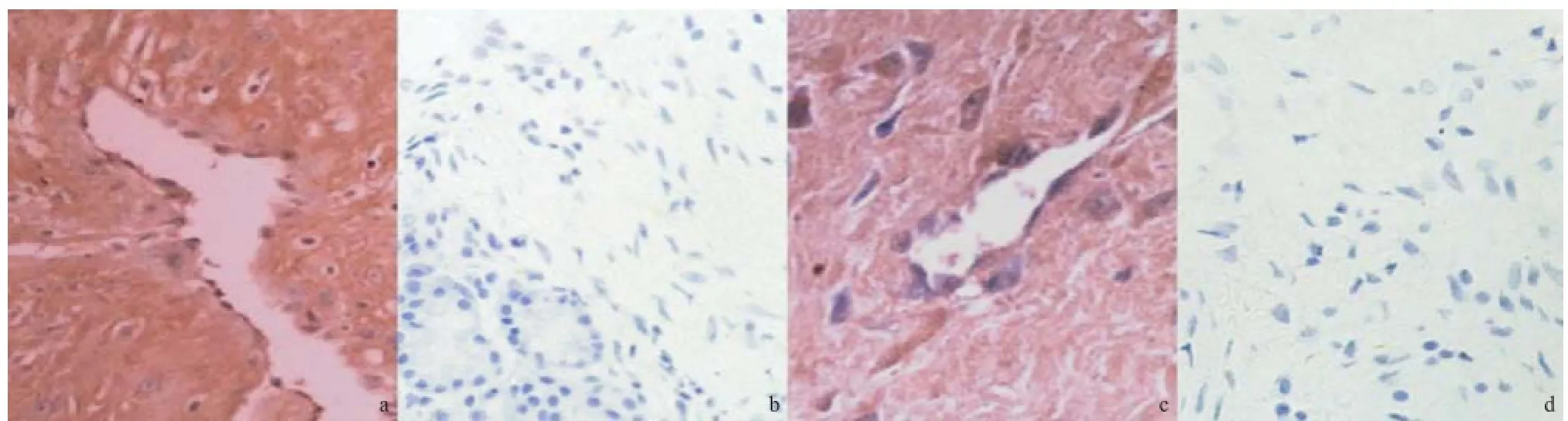
图1 免疫组织化学染色结果(×400)

表1 TNF-α和IL-6在2组中的表达(例)
2.2 TNF-α和IL-6在JNA中不同临床分期中的表达 TNF-α和IL-6在JNA不同临床分期中的表达差异无统计学意义(P>0.05),见表2。
3 讨论
TNF-α具有广泛生物学活性。TNF-α不仅有抗肿瘤、抗病毒、诱发炎症反应等作用,还能调节机体免疫系统功能,在骨重建中也发挥重要作用。Wise 等[5]研究发现TNF-α是一种强有力的骨吸收诱导剂,调控破骨细胞的分化及其生物学活性。Nanes等[6]研究发现TNF-α具有抑制骨形成,促进骨吸收的作用,TNF-α还可间接作用于破骨细胞分化所必需的下游细胞因子,如集落刺激因子-1、IL-6,促进破骨祖细胞的增殖,抑制成骨细胞的功能。Kubota等[7]研究显示TNF-α对核因子-κB受体活化因子配体(nuclear factor-kappa B ligand,RANKL)和护骨素(osteoprotegerin,OPG)的表达有调节作用。有研究[8]证明TNF-α刺激骨髓基质细胞表达RANKL,结合破骨细胞前体或破骨细胞表面的核因子-κB受体活化因子(receptor activator of nuclear factorkappa B,RANK)后引起破骨细胞分化和活化,抑制骨形成和钙化,进而影响骨代谢。有研究[9]发现TNF-α和RANKL可以相互作用,增强人破骨细胞活性。TNF-α促进破骨细胞的活性,特别是在炎症状态骨溶解中如牙周炎,促进牙槽骨破坏[10]。有研究[11]显示在一些伴有骨质破坏的炎性关节疾病如类风湿关节炎和发生骨质溶解的患者假体周围组织及关节液中TNF-α水平均升高。Vitale等[12]在胆脂瘤研究中发现TNF-α的表达增高,而且TNF-α的表达量与胆脂瘤骨质破坏相关。

表2 TNF-α和IL-6在不同临床分期中的表达(例)
IL-6是细胞因子的核心成员之一,在机体的防御机制中起着不可忽视的作用。它由活化的T细胞、单核巨嗜细胞、成纤维细胞、内皮细胞以及成骨细胞等产生并作用于多种效应细胞,因此具有广泛的生物学活性。IL-6也是破骨细胞主要的调节因子之一。首先,它可诱导骨髓单个核细胞和成骨细胞产生RANKL,在生理条件下,这些细胞中IL-6受体的表达水平较低,但在可溶性IL-6受体(SIL-6R)及信号转导和转录激活因子-3(STAT-3)被激活的情况下,可引起RANKL的表达[13-16]。RANKL与其受体RANK结合后激活NF-κB、ERK1/2和p38/MAP激酶,诱导破骨细胞的成熟及其相关受体的表达[17-18],增加破骨细胞的活性,进而引起骨丢失。其次,IL-6还能诱导一些不依赖于RANKL的促破骨细胞合成因子如IL-lB的生成。研究发现IL-lB能增加NF-κB的生成,从而影响骨代谢,而NF-κB又可反过来促进IL-6的释放,进一步使IL-6生成增加[19-20]。已有研究[21]发现IL-6在中耳胆脂瘤中表达增高,而且表达量与听骨链的破坏显著相关。也有研究[22]证明IL-6可直接激活破骨细胞分化而产生骨质降解效应。有研究[23]报道TNF-α和IL-6在COPD患者血清中表达增高,而且它们的表达与骨吸收指标呈正相关。Murakami等[24]研究发现IL-6诱导破骨细胞的分化和活性,Tocilizumab(TCZ)-人源化抗IL-6受体抗体,抑制IL-6信号,对骨和软骨的破坏有保护作用。本实验结果显示,在JNA中TNF-α和IL-6蛋白的阳性表达率均为90.0%,明显高于它们在正常下鼻甲组织中均为20.0%的阳性表达率,二者间差异有明显的统计学意义(P<0.01)。但本实验发现,TNF-α和IL-6在鼻咽血管纤维瘤中不同临床分期中的表达差异无统计学意义(P>0.05),我们认为TNF-α和IL-6蛋白与鼻咽血管纤维瘤的扩张性生长无显著相关。TNF-α和IL-6在JNA组织中表达增高,IL-6是破骨细胞分化所必需的下游细胞因子,本研究推测TNF-α间接作用于IL-6,刺激破骨细胞增殖,使成骨细胞的功能受到抑制,使成骨细胞碱性磷酸酶的活性降低,参与骨质破坏。IL-6可能诱导RANKL与RANK结合,进而激活NF-κB、ERK1/2和p38/MAP激酶,诱导破骨细胞的成熟及其相关受体的表达,增加破骨细胞的活性,引起骨丢失。TNF-α和IL-6可能是参与JNA骨质破坏的影响因素,但具体机制有待进一步研究。
[1]LIANG J, YI Z, LIANG P.The nature of juvenile nasopharyngeal angiofi broma[J].Otolaryngol Head Neck Surg, 2000, 123(4): 475-481.
[2]LIU W, XIE S, CHEN X, et al.Activation of the IL-6/JAK/ STAT3 signaling pathway in human middle ear cholesteatoma epithelium[J].Int J Clin Exp Pathol, 2014, 7(2): 709-715.
[3]KUCZKOWSKI J, SAKOWICZ-BURKIEWICZ M, IZYCKA-SWIESZEWSKA E, et al.Expression of tumor necrosis factor-a, interleukin-1a, interleukin-6 and interleukin-10 in chronicotitis media with bone osteolysis[J].ORL J Otorhi-nolaryngol Relat Spec, 2011, 73(2): 93-99.
[4]AXIOTIS C A, MONTEAGUDO C, MERINO M J, et al.Immunohistochemical detection of P-glycoprotein in endometrial adenocarcinoma[J].Am J Pathol, 1991, 138(4): 799-806.
[5]WISE G E, YAO S.Expression of tumour necrosis factor-alpha in the rat dental follicle[J].Arch Oral Biol, 2003, 48(1): 47-54.
[6]NANES M S.Tumor necrosis factor-alpha: molecular and cellular mechanisms in skeletal pathology[J].Gene, 2003, 321: 1-15.
[7]KUBOTA A, HASEGAWA K, SUGURO T, et al.Tumor necrosis factor-alpha promotes the expression of osteoprotegerin in rheumatoid synovial fibroblasts[J].J Rheumatol, 2004, 31(3): 426-435.
[8]VERMES C, CHANDRASEKARAN R, JACOBS J J, et al.The effects of particulate wear debris, cytokines, and growth factors on the functions of MG-63 osteoblasts[J].J Bone Joint Surg Am, 2001, 83-A(2): 201-211.
[9]HOLDING C A, FINDLAY D M, STAMENKOV R, et al.The correlation of RANK, RANKL and TNF alpha expression with bone loss volume and polyethylene wear debris around hip implants[J].Biomaterials, 2006, 27(30): 5212-5219.
[10]HIENZ S A, PALIWAL S, IVANOVSKI S.Mechanisms of bone resorption in periodontitis[J].J Immunol Res, 2015, 2015: 615486.
[11]STEINER G, SMOLEN J.Autoantibodies in rheumatoid arthritis and their clinical signifi cance[J].Arthritis Res, 2002, 4 Suppl 2: S1-5.
[12]VITALE R F, RIBEIRO FDE A.The role of tumor necrosis factor-alpha (TNF-alpha) in bone resorption present in middle ear cholesteatoma[J].Braz J Otorhinolaryngol, 2007, 73 (1): 117-121.
[13]HOFBAUER L C, SCHOPPET M.Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular diseases[J].JAMA, 2004, 292(4): 490-495.
[14]BOYCE B F, XING L.Functions of RANKL/RANK/OPG in bone modeling and remodeling[J].Arch Biochem Biophys, 2008, 473(2): 139-146.
[15]TILG H, MOSCHEN A R, KASER A, et al.Gut, infl ammation and osteoporosis: basic and clinical concepts[J].Gut, 2008, 57(5): 684-694.
[16]VEERAPPAN S G, O’MORAIN C A, DALY J S, et al.Review article: the effects of antitumour necrosis factor-a on bone metabolism in infl ammatory bowel disease[J].Aliment Pharmacol Ther, 2011, 33(12): 1261-1272.
[17]TURK N, CUKOVIC-CAVKA S, KORSIC M, et al.Proinflammatory cytokines and receptor activator of nuclear factor kappaB-ligandosteoprotegerin associated with bone deterioration in patients with Crohn’s disease[J].Eur J Gastroenterol Hepatol, 2009, 21(2): 159-166.
[18]TARGOWNIK L E, BERNSTEIN C N, NUGENT Z, et al.Infl ammatory bowel disease has small effect on bone mineral density and risk for osteoporosis[J].Clin Gastroenterol Hepatol, 2013, 11(3): 278-285.
[19]CARD T, WEST J, HUBBARD R, et al.Hip fractures in patients with inflammatory bowel disease and their relationship to corticosteroid use: a population based cohort study [J].Gut, 2004, 53(2): 251-255.
[20]ORLIC Z C, TURK T, SINCIC B M, et al.How activity of infl ammatory bowel disease infl uences bone loss[J].J Clin Densitom, 2010, 13(1): 36-42.
[21]HELGALAND T, ENGELEN B, OLSNES C, et al.In vitro cholesteatoma growth and secretion of cytokines[J].Acta Otolaryngol, 2010, 130(7): 815-819.
[22]SETHI N, DAI X, WINTER C G, et al.Tumor-derived JAGGED1 promotes osteolytic bone metastasis of breast cancer by engaging notch signaling in bone cells[J].Cancer Cell, 2011, 19(2): 192-205.
[23]管频, 陈娟, 冯光球, 等.慢性阻塞性肺疾病合并骨质疏松时肿瘤坏死因子α、白细胞介素的表达及意义[J].骨科, 2014, 5(3): 133-142.
[24]MURAKAMI M, NISHIMOTO N.IL-6 inhibitors prevent bone loss and cartilage degeneration in rheumatoid arthritis [J].Clin Calcium, 2015, 25(12): 1851-1857.
(本文编辑:赵翠翠)
Expression and signifi cance of tumor necrosis factor-alpha and interleukin-6 in juvenile nasopharyngeal angiofi broma
WU Xianmin1, YE Fan1, WU Peng1, CHEN Xiaoyun1, LIN Chang2, LIAO Zhisu1.
1.Department of Otorhinolaryngology and Head and Neck Surgery, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Otorhinolaryngology and Head and Neck Surgery, the First Affi liated Hospital of Fujian Medical University, Fuzhou, 350004
Objective: To detect the expression of tumor necrosis factor-alpha (TNF-α) and interleukin-6 (IL-6) in nasopharyngeal angiofi broma (JNA) and to explore the role of TNF-α and IL-6 in the mechnism of the bone destruction in JNA.Methods: The expressions of TNF-α and IL-6 in JNA tissue of 20 patients and normal inferior turbinate tissues in 10 cases of persons were determined by SP method of immunohistochemistry.Results: The positive expression rates of TNF-α and IL-6 proteins in JNA both were 90.0%, signifi cantly higher than those in inferior turbinate tissues which both were 20.0% (P<0.01).The expressions of TNF-α and IL-6 protein were no correlation with the clinical stage of JNA (P>0.05).Conclusion: The higher expressions of TNF-α and IL-6 in JNA tissues may be the infl uence factors involved in bone destruction of the JNA.
tumor necrosis factor-alpha; interleukin-6; juvenile nasopharyngeal angiofi broma
R739.63
A
10.3969/j.issn.2095-9400.2016.12.007
2016-04-09
温州市科技计划项目(Y20140596)。
吴贤敏(1982-),男,浙江温州人,主治医师,硕士。
