两种原代培养方法对血管平滑肌细胞收缩表型的影响
2016-02-04周昌钻郭航远孟立平季政
周昌钻,郭航远,,孟立平,季政
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.绍兴市人民医院(浙江大学绍兴医院) 心内科,浙江 绍兴 312000)
・论 著・
两种原代培养方法对血管平滑肌细胞收缩表型的影响
周昌钻1,郭航远1,2,孟立平1,季政2
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.绍兴市人民医院(浙江大学绍兴医院) 心内科,浙江 绍兴 312000)
目的:探究胶原酶消化法和植块法培养原代血管平滑肌细胞(VSMCs)对细胞收缩表型影响的特点。方法:使用I I型胶原酶消化法和植块法分别离体培养原代VSMCs,并获取第1代、第2代、第4代、第8代、第12代VSMCs,Western blot检测不同代数表型标志蛋白α平滑肌肌动蛋白(SMA-α)、调宁蛋白(calponin)和骨桥蛋白(OPN)表达情况;随后检测不同培养方法间表型标志蛋白表达差异,并用划痕实验和MTT实验检测迁移、增殖水平,免疫荧光检测SMA-α胞内表达。结果:消化法最初可获得明显优于植块法的VSMCs收缩表型,表现为SMA-α和calponin高表达,OPN较低表达,增殖、迁移能力相对较弱。培养至第8代后,2种方法的细胞都发生显著的表型改变,增殖、迁移能力增强且消化法细胞呈现更强的去分化表型趋势。结论:I I型胶原酶消化法可快速获得良好收缩表型的VSMCs,在第4代前具有优于植块法的收缩表型。[关键词]血管平滑肌细胞;表型;细胞去分化;细胞分离;原代培养
正常血管平滑肌细胞(vascular smooth muscle cells,VSMCs)保持稳定的收缩表型,但仍保持了重塑的潜力,在环境刺激下可发生表型转化,是动脉粥样硬化、高血压、术后再狭窄等血管性疾病的病理基础[1-2]。VSMCs去分化将失去明显的梭形外形,内质网面积增加,重构细胞外基质能力增强,并伴有VSMCs标记蛋白α平滑肌肌动蛋白(smooth muscle actin-α,SMA-α)、调宁蛋白(calponin)、平滑肌肌凝蛋白重链(smooth muscle myosinheavy chain,SMHC)表达下调和骨桥蛋白(osteopontin,OPN)表达上调[3-6]。但是国内外关于VSMCs分离方法对细胞表型和后续实验的影响仍未给予足够重视。本研究用多种标志蛋白反映细胞去分化程度,比较胶原酶消化法和植块法培养VSMCs对表型的影响,为不同实验中VSMCs分离培养方法的选择提供依据。
1 材料和方法
1.1 实验材料 SPF级SD大鼠,雌雄不限,50 d左右,体质量150~180 g(购自上海斯莱克实验动物有限责任公司)。I I型胶原酶(Sigma公司),75%乙醇(杭州化学试剂有限公司),DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS)、0.25%胰蛋白酶-EDTA、100×青霉素和链霉素(Gibco公司),抗大鼠SMA-α单克隆抗体、OPN单克隆抗体、calponin单克隆抗体、β-actin单克隆抗体(Abcam公司),FITC标记的山羊抗兔IgG二抗、辣根过氧化酶标记的山羊抗兔IgG二抗(Abbkine公司),DAPI(Rcohe公司),MTT(Emresco公司)。CO2培养箱(Thermo公司),超净工作台(苏州安泰空气技术有限公司),倒置显微镜、荧光显微镜(Nikon公司),低速离心机(合肥中佳医疗器械有限公司),组织剪、止血钳(上海医疗器械集团有限公司手术器械厂),眼科剪、眼科镊(苏州六六视觉科技股份有限公司),显微剪、显微镊(宁波成和显微器械厂),25 cm细胞培养瓶(Corning公司)。
1.2 VSMCs的分离培养
1.2.1 植块法培养VSMCs:将SD大鼠按0.2 mL/100 g腹腔注射1.5%戊巴比妥钠麻醉,无菌条件下分离胸腹主动脉,置于预冷DMEM培养基中,体视显微镜下刮除内膜,弯镊轻柔挤推血管分离中膜,迅速移入超净台并用锋利的无菌剪刀将中膜剪成0.5~1 mm2的小块,均匀铺于细胞培养瓶底面,倒置细胞瓶并加入含20% FBS的DMEM培养基,后移至37 ℃细胞孵育箱中。2 h后翻转细胞瓶使组织块浸入液面,绝对静置4 d后换液,接下来每4 d换液1次。培养1周后可见细胞游离出组织块,培养2周后,细胞融合至80%后消化传代,更换为10% FBS的完全培养基继续传代培养。
1.2.2 消化法培养VSMCs:将I I型胶原酶溶于无血清的DMEM培养基中,配成2 mg/mL的消化液。取血管中膜,剪成小块,加入2 mL消化液,37 ℃水浴消化,每30 min轻柔吹打消化液,200目无菌钢网滤过残余组织,离心收集细胞,含20% FBS的DMEM培养基重悬浮;残余组织块用巴氏管轻柔刮下后继续置于消化液中,重复以上过程,约2 h后组织块基本消化完全,将收集的细胞种植于6 cm多聚赖氨酸铺被的培养皿中,移至细胞孵育箱48 h后换液,2 d后细胞融合至80%后消化传代,并更换为含10% FBS培养基培养。
1.3 MTT实验 分别采用2种方法培养第2代和第8代原代细胞,以每孔6×103个细胞接种于96孔培养板中。每组设3个复孔,待细胞贴壁后,无血清培
养基培养24 h使细胞同步化。将细胞于37 ℃、5% CO2孵育箱培养48 h。每孔含有100 μL培养基,加入5 mg/mL的MTT溶液20 μL,37 ℃避光孵育4 h,终止培养,小心弃去培养上清,每孔加入150 μL DMSO,震荡10 min,选择570 nm波长于酶标分析仪中测定各孔吸光度值并记录。
1.4 划痕实验 取第2、第8代培养细胞,按每孔5×105个细胞数接种于6孔板中,待细胞铺满孔底后,无血清培养基同步化细胞8 h,然后加入1.8 mmol/L羟基脲抑制细胞增殖,避免细胞增殖带来的假阳性结果。12 h后100 μL黄色枪头垂直于孔板制造细胞划痕,PBS冲洗孔板3次,更换培养基。分别记录各组0、24 h图片,用Image Pro Plus 6.0分析计算出细胞迁移的面积,细胞迁移面积与最初划痕面积之间的比值来表示迁移能力。
1.5 Western blot测定VSMCs中标志蛋白的表达待第1代细胞融合至80%时,用0.25%胰酶消化、重悬浮细胞,200目钢网滤过残渣,滤液平均分为2管,随后离心收集细胞。1管继续传代培养,另1管加入2倍沉淀体积的裂解液提取蛋白。第2、第4、第8、第12代细胞常规消化离心后,提取蛋白。蛋白经上样缓冲液混匀后沸水浴5 min,按每个孔道20 μg蛋白样品上样进行SDS-PAGE凝胶电泳。分别检测各个样品中SMA-α、OPN、calponin以及内参β-actin表达情况。
1.6 细胞免疫荧光检测VSMCs中SMA-α的表达 取2种方法第2代或第8代VSMCs,按每孔500个细胞种植于96孔板内,用完全培养基孵育24 h使细胞完全贴壁,弃培养基后4%多聚甲醛固定1 h,PBS清洗后再用0.25% TritonX-100打孔,山羊血清室温封闭1 h,分别用1∶250的SMA-α抗体4 ℃条件下孵育细胞过夜,PBS洗涤3次,FICT标记山羊抗兔二抗室温孵育1 h,再用1 μg/mL DAPI染核,PBS洗涤3次,荧光显微镜下观察SMA-α分布表达。
1.7 统计学处理方法 采用SPSS19.0统计软件进行数据分析。实验数据以±s表示,2组数据间比较采用t检验,多组数据间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 MTT实验 2种方法培养的第2代VSMCs接种培养48 h后,以消化法与植块法之间光密度(optical density,OD)值的比值反映增殖能力的强弱,消化法组增殖水平低于植块法组,差异有统计学意义(1.00±0.16 vs.1.63±0.11,P<0.05);第8代细胞经48 h培养后,2组细胞OD值差异无统计学意义(1.00±0.14 vs.0.92±0.09,P>0.05),见图1。
2.2 划痕实验 分别取2种方法培养的第2代和第8代细胞行划痕实验,并根据24 h后细胞迁移面积与最初划痕面积的比值反应迁移水平。在第2代时,植块法细胞较消化法表现出更强的迁移能力,差异有统计学意义(0.321±0.010 vs.0.399±0.026,P<0.05),而培养至第8代后,两者的迁移面积差异无统计学意义(0.449±0.023 vs.0.404±0.014,P>0.05),见图2。

图1 MTT法检测植块法与消化法VSMCs增殖能力的差异
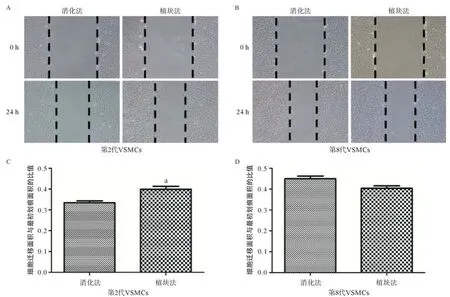
图2 划痕实验检测植块法与消化法VSMCs迁移能力的差异
2.3 Western blot测定VSMCs标志蛋白表达 2种方法获得的VSMCs随着培养时间的延长,calponin 和SMA-α表达逐渐下降,OPN表达上调,在培养至第4代时,SMA-α和OPN与第1代VSMCs相比差异有统计学意义(P<0.05);继续培养至第12代,calponin和SMA-α表达显著下降,OPN表达上调明显,见图3。随后检测二者第2、第4、第8代VSMCs标志蛋白表达,发现消化法第2代细胞与植块法相比,calponin、SMA-α表达较高而OPN表达较低;培养至第4代时消化法的细胞SMA-α表达仍高于植块法;而calponin和OPN在二者间表达差异无统计学意义。培养至第8代时,消化法原代细胞calponin表达低于植块法,而OPN表达高于植块法(P<0.05),SMA-α表达差异无统计学意义,见图4。
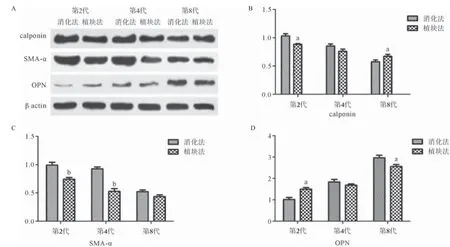
图4 不同方法VSMCs间标志蛋白表达差异检测
2.4 细胞免疫荧光检测VSMCs标志蛋白表达 细胞免疫荧光检测原代VSMCs中SMA-α表达,发现第2代消化法细胞SMA-α表达明显强于植块法;培养至第8代时,二者的SMA-α表达都出现下调,而植块法VSMCs的SMA-α表达表现出略高于消化法VSMCs的趋势,见图5。
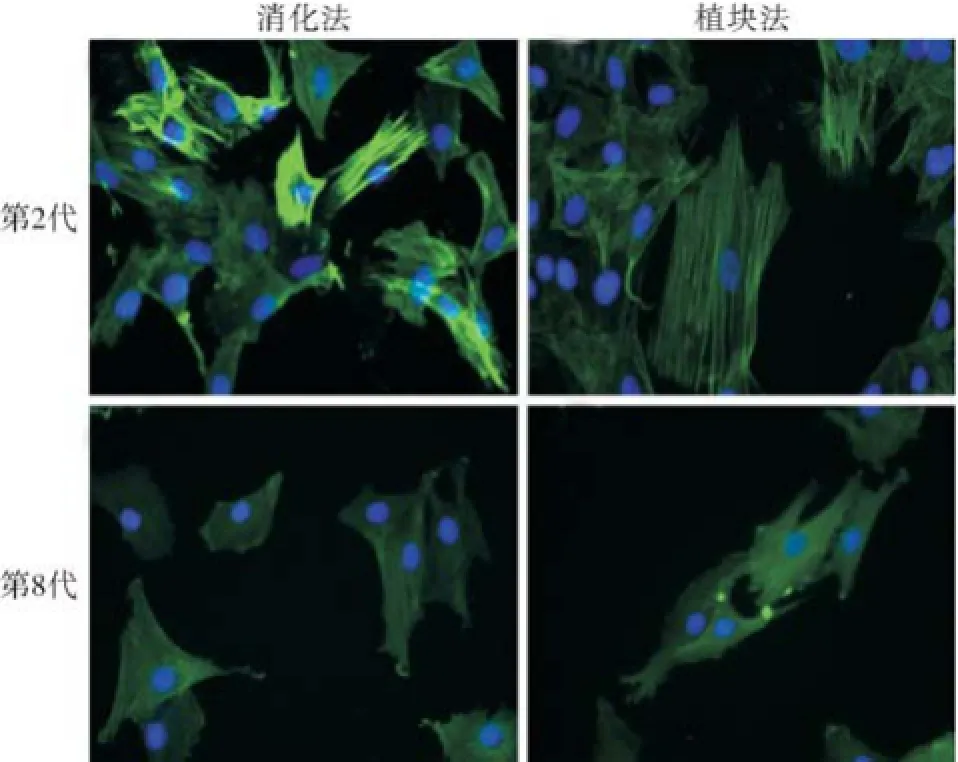
图5 免疫荧光检测2种方法VSMCs在第2代和第8代时SMA-α蛋白表达情况(× 400)
3 讨论
VSMCs在动物体内高度特异分化,参与动物血压维持和血流调节,表达一系列与收缩功能密切相关的特异蛋白。VSMCs在不同环境刺激下表型可转化为合成型、巨噬细胞样表型、钙化表型等多种细胞表型[7-9],其共同过程是VSMCs标志蛋白表达的改变。研究[10]发现,在动脉粥样斑块中82%的VSMCs 的SMA-α低表达或不表达,甚至其中部分表达巨噬细胞特异标志抗原。VSMCs发生表型转化后细胞的特性发生显著改变,在一些药理反应上出现显著差异。例如,史建红等[11]发现合成型VSMCs对乙酰胆碱诱导的细胞收缩完全不敏感。血管紧张素I I处理收缩型VSMCs能迅速诱导细胞收缩,但对于已经发生去分化的VSMCs,血管紧张素I I的这种作用则不甚明显,同时更会选择性诱导去分化VSMCs的凋亡[12]。因此,如何正常认识和在实验中恰当选择VSMCs的表型,是心血管疾病研究的重要基础。
本研究中选用3种表型标志蛋白反映VSMCs表型转化程度。SMA-α主要位于VSMCs微丝束中,是观察细胞收缩功能和细胞骨架最常用的指标之一,而calponin作为肌动蛋白的结合蛋白也直接参与了细胞收缩机制,并且具有相当高的VSMCs特异性,因此两者常被用于VSMCs细胞的鉴定[13-14]。OPN在正常血管壁中极低表达,当VSMCs受到病理刺激发生表型转化后显著增加,并且可显著增强VSMCs迁移能力,并负性调控SMA-α和calponin表达[15-16]。外源性的OPN可参与维持VSMCs的去分化表型,因此常被作为反映VSMCs表型转化程度的指标[17]。但研究发现,疾病状态、组织修复、机体发育等过程都可影响这些标志蛋白的表达,甚至其他类型细胞在发育的某些阶段也可表达部分VSMCs标志蛋白,因此VSMCs的鉴定常需要同时检测多项标志蛋白[5,18]。
实验结果显示,I I型胶原酶消化法可短期内获得大量的收缩表型良好的VSMCs。与之相比,植块法获得的VSMCs已经发生表型转化。比较两者间差异,我们推测原因可能在于胶原酶消化法直接分解细胞外基质,使细胞从组织中释放,可获得最贴近正常表型的VSMCs,随后再因为消化和血清的刺激,逐渐发生表型去分化。在第4代细胞及以前,消化法细胞在收缩表型上存在较明显的优势。植块法主要依靠VSMCs的增殖、迁移能力获得细胞,导致了初期得到的细胞已经过“筛选”,获得的细胞以高增殖、高迁移的去分化VSMCs为主。
血小板衍生因子(platelet derived growth factor,PDGF)是细胞有效的有丝分裂诱导因子,并具有活化胶原酶的作用,常用于构建VSMCs去分化模型[19-20]。研究[21]显示,植块法中添加PDGF-BB可将细胞游离出植块的时间缩短2 d,且促进细胞快速增殖、融合。可见,植块法中VSMCs培养效率和细胞表型之间存在一种直接关联。
综上所述,2种方法获得的VSMCs在表型方面存在明显差异,因此在生物学研究中应根据研究目的的不同,准确使用相应的VSMCs体外分离培养方法。I I型胶原酶消化法可迅速获得大量收缩表型良好的原代细胞,在节约培养周期和保证成功率上有明显优势,适合用于机体VSMCs信号通路调控、细胞因子影响、疾病危险因素等方面的研究,但建议在第4代或者更早培养时间的细胞用于实验研究。植块法作为经典的VSMCs培养方法,操作手法对培养成功率影响较大,获得的细胞已经发生相当程度的表型转化,可以用于疾病模型构建、药物治疗效果的观察等。
[1]DORAN A C, MELLER N, MCNAMARA C A.Role of smooth muscle cells in the initiation and early progression of atherosclerosis[J].Arterioscler Thromb Vasc Biol, 2008, 28(5): 812-819.
[2]YOSHIDA T, OWENS G K.Molecular determinants of vascular smooth muscle cell diversity[J].Circ Res, 2005, 96(3): 280-291.
[3]LACOLLEY P, REGNAULT V, NICOLETTI A, et al.The vascular smooth muscle cell in arterial pathology: a cell thatcan take on multiple roles[J].Cardiovasc Res, 2012, 95(2): 194-204.
[4]VAN DER LOOP F T, GABBIANI G, KOHNEN G, et al.Differentiation of smooth muscle cells in human blood vessels as defi ned by smoothelin, a novel marker for the contractile phenotype[J].Arterioscler Thromb Vasc Biol, 1997, 17(4): 665-671.
[5]GOMEZ D, OWENS G K.Smooth muscle cell phenotypic switching in atherosclerosis[J].Cardiovasc Res, 2012, 95(2): 156-164.
[6]OWENS G K, KUMAR M S, WAMHOFF B R.Molecular regulation of vascular smooth muscle cell differentiation in development and disease[J].Physiol Rev, 2004, 84(3): 767-801.
[7]PERRY R L, RUDNICK M A.Molecular mechanisms regulating myogenic determination and differentiation[J].Front Biosci, 2000, 5: D750-D767.
[8]LIU R, LESLIE K L, MARTIN K A.Epigenetic regulation of smooth muscle cell plasticity[J].Biochim Biophys Acta, 2015, 1849(4): 448-453.
[9]FREISE C, KIM K Y, QUERFELD U.A lindera obtusiloba extract blocks calcium-/phosphate-induced transdifferentiation and calcifi cation of vascular smooth muscle cells and interferes with matrix metalloproteinase-2 and metalloproteinase-9 and Nf-kappaB[J].Evid Based Complement Alternat Med, 2015, 2015: 679238.
[10]KAPOOR N, NIU J, SAAD Y, et al.Transcription factors STAT6 and KLF4 implement macrophage polarization via the dual catalytic powers of MCPIP[J].J Immunol, 2015, 194(12): 6011-6023.
[11]史建红, 郑斌, 韩梅, 等.细胞代数和密度影响血管平滑肌细胞表型重塑和收缩反应性的机制[J].细胞生物学杂志, 2007, 29(3): 420-424.
[12]BEAMISH J A, HE P, KOTTKE-MARCHANT K, et al.Molecular regulation of contractile smooth muscle cell phenotype: implications for vascular tissue engineering[J].Tissue Eng Part B Rev, 2010, 16(5): 467-491.
[13]SKALLI O, PELTE M F, PECLET M C, et al.Alpha-smooth muscle actin, a differentiation marker of smooth muscle cells, is present in microfi lamentous bundles of pericytes[J].J Histochem Cytochem, 1989, 37(3): 315-321.
[14]GIMONA M, HERZOG M, VANDEKERCKHOVE J, et al.Smooth muscle specific expression of calponin[J].FEBS Lett, 1990, 274(1-2): 159-162.
[15]YUE T L, MCKENNA P J, OHLSTEIN E H, et al.Osteopontin-stimulated vascular smooth muscle cell migration is mediated by beta 3 integrin[J].Exp Cell Res, 1994, 214(2): 459-464.
[16]GAO H, STEFFEN M C, RAMOS K S.Osteopontin regulates alpha-smooth muscle actin and calponin in vascular smooth muscle cells[J].Cell Biol Int, 2012, 36(2): 155-161.
[17]李占园, 刘毅, 徐玉兰, 等.骨桥素对高磷诱导的牛血管平滑肌细胞钙化的作用[J].温州医学院学报, 2006, 36(6): 539-543.
[18]CHAABANE C, COEN M, BOCHATON-PIALLAT M L.Smooth muscle cell phenotypic switch: implications for foam cell formation[J].Curr Opin Lipidol, 2014, 25(5): 374-379.
[19]RICCI C, FERRI N.Naturally occurring PDGF receptor inhibitors with potential anti-atherosclerotic properties[J].Vascul Pharmacol, 2015, 70: 1-7.
[20]BHARDWAJ S, ROY H, HEIKURA T, et al.VEGF-A, VEGF-D and VEGF-D (DeltaNDeltaC) induced intimal hyperplasia in carotid arteries[J].Eur J Clin Invest, 2005, 35 (11): 669-676.
[21]孟立平, 蒋承建, 赵飞, 等.大鼠胸主动脉血管平滑肌细胞原代培养方法的改进[J].温州医科大学学报, 2015, 45(8): 593-596.
(本文编辑:赵翠翠)
The infl uence of two vascular smooth muscle cell primary culture methods on cellular contractile phenotype
ZHOU Changzuan1, GUO Hangyuan1,2, MENG Liping1,2, JI Zheng2.
1.The First Clinical Medical College, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Cardiology, Shaoxing People’s Hospital, Shaoxing Hospital of Zhejiang University, Shaoxing, 312000
Objective: To explore the difference between collagenase digestion method and explant-culture method to obtain vascular smooth muscle cells (VSMCs) primary culture on maintaining contractile phenotype.Methods: The 1st, 2nd, 4th, 8th, 12th generation of primary VSMCs were obtained via type II collagenase digestion and explant-culture method.VSMCs contractile phenotype protein markers, calopnin and smooth muscle actin-α (SMA-α), as well assecreted protein osteopontin (OPN), were detected by western blot between different generations.The migration and proliferation ability of VSMCs from two methods were detected by woundhealing assay and MTT assay, and the phenotype protein markers expression by immunofl uorescence and western blot.Results: We found VSMCs obtained from enzyme digestion initially exhibited stronger SMA-α and calponin expression, lower OPN expression and suppressed cellular proliferation and migration compared with that from explant-culture method.However, we observed a positive correlation between cell generation and VSMCs dedifferentiation degree, and a stronger dedifferentiation trend in enzyme digestion cells after 8th generation.Conclusion: Type II collagenase digestion method shows advantages in acquiring primary cells rapidly and maintaining VSMCs contractile phenotype within 4th generation compared with explant-culture method.
vascular smooth muscle cell; phenotype; cell dedifferentiation; cell separation; primary cell culture
Q254;Q2-33
A
10.3969/j.issn.2095-9400.2016.12.001
2016-01-21
浙江省自然科学基金资助项目(LY14H020002);浙江省医药卫生培育计划(2015PYA013)。
周昌钻(1991-),男,浙江温州人,硕士生。
郭航远,主任医师,教授,博士生导师,Email:ghang yuan@hotmail.com。
