肝癌组织中SRC-3的表达及其与肝癌临床病理特征的关系
2016-01-31陈雪姣赵伟锋温一阳王朝杰胡金龙仓顺东
陈雪姣,赵伟锋,温一阳,王朝杰,付 蕾,胡金龙,白 冰,仓顺东
(郑州大学附属人民医院,河南 郑州 450003)
肝癌组织中SRC-3的表达及其与肝癌临床病理特征的关系
陈雪姣,赵伟锋,温一阳,王朝杰,付蕾,胡金龙,白冰,仓顺东
(郑州大学附属人民医院,河南 郑州 450003)
[摘要]目的探讨肝癌组织中类固醇受体共激活因子-3(SRC-3)表达及其与肝癌临床病理特征的关系。方法采用免疫组织化学染色和RT-PCR检测80例肝癌组织和癌旁组织中SRC-3蛋白和mRNA表达水平。结果肝癌组织中SRC-3蛋白阳性表达率为56.25%,明显高于癌旁组织的8.75%,差异有统计学意义(P<0.05)。58例肝癌组织中SRC-3 mRNA呈高水平转录,癌旁组织仅有12例出现高水平转录,肝癌组织中SRC-3 mRNA转录水平较癌旁组织明显升高(P<0.05)。合并乙型肝炎病毒(HBV)感染肝癌患者SRC-3蛋白表达阳性率为63.49%,明显高于未合并HBV感染肝癌患者的29.41%,差异有统计学意义(P<0.05);甲胎蛋白(AFP)<400 ng·mL-1肝癌患者SRC-3蛋白表达阳性率为76.19%,明显高于AFP≥400 ng·mL-1肝癌患者的49.15%,差异有统计学意义(P<0.05);高分化肝癌患者SRC-3蛋白表达阳性率为 88.24%,明显高于中、低分化患者的47.62%,差异有统计学意义(P<0.05)。结论SRC-3的高表达与肝癌的疾病进展关系密切,可能成为潜在的肝癌分子标志物或治疗靶点。
[关键词]肝癌;类固醇受体共激活因子-3;免疫组织化学染色;RT-PCR
近年来,新增肝癌病例逐年增多,其早期症状轻微,不易被诊断并及时治疗,故患者被确诊时多处于中晚期,部分甚至出现远处转移的症状[1],导致其治疗难度较大,同时患者预后性较差,死亡率极高,故准确查明肝癌的发病机制以提高其早期诊断的准确性,已成为延长患者生存时间的关键点[2]。类固醇受体共激活因子-3(steroid receptor coactivator -3,SRC-3)作为新发现的一种原癌基因,其蛋白编码类似固醇激素受体,具有激活转录细胞染色体片段的功能,若其在人体内过表达可导阻断或影响多种信号通路[3],从而刺激或抑制肿瘤生成。本研究采用免疫组织化学染色和RT-PCR检测2013年5月至2015年5月在我院治疗的80例肝癌患者的肝癌组织和癌旁组织中SRC-3蛋白和mRNA表达水平,以探讨SRC-3表达与肝癌临床病理特征的关系,现将结果报道如下。
1资料与方法
1.1研究对象选取2013年5月至2015年5月在我院治疗的肝癌患者80例,纳入标准[4]:1)均为行肝癌切除术患者;2)手术前未进行过放疗、化疗、介入等治疗;2)术后病理检查证实为肝细胞肝癌;4)患者及家属知情同意,并签署同意书。排除标准:患者临床病理资料缺失;术前行过放疗、化疗、介入治疗。80例肝癌患者中,男57例,女23例;年龄32~73(53.19±12.40)岁。本次研究通过了院内伦理委员会批准。
1.2标本采集纳入研究的80例肝癌患者手术切除后均获取的新鲜组织标本,送检经术后病理检查确诊为肝细胞肝癌。标本获取即可放于液氮标本罐中,并冷存于-80 ℃低温冰箱中,后用质量分数4%多聚甲醛固定,石蜡包埋,HE染色。
1.3仪器和试剂NCOA3多克隆抗体购自上海研晶实业科技有限公司;生物素标记的羊抗兔二抗购自上海研卉生物科技有限公司;RNA Trizol、PrimeScript RT reagent逆转录试剂盒及2×Taq PCR Mastennix均购自日本TAKARA(大连)公司;凝胶成像分析系统购自上海志行仪器设备有限公司;医用冰箱购自安徽中科都菱商用电器股份有限公司。
1.4SRC-3引物设计按照SRC-3的cDNA序列排列,使用Primer 3.0软件对PCR引物进行设计,序列如下:P1(上游引物):5’-TCTGGG-GACTAAGCAACAGG-3’,P2(下游引物):5’-AGTCACATTTCG-GTTTGGCC-3’,扩增产物为262 bp。以β-actin基因表达产物作为内参照设计PCR引物,序列如下:P1:5’-CCTGGCACCCAGCACAAT-3’:P2:5’-GGGCCGGACTCGTCATACT-3’,扩增产物为143 bp,由美国Invitmgen公司合成。
1.5SRC-3蛋白检测肝癌组织及癌旁组织中SRC-3蛋白检测采用免疫组织化学S-P法。肝癌组织及癌旁组织切片置于65 ℃烤箱中加温30 min,后逐步脱蜡及水化,加入质量分数3% H2O2除去内源性过氧化物酶,接着放入室温条件下孵育10~15 min,使用PBS冲洗1次,加入0.01 moL·L-1的柠檬酸PBS缓冲液缓慢加温至95~98 ℃搅拌修复20 min,然后放于室温条件下慢慢冷却,选择PBS冲洗,再加入体积分数5%山羊血清后封闭置于37 ℃静置20 min,加入兔抗人SRC-3抗体放入4 ℃孵育箱静置过夜,取出放入37 ℃条件下解冻30 min,PBS冲洗后滴加羊抗兔二抗,于37 ℃孵育20 min,行PBS冲洗并滴入链霉亲和素-生物素-过氧化物酶复合物,置于37 ℃条件下孵育20 min,PBS冲洗后滴加DAB显色,在显微镜观察下控制染色试剂反应时间,达到理想染色时即刻用蒸馏水冲洗以终止反应,后行苏木素复染,脱水、透明,最后用中性树胶封固。
1.6SRC-3 mRNA转录水平检测RT-PCR法检测SRC-3 mRNA转录:取100 mg肝癌组织及癌旁组织后用Trizol法常规提取总RNA,后用分光光度计检测定量后,抽取2 μg总RNA,按照试剂盒操作说明对cDNA行逆转录合成。以β-actin作为内参,对半定量PCR行扩增。条件为:94 ℃温度下,预变性5 min,变性30 s,55 ℃温度下退火30 s,72 ℃温度下延伸30 s,行循环30次,72 ℃温度下延伸5 min。反应得到PCR产物放入4 ℃冰箱下冷存,后取10 μL扩增产物,DAB染色后加质量分数1.5%琼脂糖凝胶电泳30 min,后取反应物在凝胶成像仪下观察PCR扩增结果。
1.7免疫组织化学结果判断免疫组织化学染色阳性为细胞内出现淡黄至棕褐色颗粒。采用二级计分法,将阳性着色细胞占视野内细胞百分比和细胞着色强度得分结合计算[6]。阳性细胞≤10%为0分,11%~25%为1分,26%~50%为2分,>50%为3分。细胞着色强度[7]:棕褐色为3分,棕黄色为2分,淡黄色为1分,不着色为0分。阳性细胞百分比得分和细胞着色强度得分乘积,≤1分为阴性,>1分为阳性。

2结果
2.1SRC-3蛋白在肝癌组织和癌旁组织中的表达SRC-3蛋白阳性染色主要表现为细胞质内呈棕黄色颗粒,分布呈弥漫或局灶状(图1)。肝癌组织中SRC-3蛋白阳性表达率为56.25%,明显高于癌旁组织的 8.75%,差异有统计学意义(P<0.05)。见表1。
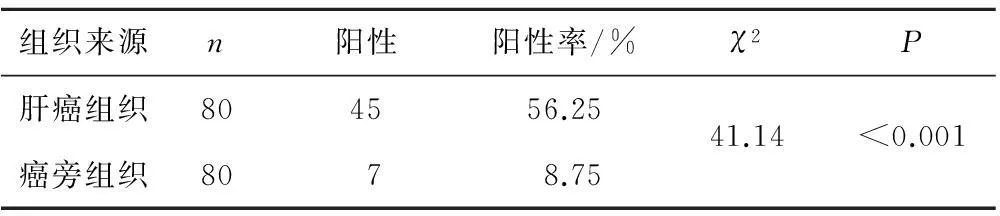
表1 SRC-3蛋白在肝癌组织和癌旁组织中的表达
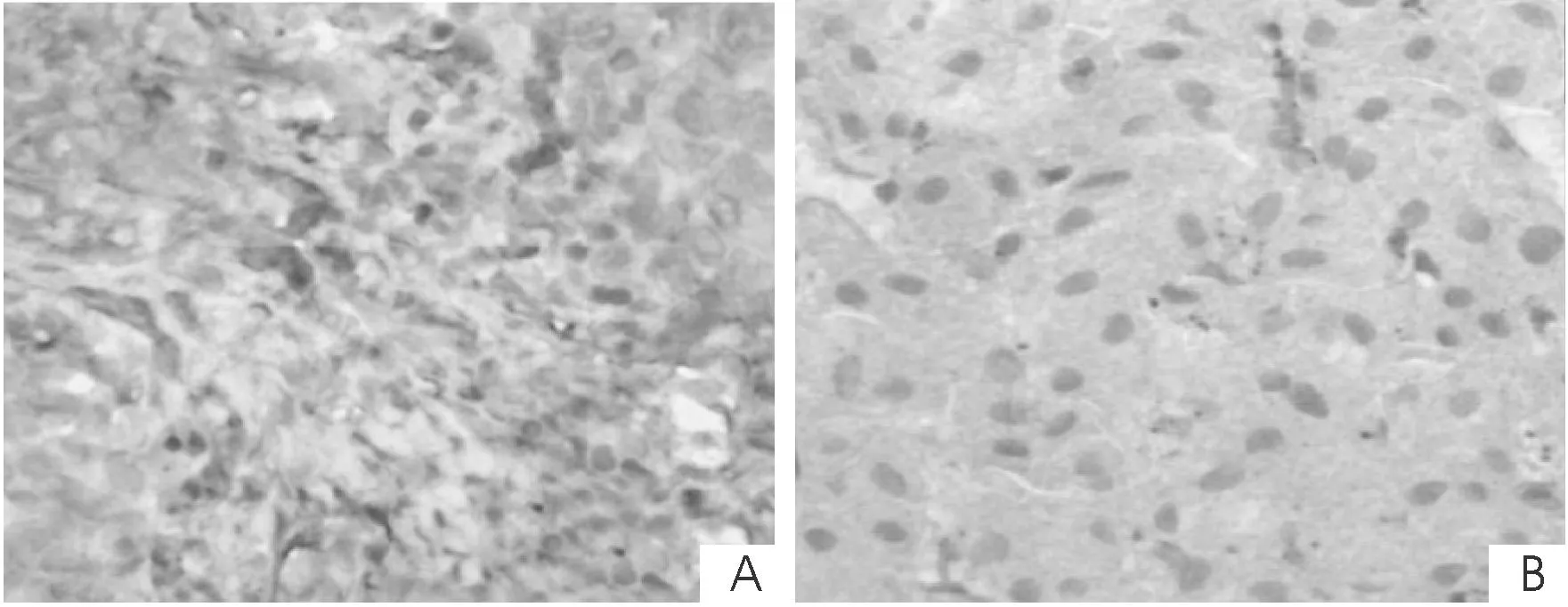
图1 SRC-3 在肝癌组织(A)和癌旁组织(B)中的表达情况(S-P,×400)
2.2SRC-3 mRNA在肝癌组织和癌旁组织中的转录水平58例肝癌组织中SRC-3 mRNA呈高水平转录,癌旁组织仅有12例出现高水平转录,肝癌组织中SRC-3 mRNA转录水平较癌旁组织明显升高(P<0.05)。见表2。

表2 SRC-3 mRNA在肝癌组织和癌旁组织中的转录水平
2.3SRC-3蛋白表达与其临床病理特征的关系合并乙型肝炎病毒(hepatitis B virus,HBV)感染肝癌患者SRC-3蛋白表达阳性率为63.49%,明显高于未合并HBV感染肝癌患者的29.41%,差异有统计学意义(P<0.05);甲胎蛋白(alpha-fetoprotein,AFP)<400 ng·mL-1肝癌患者SRC-3蛋白表达阳性率为 76.19%,明显高于AFP≥400 ng·mL-1肝癌患者的49.15%,差异有统计学意义(P<0.05);高分化肝癌患者SRC-3蛋白表达阳性率为88.24%,明显高于中、低分化患者的47.62%,差异有统计学意义(P<0.05)。见表3。

表3 SRC-3蛋白表达与其临床病理特征的关系
3讨论
现代医学已证明,肝癌的形成过程漫长且极其复杂,其可能因机体内肝脏组织细胞增殖及生长的调控过程出现异常所致[8]。人体内各种细胞包括肝组织细胞增殖由受多种调节因子调控,其中包括生长因子及其受体、基因转录因子、各类信号传导蛋白及增殖-凋亡调控蛋白酶等,这些因子均可显著影响肿瘤生成及生长,并有效促进或抑制细胞凋亡[9]。近年来,有学者在研究乳腺癌致病机制的过程中,新发现一种核激素受体转录共激活因子SRC-3,经实验证明其与乳腺癌肿瘤细胞转录扩展具有密切关系[10]。研究[11]显示,SRC-3能够与细胞核受体、核因子кB(NF-кB)、激活蛋白-1(AP-1)和组蛋白乙酰转移酶及甲基转移酶等人体因子或蛋白结合、相互作用,使得细胞内染色体得到重建,并促进靶基因转录。SRC-3能够有效促进细胞的生长及增殖,还可显著调节细胞代谢和信号传导中发挥着重要的作用,同时人体细胞内SRC-3表达水平及活性的改变会导致相关细胞因子呈现连锁式异变,从而造成整个细胞出现变异或癌变化。
在本研究中,通过免疫组织化学染色检测肝癌组织及癌旁组织标本中SRC-3的表达,我们可以观察到SRC-3蛋白阳性染色表现为细胞质内呈棕黄色颗粒,染色结果显示肝癌组织中SRC-3蛋白阳性表达率为56.25%,而癌旁组织中SRC-3蛋白阳性表达率明显要低,仅为8.75%。结果显示,肝癌组织中SRC-3呈现异常性高表达。同时,我们观察染色后的标本,可见SRC-3染色呈弥漫或局灶状分布,肝癌组织染色颗粒较集中,而癌旁组织染色颗粒分散。故我们可推测SRC-3和肝细胞的合成、增殖、凋亡及代谢信号传导等生理活动具有一定相关性,若其表达异常可导致肝细胞异变成肝癌细胞。
SRC-3 mRNA水平在乳腺癌组织内及子宫内膜癌组织内的表达水平明显高于正常乳腺及子宫内膜组织。本研究结果显示,肝癌组织中SRC-3 mRNA呈高水平转录的标本数量明显高于癌旁组织,同时肝癌组织中SRC-3 mRNA转录水平较癌旁组织明显升高。现代临床研究[12]证实,慢性乙型肝炎和慢性丙型肝炎患者均是肝癌的高发群体,这是因为肝炎病毒复制与肝癌产生机制间具有明显相关性,HBV继发肝硬化后进一步导致肝癌概率最高,据统计,约70%~90%的慢性乙型肝炎患者在肝硬化后均出现肝癌。同时,HBV可促使细胞染色体的融合,并可反式激活细胞基因,提高细胞内SRC-3表达后呈现高水平转录,并和NF-κB相互作用,导致基因转录异变后插入肝组织细胞主基因序列段内,导致其RNA转录异变,促使细胞癌变。故在研究中,合并HBV感染肝癌患者SRC-3蛋白表达阳性率明显高于未合并HBV感染肝癌患者。同时,在本研究中,我们还发现AFP<400 ng·mL-1肝癌患者SRC-3蛋白表达阳性率明显高于AFP≥400 ng·mL-1肝癌患者,这是因为肝癌肿瘤患者可致体内AFP水平呈现高表达,其已作为常规筛选肝癌患者检测标志物。其于正常人体内的浓度标准约为20 ng·mL-1,高表达标准为400 ng·mL-1,其代表患者肝癌直径较大且已弥散至不同的肝叶上。同时,研究中高分化肝癌患者SRC-3蛋白表达阳性率也明显高于中、低分化患者。因此,我们推断肝癌患者肿瘤分期及分化程度越高,其肝组织内SRC-3水平越高,故我们认为SRC-3表达水平还可预测患者预后及未来存活率。
综上所述,SRC-3表达水平变化与肝癌患者临床病理特征具有一定相关性,能够被作为一种潜在的肝癌分子标志物用于未来肝癌治疗的新靶点。
参考文献:
[1]王益.SRC-3在HBV转录复制中作用的初步研究[D].厦门:厦门大学,2014.
[2]罗磊.类固醇受体共激活因子3在人肝癌组织中的表达水平及其临床意义[D].郑州:郑州大学,2014.
[3]周琳.Ezrin在肝细胞癌侵袭转移中的作用及吴茱萸硬碱对人肝癌细胞株HepG2 Ezrin生物学行为的影响[D].长沙:中南大学,2013.
[4]罗磊,郭文治,阎冰,等.类固醇受体共激活因子-3在人肝癌组织中的表达及其临床意义[J].中华实验外科杂志,2014,31(1):156-158.
[5]张荣,王红兵.基底硬度对肝细胞和肝癌细胞融合生长的影响[J].医用生物力学,2013,28(01):91-96.
[6]Iqbal J,McRae S,Mai T,et al.Role of hepatitis C virus induced osteopontin in epithelial to mesenchymal transition,migration and invasion of hepatocytes[J].PLoS One,2014,9(1):e87464.
[7]Lee D,Lee JW.Self-renewal and circulating capacities of metastatic hepatocarcinoma cells required for collaboration between TM4SF5 and CD44[J].BMB Rep,2015,48(3):127-128.
[8]徐琉宁.可诱导表达乙肝病毒X蛋白(HBx)的HepG2和SK-Hep1细胞株的建立以及HBx对SRC-3调控效果的研究[D].长沙:中南大学,2011.
[9]Geng S,Wang X,Xu X,et al.Steroid receptor co-activator-3 promotes osteosarcoma progression through up-regulation of FoxM1[J].Tumour Biol,2014,35(4):3087-3094.
[10]Biswas A,Panigrahi R,Pal M,et al.Association of Interleukin-1β and Gene Polymorphisms with Liver Pathogenesis in Hepatitis B Virus Infection among Eastern Indian Population[J].J Clin Exp Hepatol,2013,3(4):281-287.
[11]Tai WT,Shiau CW,Chen PJ,et al.Discovery of novel Src homology region 2 domain-containing phosphatase 1 agonists from sorafenib for the treatment of hepatocellular carcinoma[J].Hepatology,2014,59(1):190-201.
[12]Hung MH,Tai WT,Shiau CW,et al.Downregulation of signal transducer and activator of transcription 3 by sorafenib:a novel mechanism for hepatocellular carcinoma therapy[J].World J Gastroenterol,2014,20(41):15269-15274.
SRC-3 Expression in the Hepatocellular
Carcinoma and Its Relationship with Clinicopathological Features
Chen Xuejiao,Zhao Weifeng,Wen Yiyang,Wang Zhaojie,Fu Lei,Hu Jinlong,Bai Bing,Cang Shundong
(DepartmentofOncology,thePeople’sHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450003,China)
[Abstract]ObjectiveTo investigate the expression of steroid receptor coactivator-3(SRC-3)in the hepatocellular carcinoma tissues and its relationship with clinicopathological features.Methodsimmunohistochemical staining and RT-PCR were used to detect SRC-3 protein and mRNA expression levels in the 80 cases of hepatocellular carcinoma and paraneoplastic tissues.ResultsThe positive expression rate of SRC-3 protein in hepatocellular carcinoma tissues was 56.25%,which was significantly higher than that(8.75%)in the paraneoplastic tissues(P<0.05).SRC-3 mRNA was high level transcription in the 58 cases of hepatocellular carcinoma,and was 12 cases in the paraneoplastic tissues,SRC-3 mRNA transcription level in the hepatocellular carcinoma was significantly increased than the paraneoplastic tissue(P<0.05).The positive rate of SRC-3 protein expression in the patients with hepatitis B virus (HBV) infection was 63.49%,which was significantly higher than that(29.41%)of patients with non HBV infection,the difference was statistically significant(P<0.05); the positive rate of SRC-3 protein expression in the patients with alpha-fetoprotein (AFP) <400 ng·mL-1was 76.19%,significantly higher than that(49.15%)in the patients with AFP≥400 ng·mL-1,the difference was statistically significant(P<0.05); the positive rate of SRC-3 protein expression in the patients with high differentiated hepatocellular carcinoma was 88.24%,significantly higher than that(47.62%)in the patients with inmiddle and low differentiated hepatocellular carcinoma,the difference was statistically significant(P<0.05).ConclusionSRC-3 high expression is related with the canceration and progression of hepatocellular carcinoma,and may become a potential molecular marker or therapeutic target.
[Key words]hepatocellular carcinoma; steroid receptor coactivator-3; immunohistochemical staining; RT-PCR
收稿日期:(2015-06-13)
[中图分类号]R735.7;R730.23
[文献标识码]A
[文章编号]1673-5412(2015)06-0469-05
通信作者:赵伟锋(1986-),男,硕士,主治医师,主要从事肿瘤靶向治疗分子机制研究。E-mail:292965288@qq.com
作者简介:陈雪姣(1987-),女,硕士,主治医师,主要从事胸部、胃肠道及血液系统恶性肿瘤的基础研究和临床工作。E-mail:chenxuejiao9999@163.com
DOI:10.3969/j.issn.1673-5412.2015.06.003
