紫花苜蓿种子萌发对钴胁迫的生理生化响应
2016-01-28张虎寇江涛师尚礼
张虎,寇江涛,师尚礼*
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,甘肃省草业工程实验室,
中-美草地畜牧业可持续研究中心,甘肃 兰州 730070)
紫花苜蓿种子萌发对钴胁迫的生理生化响应
张虎1,2,寇江涛1,2,师尚礼1,2*
(1.甘肃农业大学草业学院,甘肃 兰州 730070;2.草业生态系统教育部重点实验室,甘肃省草业工程实验室,
中-美草地畜牧业可持续研究中心,甘肃 兰州 730070)
摘要:以“甘农3号”紫花苜蓿为试验材料,研究不同浓度Co2+(0,0.25,0.50,1.00,2.50,5.00 mmol/L CoCl2)胁迫对紫花苜蓿种子萌发及幼苗生理生化特性的影响。结果表明:Co胁迫对紫花苜蓿种子的萌发及幼苗的生长有明显的抑制作用,随着Co胁迫浓度的增大,种子发芽势、发芽率、发芽指数、活力指数及幼苗的胚芽长、胚根长、根系活力和干重均显著降低,而且Co胁迫对发芽势的抑制作用大于发芽率,对胚根生长的抑制作用大于胚芽;低浓度Co胁迫(0.25和0.50 mmol/L)下,苜蓿幼苗叶片中可溶性蛋白、可溶性糖含量和蛋白水解酶、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、愈创木酚过氧化物酶(GPX)、过氧化氢酶(CAT)活性与CK均无显著差异,而游离脯氨酸含量显著升高;随着Co胁迫浓度的升高,可溶性蛋白、可溶性糖、游离脯氨酸含量及蛋白水解酶、SOD、APX、GPX、CAT活性均显著下降,超氧阴离子自由基(O2·-)产生速率、羟自由基(OH·)浓度、H2O2及丙二醛(MDA)含量均显著增加。说明高浓度Co胁迫使得苜蓿幼苗抗氧化系统活性下降,活性氧清除能力降低,膜脂过氧化程度加剧,从而抑制了紫花苜蓿种子的萌发及幼苗的生长。
关键词:钴胁迫;紫花苜蓿;种子萌发;幼苗生长;抗氧化酶;渗透调节;活性氧
Physiological and biochemical responses ofMedicagosativaseed to cobalt stress
ZHANG Hu1,2, KOU Jiang-Tao1,2, SHI Shang-Li1,2*
1.CollegeofGrasslandScience,GansuAgriculturalUniversity,Lanzhou730070,China; 2.KeyLaboratoryofEcosystemMinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-USCenterforGrazinglandEcosystemSustainability,Lanzhou730070,China
Abstract:The aim of this study was to investigate the mechanism of cobalt (Co) stress damage on Medicago sativa as experiment materials, The effects of different concentrations (0, 0.25, 0.50, 1.00, 2.50, 5.00 mmol/L CoCl2) of Co on M. sativa (cv. Gannong No.3) seed germination and seedling physiological and biochemical characteristics were assessed. The results indicate that Co stress significantly inhibited seed germination and seedling growth. Seed germination potential, germination rate, germination index, vigor index, seedling sprout length, radicle length, root activity and dry weight were significantly reduced with increasing cobalt concentration. The inhibitory effects of Co stress on germination potential was higher than that of cobalt stress on germination rate, and the inhibitory effects of Co stress on radical growth was higher than that on the plumule. Co significantly reduced the soluble protein content, soluble sugar content, proteolytic enzyme activity, superoxide dismutase (SOD), ascorbate peroxidase (APX), guaiacol peroxidase (GPX) and catalase (CAT) in seedling leaves. However free proline content increased dramatically at lower Co concentrations but declined at higher concentrations. At higher Co concentrations, O2·-(superoxide anion radical), OH·(hydroxyl radical), H2O2and malondialdehyde increased significantly. This illustrates that under high Co stress, the seedling antioxidant system activity and active oxygen scavenging ability of M. sativa decreased, inhibiting M. sativa seed germination and seedling growth.
Key words:cobalt stress; Medicago sativa; seed germination; seedling growth; antioxidant enzyme; osmotic adjustment; active oxygen
土壤是人类赖以生存的自然环境要素和重要的农业生产资源,人类活动的不断增加导致全球土地重金属污染越来越严重,并严重危害着人类自身的健康,因此,近年来治理重金属污染成为国际科学界研究的热点问题[1]。钴(Co)是动植物体生长发育所必需的微量营养元素之一,对保持生物机体的正常代谢功能必不可少[2],其在土壤中广泛存在并参与豆科植物的根瘤固氮[3-4],在植物的矿质营养中通常作为植物生长发育的有益元素而发挥作用,对多种植物具有提高产量、改善品质的作用[5]。
调查表明,世界土壤钴的平均含量范围一般在0.05~300 mg/kg之间,大多数土壤钴含量范围为2~40 mg/kg,目前多引用10 mg/kg[6]。我国土壤中钴含量的变幅较大,一般为0.57~104 mg/kg,大部分土壤钴含量在5~40 mg/kg之间。我国土壤钴的背景值为11.6 mg/kg,且南北方差异较大,北方土壤钴含量高、变幅小,一般范围为12~35 mg/kg,南方则从痕量到200 mg/kg[7-8]。钴虽然植物生长的必需微量营养元素,在植物的生长过程中有重要的作用[9],但土壤中过量的钴会阻滞植物的生长发育并使之受到毒害[10]。
紫花苜蓿(Medicagosativa)作为多年生的高产、优质豆科经济作物,具有生长速度快、生活史短、地上部及根系生物量大等特点,但有关钴胁迫对紫花苜蓿萌发、生长及生理生化的影响还缺乏研究。本文以紫花苜蓿为材料,研究不同浓度钴胁迫对紫花苜蓿种子发芽及幼苗生理生化特性的影响,旨在探明钴胁迫对紫花苜蓿幼苗的伤害机理,为明确紫花苜蓿对钴胁迫的耐性机制提供理论依据。
1材料与方法
1.1 供试材料及处理
供试品种为甘农3号紫花苜蓿(M.sativacv. Gannong No.3),由甘肃农业大学草业学院提供。
试验于2012年在甘肃农业大学草业生态系统教育部重点实验室进行。试验选取饱满均匀的苜蓿种子,用0.1% HgCl2溶液消毒 5 min,去离子水冲洗3~4次,吸水纸吸干,置于垫有2层滤纸的培养皿中,每皿100粒种子,将培养皿置于种子发芽箱中[光通量密度70 μmol/m2·s,温度(25±1)℃,相对湿度80%]进行发芽。试验药品为CoCl2,设6个Co2+胁迫浓度,分别为0(CK:蒸馏水),0.25,0.50,1.00,2.50,5.00 mmol/L,每个处理重复6次,为保证处理浓度稳定,每隔24 h更换1次处理液。
自种子发芽之日起,每日观察并记录发芽种子数(以胚根伸出种皮作为发芽标准),于处理第4天时统计种子的发芽势,测定可溶性蛋白、可溶性糖及游离脯氨酸含量、蛋白水解酶活性;第10天时统计种子的发芽率,测量苜蓿幼苗的胚芽长、胚根长、幼苗干重,计算发芽指数、活力指数,并测定幼苗的根系活力,超氧化物歧化酶(superoxide dismutase activity,SOD)、抗坏血酸过氧化物酶(ascorbate peroxidase activity,APX)、愈创木酚过氧化物酶(guaiacol peroxidase activity,GPX)、过氧化氢酶(catalase activity,CAT)活性,超氧阴离子自由基(O2·-)产生速率,羟自由基(OH·)浓度、双氧水(H2O2)及丙二醛(malondialdehyde content,MDA)含量。
1.2 测定方法
种子发芽势、发芽率采用常规统计方法测定:发芽势(%)=(4 d内正常发芽种子粒数/供试种子数)×100,发芽率(%)=(10 d内正常发芽的种子数/供试种子数)×100。胚芽长、胚根长的测定:发芽第10 天时,每处理随机选取20株幼苗,采用精度为0.1 mm的游标卡尺分别测量胚芽长、胚根长,求平均值。幼苗干重的测定:发芽第10天时,每处理随机选取20株幼苗,95℃杀青10 min,65℃下烘干称重。发芽指数(GI)= ∑(Gt/Dt),活力指数(VI)=GI×S。其中,Gt为在t日的发芽种子数,Dt为发芽天数,S为单株鲜重。根系活力采用氯化三苯基四氮唑(TTC)法,参考邹琦[11]的方法测定。
可溶性蛋白含量采用考马斯亮蓝G-250 染色法[11]测定,可溶性糖含量采用蒽酮比色法[11]测定,游离脯氨酸含量采用酸性茚三酮比色法[11]测定,蛋白水解酶活性测定参考Zhang等[12]的方法。超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、愈创木酚过氧化物酶(GPX)及过氧化氢酶(CAT)活性参考André Dias de Azevedo Neto等[13]方法测定。超氧阴离子自由基(O2·-)产生速率采用对氨基苯磺酸法[14]测定,羟自由基(OH·)浓度采用2-脱氧-D-核糖显色法[14]测定,双氧水(H2O2)含量采用KI显色法[14]测定,丙二醛(MDA)含量采用硫代巴比妥酸(TBA)显色法[14]测定,以上各指标重复3次。
1.3 数据处理与分析
采用Excel 2003进行数据处理和图表绘制,并采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA)和最小显著差数法(LSD法)进行多重比较。
2结果与分析
2.1 Co胁迫对紫花苜蓿种子萌发及幼苗生长的影响
紫花苜蓿种子在Co胁迫条件下能否正常萌发是其能否在Co污染的土壤中生长的先决条件。Co胁迫对紫花苜蓿种子的萌发有显著的影响,并存在明显的浓度效应,随着Co胁迫浓度的增大,紫花苜蓿种子的发芽势、发芽率(图1)和发芽指数、活力指数(表1)均呈降低的趋势。由图1可知,Co胁迫对紫花苜蓿种子发芽势的抑制程度大于发芽率,当Co胁迫浓度达到2.5 mmol/L时,其发芽势低于50%,发芽率也低于60%。由表1可知,0.25 mmol/L Co胁迫对紫花苜蓿种子的发芽指数和活力指数无显著的影响,当Co胁迫浓度达到0.5 mmol/L时,紫花苜蓿种子的发芽指数和活力指数均显著降低。

图1 Co胁迫对紫花苜蓿种子发芽势和发芽率的影响Fig.1 Effect of cobalt stress on alfalfa seed germination potential and germination rate 不同小写字母表示处理间差异达5%显著水平,下同。Different letters are significantly different at P<0.05, the same below.
Co胁迫对紫花苜蓿幼苗的根系活力(表1)及生长(表2)也有明显的影响。0.25~0.50 mmol/L Co胁迫对紫花苜蓿幼苗的根系活力无显著影响,当Co胁迫浓度达到1.00 mmol/L时,紫花苜蓿幼苗的根系活力开始降低,并随着Co胁迫浓度的增大而显著降低。0.25 mmol/L Co胁迫对紫花苜蓿幼苗的胚芽长、干重无显著的影响,但显著降低了幼苗的胚根长,当Co胁迫浓度达到0.50 mmol/L时,紫花苜蓿幼苗的胚芽长和干重均显著降低,并且随着Co胁迫浓度的增大,紫花苜蓿幼苗的胚芽长、胚根长和干重呈显著的下降趋势。
以上结果表明,Co胁迫明显抑制了紫花苜蓿种子的萌发及幼苗的生长,致使紫花苜蓿种子的发芽势、发芽率、发芽指数及活力指数下降,显著降低了幼苗的根系活力、胚芽长、胚根长和干重。
2.2 Co胁迫对紫花苜蓿种子萌发中渗透调节物质含量及蛋白水解酶活性的影响
可溶性蛋白、可溶性糖是植物生长发育的主要营养成分,也是植物体内的重要信号分子,能够参与植物在逆境胁迫下的信号转导和渗透调节;游离脯氨酸也在植物渗透调节中发挥着重要的作用;蛋白水解酶能够催化贮藏蛋白的氧化分解与能量释放,在种子萌发初期提供萌发所需要的营养物质和能量来源。由表3可知,当Co胁迫浓度为0.25和0.50 mmol/L时,紫花苜蓿种子萌发过程中的可溶性蛋白、可溶性糖含量及蛋白水解酶活性均与CK差异不显著;当Co胁迫浓度达到1.00 mmol/L时,紫花苜蓿种子萌发过程中的蛋白水解酶活性显著受到抑制,可溶性蛋白、可溶性糖含量显著降低,均显著低于CK,并且随着Co胁迫浓度的增大而显著下降;0.25和0.50 mmol/L Co胁迫下紫花苜蓿种子萌发过程中的游离脯氨酸含量显著高于CK,其中以0.50 mmol/L Co胁迫浓度下最高,1.00 mmol/L Co胁迫对游离脯氨酸含量无显著的影响,当Co胁迫浓度达到2.50 mmol/L时,游离脯氨酸含量显著下降。
2.3 Co胁迫对紫花苜蓿幼苗抗氧化酶活性的影响
逆境条件下,植物为了避免活性氧诱导对细胞产生的伤害,能够利用抗氧化酶系统及时清除活性氧,从而保护植物机体的生理机能。由图2可知,随着Co胁迫浓度的增大,紫花苜蓿幼苗叶片的SOD、APX、GPX活性均呈先升高后降低的趋势, 而CAT活性呈下降的趋势。当Co胁迫浓度为0.25和0.50 mmol/L时,紫花苜蓿幼苗的SOD、APX、GPX、CAT活性均与CK差异不显著;在1.00和2.50 mmol/L Co胁迫浓度下,紫花苜蓿幼苗的SOD活性显著高于CK,当Co胁迫浓度达到5.00 mmol/L时,SOD活性有所下降,与CK无显著差异;在1.00 mmol/L Co胁迫浓度下,紫花苜蓿幼苗的APX、GPX活性达到最高,并且显著高于CK,当Co胁迫浓度达到2.50 mmol/L时,APX、GPX活性开始下降,在2.50和5.00 mmol/L Co胁迫浓度下,APX、GPX活性均与CK差异不显著;当Co胁迫浓度达到1.00 mmol/L时,随着Co胁迫浓度的增大,紫花苜蓿幼苗的CAT活性也开始降低,并且均显著低于CK。

表1 Co胁迫对紫花苜蓿种子发芽指数、活力指数
不同小写字母表示处理间差异达5%显著水平,下同。Different letters are significantly different atP<0.05, the same below.

表2 Co胁迫对紫花苜蓿幼苗生长的影响

表3 Co胁迫对紫花苜蓿种子萌发中渗透调节物质含量及蛋白水解酶活性的影响
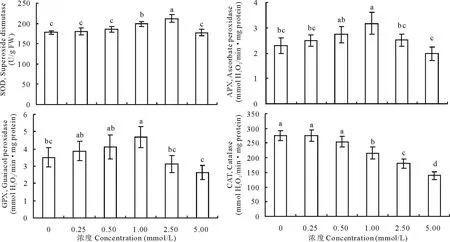
图2 Co胁迫对紫花苜蓿幼苗抗氧化酶活性的影响Fig.2 Effect of cobalt stress on alfalfa seedling antioxidant enzyme activity
2.4 Co胁迫对紫花苜蓿幼苗活性氧积累及膜脂过氧化的影响
Co胁迫对紫花苜蓿幼苗体内活性氧代谢有显著的影响(表4)。Co胁迫下,紫花苜蓿幼苗体内的O2·-产生速率、OH·浓度、H2O2含量及膜脂过氧化产物MDA含量均显著增加,并且随着Co胁迫浓度的增大而升高。在0.25 mmol/L Co胁迫浓度下,紫花苜蓿幼苗体内的O2·-产生速率、OH·浓度、H2O2及MDA含量均与CK差异不显著。当Co胁迫浓度达到0.5 mmol/L时,O2·-产生速率、OH·浓度、H2O2及MDA含量均显著高于CK,并随着Co胁迫浓度的增大而显著升高。说明Co胁迫诱导产生了大量的活性氧,并引起了紫花苜蓿幼苗的膜脂过氧化,而且随着Co胁迫浓度的增大,紫花苜蓿幼苗膜脂过氧化程度进一步加剧。

表4 Co胁迫对苜蓿幼苗活性氧积累和膜脂过氧化的影响
3讨论与结论
种子在逆境胁迫下能否正常萌发及幼苗生长状况是植物能否存活的前提条件,也是某物种能否在某一地区形成自然群落的关键因素[15]。一般情况下,种子的发芽势高,说明种子的生命力强,种子出苗较为整齐一致,而发芽率则能够反映种子的出苗情况。发芽指数反映了种子的发芽速率和整齐程度,而活力指数反映了种子在较广的范围能否迅速发芽和生长的整齐度。本试验中,Co胁迫显著降低了紫花苜蓿种子的发芽势、发芽率、发芽指数及活力指数,抑制了紫花苜蓿种子的萌发。根系作为植物体最活跃的吸收器官和合成器官,其活力水平可直接影响地上部的生长和营养状况及产量水平。在种子萌发过程中,胚芽长、胚根长及幼苗干重也是反映幼苗生长状况的关键指标。Co胁迫也显著降低了紫花苜蓿幼苗的根系活力,降低了胚芽长、胚根长及幼苗干重,说明Co胁迫对紫花苜蓿幼苗生长有显著的抑制作用。一般认为,重金属对植物种子萌发及幼苗的影响存在一个较低浓度下的刺激效应和高浓度下的抑制效应。随着Co胁迫浓度的增大,对紫花苜蓿种子萌发及幼苗生长的抑制作用加剧,这与前人[16-19]的研究结果一致,但本试验结果不存在低浓度下的刺激效应,这可能和Co的胁迫浓度有关,也可能和植物种类有关。由于种子萌发后,胚根最先突破种皮吸水,受Co胁迫的时间比胚芽长,并且胚根是种子发芽过程中吸收水分和营养的主要器官,Co进入幼苗体内后,大多数积累在胚根部位,所以胚根受到的抑制程度大于胚芽。
任何逆境都会引起渗透胁迫,渗透调节是植物减少逆境伤害的一个重要特征[20]。逆境胁迫下,植物体能够通过代谢调控积累一些小分子有机物质进行渗透调节,缓解逆境造成的渗透胁迫[21],可溶性蛋白、可溶性糖、游离脯氨酸含量的高低能够在一定程度上反映植物对逆境胁迫的耐性,而蛋白水解酶活性的升高有利于植物在逆境胁迫下积累游离氨基酸[22]。研究表明,逆境胁迫能够诱导植物的基因表达发生改变,正常蛋白合成受阻,逆境应激蛋白被诱导合成,应激蛋白的协同作用可以清除变性蛋白、维持细胞正常代谢[23]。所以重金属胁迫诱导可溶性蛋白含量增加,可能是植物抵抗重金属毒害的一种解毒机制[24]。本试验中,可溶性蛋白含量的下降可能是由于Co2+在苜蓿幼苗体内过量积累而导致细胞结构遭到破坏而引起的。同时,Co胁迫增加了苜蓿幼苗的代谢强度,进而增加了苜蓿幼苗对营养和能量的需求,对可溶性糖的需求和利用量增加,所以可溶性糖含量下降。Co2+在苜蓿幼苗体内的过量积累,引起蛋白质变性,也造成了可溶性蛋白含量下降,蛋白水解酶活性也受到了抑制。在低浓度Co胁迫下,游离脯氨酸含量升高以缓解Co胁迫引起的渗透胁迫,在高浓度Co胁迫下,苜蓿幼苗体内的渗透调节平衡被打破,游离脯氨酸含量下降。
在正常生理条件下,植物体内的抗氧化酶促系统和非酶促系统共同发挥作用,使得体内的活性氧代谢处于动态平衡[25]。植物遭受逆境胁迫后,体内活性氧(reactive oxygen species,ROS)代谢平衡会被打破,ROS大量产生并积累,ROS会以极强的氧化性造成细胞膜脂过氧化反应,导致膜系统损伤和细胞氧化,并大量积累过氧化产物MDA,从而引起植物的氧化伤害[26]。本试验中,在低浓度Co胁迫(0.25和0.50 mmol/L)下,紫花苜蓿幼苗的SOD、APX、GPX、CAT活性均与CK差异不显著,在1.00 mmol/L Co胁迫浓度下,紫花苜蓿幼苗的SOD、APX、GPX活性均显著升高,CAT活性开始下降,之后随着Co胁迫浓度的增大,SOD、APX、GPX、CAT活性均下降,说明Co胁迫对苜蓿幼苗抗氧化酶系统造成了损伤。0.25 mmol/L Co胁迫对紫花苜蓿幼苗的活性氧代谢无显著影响,Co胁迫浓度达到0.50 mmol/L时,紫花苜蓿幼苗的活性氧代谢发生紊乱,O2·-产生速率、OH·浓度、H2O2及MDA含量均显著升高,说明Co胁迫对紫花苜蓿幼苗的质膜结构造成了严重的伤害,这与王松华等[27]的结果一致,说明重金属胁迫诱导膜脂过氧化是紫花苜蓿受害表现的普遍现象。
References:
[1]Chaney R L, Malik M, Li Y M,etal. Phytoremediation of soil metals. Current Opinions in Biotechnology, 1997, 8: 279-284.
[2]Meng Y X, Wang S H, Wang J C,etal. Influences of CoCl2on the growth and seedling physiological indexes ofHordeumvulgareunder NaCl stress. Acta Prataculturae Sinica, 2014, 23(3): 160-166.
[3]Locke J M, Bryce J H, Morris P C. Contrasting effects of ethylene perception and biosynthesis inhibitors on germination and seedling growth of barley (HordeumvulgareL.) . Journal of Experimental Botany, 2000, 51: 1843-1849.
[4]Hansen H, Larssen T, Seip H M,etal. Trace metals in soils at four sites in southern china. Water, Air, and Soil Pollution, 2001, 130: 1721-1726.
[5]Hewitt E J. Effect of mineral deficiencies and excesses on growth and composition. In: Bould C, Hewitt E J, Needham P,etal. Diagnosis of Mineral Disorders in Plants[M]. London: Prinipals,1983: 54-110.
[6]Xing G X, Zhu J G. Soil Trace Elements and Rare Earth Elements Chemistry[M]. Beijing: Science Press, 2003.
[7]China National Environmental Monitoring Centre. China Background Value of Soil Elements[M]. Beijing: China Environmental Science Press, 1990.
[8]Wang Y, Wei F S H. Soil Environmental Elements Chemistry[M]. Beijing: China Environmental Science Press, 1995.
[9]Guo X, Jie X M, Li M,etal. Effects of selenium and cobalt fertilization on nutrition levels of alfalfa hay. Plant Nutrition and Fertilizer Science, 2010, 16(2): 439-448.
[10]Aery A C, Jagetiya B L. Effect of cobalt treatments on dry matter production of wheat and DTPA extractable cobalt content in soils. Communications in Soil Science and plant Analysis, 2002, 31: 9-10.
[11]Zou Q. Plant Physiology Experiment Guidance[M]. Beijing: China Agriculture Press, 2000.
[12]Zhang Z G, Rui Q, Xu L L. Relationship between endopeptidases and H2O2during wheat leaves aging. Acta Botany Sinica, 2001, 43: 127-131.
[13]André Dias de Azevedo Neto, José Tarquinio Prisco, Joaquim Enéas-Filho,etal. Hydrogen peroxide pre-treatment induces salt-stress acclimation in maize plants. Journal of Plant Physiology, 2005, 162: 1114-1122.
[14]Kou J T, Shi S L, Hu G X,etal. Effect ofOdontothripslotion reactive oxygen metabolism ofMedicagosativa. Journal of Nuclear Agricultural Sciences, 2013, 27(12): 1948-1954.
[15]Zhou W H, Shi S L, Kou J T. Effect of nitric oxide on alfalfa seed germination under NaCl stress. Journal of Nuclear Agricultural Sciences, 2012, 26(4): 710-716.
[16]Ding Y, Xie H R, Wei Q,etal. Impacts of heavy metal stress on alfalfa germination. Journal of Nanchang Institute of Aeronautical Technology (Natural Science), 2004, 18(4): 45-47, 53.
[17]Zhang C R, Li H, Xia L J,etal. Effect of zinc cadmium germination ofMedicagosativaseeds and growth of seeding. Acta Agriculturae Boreali-sinica, 2005, 20(1): 96-99.
[18]Yu Y H, Wang W Q, Zheng C X,etal. The effect of Pb2+, Ca2+& Cd2+in soil on sprout and growth of alfalfa seeds. Journal of Xinjiang Agricultural University, 2006, 29(2): 58-61.
[19]Ci E, Gao M, Wang Z F,etal. Effects of cadmium on seed germination and growth of alfalfa. Chinese Journal of Eco-Agriculture, 2007, 15(1): 96-98.
[20]Gegg M E, Beltran B, Salas-Pino S,etal. Differential effect of nitric oxide on glutathione metabolism and mitochondrial function in astrocytes and neurons: implications for neuroprotection/neurodegeneration. Journal of Neurochemistry, 2003, 86(1): 228-237.
[21]Zhou W H, Shi S L, Kou J T. Effects of exogenous nitric oxide on the growth and nitrogen metabolism of alfalfa seedlings under salt stress. Chinese Journal of Applied Ecology, 2012, 23(11): 3003-3008.
[22]Poustini K, Siosemardeh A, Ranjbar M. Proline accumulation as a response to salt stress in 30 wheat (TriticumaestivumL.)cultivars differing in salt tolerance. Genetic Resources and Crop Evolution, 2007, 54: 925-934.
[23]He Z L, Wang H C. The emergence of salt-induced proteins in alfalfa under NaCl stress. Acta Phytophysiologica Sinica, 1991, 17: 71-79.
[24]Hong R Y, Yang G X, Liu D H,etal. Effects of cadmium on the growth and physiological and biochemical reactions of wheat seedlings. Acta Agriculturae Boreali-sinica, 1991, 6(3): 70-75.
[25]Zhou W H, Shi S L, Kou J T. Exogenous salicylic acid on alleviating salt stress in alfalfa seedlings. Acta Prataculturae Sinica, 2012, 21(3): 171-176.
[26]Zhao T H, Sun J W, Fu Y. Advances of research on metabolism of plant reactive oxygen species and exogenous regulation under abiotic stresse. Corps, 2008, 3: 10-13.
[27]Wang S H, Zhang H, He Q Y. Effects of copper stress onMedicagosativaseedlings leaf antioxidative system. Chinese Journal of Applied Ecology, 2011, 22(9): 2285-2290.
参考文献:
[2]孟亚雄, 王世红, 汪军成, 等. CoCl2对NaCl胁迫下大麦生长及幼苗生理指标的影响. 草业学报, 2014, 23(3): 160-166.
[6]邢光熹, 朱建国. 土壤微量元素和稀土元素化学[M]. 北京: 科学出版社, 2003.
[7]中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990.
[8]王云, 魏复盛. 土壤环境元素化学[M]. 北京: 中国环境科学出版社, 1995.
[9]郭孝, 介晓磊, 李明, 等. 硒、钴对苜蓿青干草营养水平影响的研究. 植物营养与肥料学报, 2010, 16(2): 439-448.
[11]邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[14]寇江涛, 师尚礼, 胡桂馨, 等. 牛角花齿蓟马为害对紫花苜蓿活性氧代谢的影响. 核农学报, 2013, 27(12): 1948-1954.
[15]周万海, 师尚礼, 寇江涛. 一氧化氮对NaCl胁迫下苜蓿种子萌发的影响. 核农学报, 2012, 26(4): 710-716.
[16]丁园, 谢海荣, 魏洽, 等. 重金属胁迫对紫花苜蓿种子萌发的影响. 南昌航空工业学院学报(自然科学版), 2004, 18(4): 45-47, 53.
[17]张春荣, 李红, 夏立江, 等. 镉、锌对紫花苜蓿种子萌发及幼苗的影响.华北农学报, 2005, 20(1): 96-99.
[18]余艳华, 王文全, 郑春霞, 等. 土壤中Pb2+,Ca2+,Cd2+对苜蓿种子发芽和生长的影响. 新疆农业大学学报, 2006, 29(2): 58-61.
[19]慈恩, 高明, 王子芳, 等. 镉对紫花苜蓿种子萌发与幼苗生长的影响研究.中国生态农业学报, 2007, 15(1): 96-98.
[21]周万海, 师尚礼, 寇江涛. 盐胁迫下外源NO对苜蓿幼苗生长及氮代谢的影响. 应用生态学报, 2012, 23(11): 3003-3008.
[23]贺志理, 王洪春. 盐胁迫下苜蓿中盐蛋白的诱导产生. 植物生理学报, 1991, 17: 71-79.
[24]洪仁远, 杨广笑, 刘东华, 等. 镉对小麦幼苗的生长和生理生化反应的影响. 华北农学报, 1991, 6(3): 70-75.
[25]周万海, 师尚礼, 寇江涛. 外源水杨酸对苜蓿幼苗盐胁迫的缓解效应. 草业学报, 2012, 21(3): 171-176.
[26]赵天宏, 孙加伟, 付宇. 逆境胁迫下植物活性氧代谢及外源调控机理的研究进展. 作物杂志, 2008, 3: 10-13.
[27]王松华, 张华, 何庆元. 铜胁迫对紫花苜蓿幼苗叶片抗氧化系统的影响. 应用生态学报, 2011, 22(9): 2285-2290.
张虎, 寇江涛, 师尚礼. 紫花苜蓿种子萌发对钴胁迫的生理生化响应. 草业学报, 2015, 24(9): 146-153.
ZHANG Hu, KOU Jiang-Tao, SHI Shang-Li. Physiological and biochemical responses ofMedicagosativaseed to cobalt stress. Acta Prataculturae Sinica, 2015, 24(9): 146-153.
通讯作者*Corresponding author. E-mail: shishl@gsau.edu.cn
作者简介:张虎(1978-),男,甘肃镇原人,助教,在读硕士。E-mail: zhangh@gsau.edu.cn
基金项目:国家现代牧草产业技术体系建设专项(CARA-35),全国种质资源保种(NB2130135)和农业部行业专项“牧区优质高效饲草生产利用技术研究与示范”(201003023)资助。
收稿日期:2015-03-17;改回日期:2015-04-20
DOI:10.11686/cyxb2015148http://cyxb.lzu.edu.cn
