两株紫花苜蓿根际芽孢杆菌的筛选及生防效果研究
2016-01-28刘莎莎程园园张丹王晓丹刘佳莉郭长虹
刘莎莎,程园园,张丹,王晓丹,刘佳莉,郭长虹
(哈尔滨师范大学生命科学与技术学院,分子细胞遗传与遗传育种黑龙江省重点实验室,黑龙江 哈尔滨 150025)
两株紫花苜蓿根际芽孢杆菌的筛选及生防效果研究
刘莎莎**,程园园**,张丹,王晓丹,刘佳莉,郭长虹*
(哈尔滨师范大学生命科学与技术学院,分子细胞遗传与遗传育种黑龙江省重点实验室,黑龙江 哈尔滨 150025)
摘要:从紫花苜蓿根际土中分离出2株芽孢杆菌(Bacillus spp.)菌株CYY-6和CYY-42,并评价了其对尖孢镰刀菌(Fusarium oxysporum)的抑制作用,及其对由尖孢镰刀菌引起的苜蓿根腐病的防治效果。经过形态观察、16S rDNA序列分析和生理生化鉴定,确定菌株CYY-6为地衣芽孢杆菌(Bacillus licheniformis),CYY-42为短短芽孢杆菌(Brevibacillus brevis)。同时检测发现这2株芽孢杆菌均能不同程度地合成嗜铁素。在平板对峙实验中,2株菌株均能对尖孢镰刀菌产生拮抗作用,并产生抑菌带,抑菌率分别为49.3%和56.3%。且其发酵液可以致使尖孢镰刀菌菌丝及孢子生长异常,出现菌丝扭曲、断裂、破碎,孢子数量明显减少等现象。在盆栽实验中,2株菌株对由尖孢镰刀菌引起的紫花苜蓿根腐病的相对防效分别为57.55%和64.03%,在紫花苜蓿根腐病防治方面具有较好的应用潜力。
关键词:芽孢杆菌;紫花苜蓿;生物防治;尖孢镰刀菌;根腐病
Isolation, identification, and biocontrol effects ofBacillusspp. from the rhizosphere of alfalfa
LIU Sha-Sha**, CHENG Yuan-Yuan**, ZHANG Dan, WANG Xiao-Dan, LIU Jia-Li, GUO Chang-Hong*
KeyLaboratoryofMolecularCytogeneticsandGeneticBreedingofHeilongjiangProvince,CollegeofLifeScienceandTechnology,HarbinNormalUniversity,Harbin150025,China
Abstract:The aims of this study were to identify two Bacillus spp., CYY-6 and CYY-42, isolated from the rhizosphere of alfalfa, and to evaluate their ability to inhibit Fusarium oxysporum, the causal pathogen of alfalfa root rot. Based on physiological, biochemical, morphological, and 16S rDNA sequencing analyses, strain CYY-6 was identified as Bacillus licheniformis and CYY-42 as Brevibacillus brevis. Both strains were able to synthesize siderophores, although at different levels. In a dual culture assay, both strains inhibited the growth of F. oxysporum. Based on the inhibition zones, the inhibitory rates of CYY-6 and CYY-42 against F. oxysporum were 49.3% and 56.3%, respectively. The fermentation broth of each strain resulted in deformed growth of the mycelia and spores of F. oxysporum. The mycelia were twisted, broken, or fragmented, and the number of spores was significantly decreased. Strains CYY-6 and CYY-42 showed 57.55% and 64.03% inhibition of alfalfa root rot in pot experiments, indicating that both strains have potential applications in controlling alfalfa root rot.
Key words:Bacillus spp.; alfalfa (Medicago sativa); biocontrol; Fusarium oxysporum; root rot
紫花苜蓿(Medicagosativa)是世界上栽培最广的优质多年生豆科牧草,具有产草量高、再生性强、利用年限长、适口性强、营养丰富等优点。至今,紫花苜蓿在我国的种植历史已超过两千年,是我国种植面积最大的牧草[1-3]。然而随着种植年限和种植面积的增加,紫花苜蓿病害也随之出现,如根腐病、褐斑病、霜霉病、白粉病等,其中紫花苜蓿根腐病(root rot)是一种世界性病害,会危害紫花苜蓿的各个生长时期,主要症状表现为根部出现坏死斑,根茎腐烂中空,侧根大量腐烂死亡,茎叶全部枯死,严重影响紫花苜蓿的品质和产量[4-6]。据估计,全世界紫花苜蓿每年因根腐病造成的产量损失在20%~40%[5],而通过对黑龙江省8个地区的紫花苜蓿根腐病进行调查,发现该病害发生普遍,严重地块发病率高达92%,这种病害还会随着种植面积和年限的增长而加重[7]。虽然紫花苜蓿根腐病病原复杂,但据研究表明多与镰刀菌有关[4,8-9]。
防治苜蓿根腐病的主要方法有选育苜蓿抗病品种、采取农业措施和使用化学杀菌剂等[5],但由于苜蓿根腐病属于土传病害,上述方法的防治效果往往不太理想。因此,筛选对紫花苜蓿根腐病菌(镰刀菌)有较强抗性的生防菌株并用于紫花苜蓿生产,将会有效解决紫花苜蓿根腐病病害问题,同时对紫花苜蓿产业的可持续发展具有重要意义。生防菌株一般通过产生抗真菌代谢物或通过诱发系统抗性来防治植物病害[10]。芽孢杆菌是一类好氧或厌氧、杆状、产芽孢、革兰氏阳性菌[11],能够产生多种抗菌物质,如嗜铁素、溶菌酶(蛋白酶、几丁质酶、纤维素酶)和抗真菌脂肽等[10],因其营养要求简单、繁殖速度快,能产生抗逆耐热的芽孢,有利于生防菌剂的制备和剂型的加工生产[12],因此芽孢杆菌在生物防治方面被广泛地研究应用。目前,还没有关于应用芽孢杆菌防治紫花苜蓿根腐病的报道。
本研究从紫花苜蓿根际土中分离鉴定了2株芽孢杆菌菌株,评价其对尖孢镰刀菌引起的紫花苜蓿根腐病的防治效果,为开发苜蓿根腐病的生防菌剂奠定基础。
1材料与方法
1.1 土壤样品采集
供试土样于2013年9月中旬取于哈尔滨师范大学试验田中生长的紫花苜蓿根际,将土样带回实验室4℃保存。
1.2 植物病原真菌
尖孢镰刀菌(Fusariumoxysporum)分离自田间患根腐病的大豆病根,属大豆专化型,由黑龙江八一农垦大学农学院植物免疫研究室提供。
1.3 培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、溶菌肉汤培养基(luria-bertani,LB)[13-15],铬奥醇培养基(chrome azurol sulphonate,CAS)[16],改良的金氏B培养基(Modified King’s B,MKB)[17]。
1.4 土样中芽孢杆菌的分离纯化
称取5 g土样,加入盛有玻璃珠和45 mL无菌水的锥形瓶中,在培养摇床上剧烈振荡30 min(37℃)后于80℃的水浴锅中保持15 min。将悬浊液稀释10-3、10-4和10-5,从其中各取100 μL于PDA平板上涂布,置于37℃恒温箱内培养1~3 d,待平板上出现较多单菌落时,在无菌条件下挑取菌落形态、颜色等性状不同的单菌落于PDA平板划线纯化至第6代,制成甘油菌-80℃保存。
1.5 分离菌株的鉴定
1.5.1分离菌株的16S rDNA序列分析采用CTAB/NaCl方法提取细菌DNA。根据原核生物16S rDNA保守序列通用引物。
F8:5′-AGAGTTTGATCCTGGCTCAG-3′;F1541:5′-AAGGAGGTGATCCAGCCGCA-3′进行扩增。扩增条件:94℃变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min(共30个循环);72℃延伸10 min。将所得产物送至上海生工生物工程股份有限公司进行DNA测序,得到16S rDNA序列后,通过一套在DNA数据库中进行相似性比较的分析工具(basic local alignment search tool,BLAST),与数据库中的已知序列进行同源性分析。
1.5.2生理生化鉴定参照《常见细菌系统鉴定手册》[14]和《南伯杰细菌鉴定手册》[15]对菌株进行形态学观察及生理生化鉴定。
1.6 芽孢杆菌嗜铁素合成能力的分析
定性测定参照Schwyn和Neilands[16]的方法,将已分离的菌株接种于CAS培养基上,28℃培养2~3 d,观察菌落周围培养基上有无形成橘黄色的透明晕圈。
定量测定采用水溶性色素产生菌铁载体的定量检测法[17],等体积的样品与CAS检测液反应后,在630 nm处测得的吸光值为A,对照为去离子水加CAS检测液,测得的值记作Ar,样品中嗜铁素的相对含量为A/Ar。
1.7 分离菌株抑菌能力测定
1.7.1平板对峙实验采用平板对峙法[18],将植物病原真菌尖孢镰刀菌接种于PDA平板中央,在平皿四周距边缘2 cm处接种分离菌株,以只接种尖孢镰刀菌为对照。28℃下恒温培养5 d,测量尖孢镰刀菌菌落半径,并计算抑菌率:
抑菌率=[(对照菌落半径-处理菌落半径)/对照菌落半径]×100%
1.7.2发酵液对病原菌丝及孢子生长的抑制作用PDA板活化尖孢镰刀菌,刮取培养基表面菌丝,接种于50 mL PDA液体培养基中。同时,取200 μL过夜培养的细菌发酵液也接入PDA液体培养基中,对照组不接种细菌发酵液。28℃振荡培养2 d,光学显微镜下观察不同处理尖孢镰刀菌菌丝及孢子的生长情况[19]。
1.7.3分离菌株对盆栽紫花苜蓿的防病作用参照张璐等[20]的方法,并稍作修改。紫花苜蓿种子经表面杀菌后密播于无菌蛭石中,45 d后,将植株根部用石英砂揉搓制造伤口,分别浸入无菌水和培养2 d的尖孢镰刀菌孢子悬浮液中40 min,将植株重新种回无菌蛭石(每盆10株),并实施如下处理:(a)无菌水;(b)接种尖孢镰刀菌孢子悬浮液和无菌水;(c)接种尖孢镰刀菌孢子悬浮液且施用CYY-6菌悬液;(d)接种尖孢镰刀菌孢子悬浮液且施用CYY-42菌悬液。(c)和(d)处理组每2 d用分离菌株制成的菌悬液灌根,(a)和(b)处理组浇灌等量的无菌水。每处理4个重复,接种10 d后观察记录病情。参照陈雅君和崔国文[9]的病害严重度分级标准,将紫花苜蓿根腐病分为5级:0级为健康植株,无枯萎或腐烂症状;1级为主根或根茎局部出现病斑,面积低于10%,地上部分生长良好;2级为主根及根茎出现连片病斑,面积在10%~30%,地上部分生长较好;3级为30%~50%,主根及根茎出现病斑,地上生长很差;4级为主根及根茎部病斑面积超过50%,全株枯死。根据病害严重度分级标准计算不同处理的病情指数和防治效果[19]。
1.8 数据统计分析
嗜铁素合成含量为平均值±SE,使用SPSS 16.0进行统计分析,多重比较采用LSD法。
2结果与分析
2.1 芽孢杆菌的分离与鉴定
从试验田种植的紫花苜蓿根际土中分离出2株芽孢杆菌菌株CYY-6和CYY-42,用PDA培养基纯化后观察菌落形态,CYY-6菌落扁平,圆形或不规则形,边缘裂片状;CYY-42菌落圆形,边缘整齐或啮蚀状。2菌株在接触酶反应、柠檬酸盐利用、葡萄糖产酸、明胶液化实验中均呈阳性;CYY-6在淀粉水解、V-P测定、厌氧生长实验中均呈阳性,而CYY-20均呈阴性;CYY-6在pH 5.5和9.0及5%和7%(W/V)NaCl的培养基上均能生长,而CYY-42均不能生长(表1)。将已测得的CYY-6和CYY-42菌株的16S rDNA序列与相近种属的16S rDNA进行比对(图1),菌株CYY-6序列与Bacilluslicheniformisstrain KIBGE-IB4与Brevibacillusbrevisstrain MH1(150419319)的同源性达97%,再结合其菌落形态及生理生化特征初步鉴定CYY-6为地衣芽孢杆菌(Bacilluslicheniformis)、CYY-42为短短芽孢杆菌(Brevibacillusbrevis)。

表1 菌株生理生化特征鉴定
注:+,阳性;-,阴性。
Note: +, Positive; -, Negative.(281335878)的同源性达99%,菌株CYY-42序列
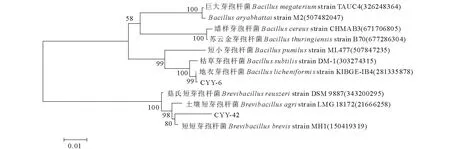
图1 16S rDNA基因序列系统发育树Fig.1 Phylogenetic tree derived from 16S rDNA gene sequence of CYY-6 and CYY-42 分支点上的数字为自展支持率(%)。括号内序号为菌株在GenBank数据库中的登录号。标尺代表序列分歧度。Numbers at each branch points indicate the percentage supported by bootstrap (%). Those in parentheses are the GenBank accession number. Bar represents sequence divergence.
2.2 分离菌株嗜铁素合成能力分析
菌株CYY-6和CYY-42在CAS检测培养基上均能够形成橘黄色透明晕圈,说明两菌株都具有嗜铁素合成能力。对两菌株的嗜铁素合成能力进行定量测定,一般A/Ar值越小,其合成嗜铁素的能力越强。如图2所示,CYY-6嗜铁素合成量为(2.577±0.091),而CYY-42嗜铁素合成量为(1.067±0.006),由此可知CYY-42合成嗜铁素能力显著强于CYY-6(P<0.05)。

图2 分离菌株嗜铁素合成量Fig.2 Siderophore synthesis of isolates *表示显著水平(P<0.05)。 * indicates significant different level (P<0.05).
2.3 分离菌株抑菌能力测定
在PDA平板上,菌株CYY-6和CYY-42对尖孢镰刀菌的生长都有拮抗作用。如图3可知,菌株CYY-42对尖孢镰刀菌的抑制效果好于CYY-6,抑菌带更加明显。CYY-6和CYY-42的抑菌率分别为49.3%和56.3%。

图3 分离菌株对尖孢镰刀菌的拮抗作用Fig.3 Antagonism of isolates against F. oxysporuma. 对照,b. CYY-6,c. CYY-42。a. Control, b CYY-6, c. CYY-42.
菌株CYY-6和CYY-42的发酵液对尖孢镰刀菌菌丝和孢子生长均有明显的抑制作用。在光学显微镜下观察,对照组(CK)菌丝大量生长,边缘光滑,可见清晰的分支结构,并伴有大量孢子生成。与对照相比,菌株CYY-6处理过的尖孢镰刀菌菌丝明显减少,菌丝体扭曲、断裂,且孢子数量也明显减少;CYY-42处理过的菌丝断裂、破碎,细胞壁溶解、原生质泄露,菌丝量和孢子量也明显减少(图4)。

图4 尖孢镰刀菌菌丝及孢子受拮抗菌作用后的异常形态(40×)Fig.4 Abnormal forms of the F. oxysporum mycelia and spores inhibited by the Bacillus spp. in PDA in vitro (40×) a. 正常尖孢镰刀菌菌丝及孢子,b. 受CYY-6抑制的菌丝和孢子,c. 受CYY-42抑制的菌丝和孢子。a. Normal mycelia and spores of F. oxysporum, b. Abnormal mycelia and spores of F. oxysporum inhibited by CYY-6, c. Abnormal mycelia and spores of F. oxysporum inhibited by CYY-42.
分离菌株生防能力的盆栽试验表明,仅破坏植株根部不接菌(图5a),植株根、茎、叶均生长良好,无发病症状;仅接种尖孢镰刀菌的紫花苜蓿(图5b),最初几天部分植株叶片开始逐渐枯萎,10 d后几乎全部发病,植株根部发黑、腐烂、死亡,茎和叶几乎全部枯死,病情指数达到86.88%;在用菌株CYY-6和CYY-42接种10 d后, 发病症状有所减轻,植株根部出现黑褐色斑点,但并未腐烂、死亡,根部生长良好,植株少量叶片干枯,但茎和叶整体长势良好,病情指数分别为36.88%和31.25%(图5c,d)。由此可见,与仅接种尖孢镰刀菌的对照相比,菌株CYY-6和CYY-42都有防病效果,相对防效分别为57.55%和64.03%。

图5 分离菌株对苜蓿根腐病的防治作用Fig.5 Biocontrol of root rot in alfalfa with bacterial isolates a. 破坏根部,加无菌水;b. 接种尖孢镰刀菌,加无菌水;c. 接种尖孢镰刀菌且施用CYY-6;d. 接种尖孢镰刀菌且施用CYY-42。a. All plants treated with sterile water; b. All plants treated with F. oxysporum alone; c. All plants treated with F. oxysporum and isolates CYY-6; d. All plants treated with F. oxysporum and isolates CYY-42.
3讨论
在可持续农业生产中,应用芽孢杆菌防治植物病害是一个极具潜力的途径[21]。本研究从紫花苜蓿根际土中分离出地衣芽孢杆菌CYY-6和短短芽孢杆菌CYY-42,评价了其对尖孢镰刀菌的拮抗作用及由其引起的紫花苜蓿根腐病的防治效果,结果表明,两菌株显著减轻了人工接种尖孢镰刀菌导致的紫花苜蓿根腐病的病情。
尖孢镰刀菌是一种世界性分布的土传病原真菌,既可在土壤中存活又能侵染植物。国内外已报道的受尖孢镰刀菌危害严重的植物包括苜蓿、甜椒(Capsicumfrutescens)、花生(Arachishypogaea)、西瓜(Citrulluslanatus)、香蕉(Musaparadisiaca)、高粱(Sorghumbicolor)等[5,22-24]。在平板对峙实验中,菌株CYY-6和CYY-42均能有效抑制尖孢镰刀菌生长,并产生抑菌带,抑菌率分别达到49.3%和56.3%。两菌株表现出的拮抗活性可能是由于其产生的抗真菌代谢物的作用,如嗜铁素,其通过螯合反应,释放出难溶性的铁,形成嗜铁素-铁螯合物,并将铁转移到体内,以满足微生物自身的生长需求,从而降低环境中的铁浓度,由此病原菌因缺铁而不能正常的生长繁殖,进而控制植物病害发生[25]。本研究中,菌株CYY-42的嗜铁素合成能力强于CYY-6,且菌株CYY-42对尖孢镰刀菌的拮抗效果也比CYY-6好,这一研究结果与Duijff等[26]和许煜泉等[27]发现的现象相似,细菌合成嗜铁素的含量与拮抗病原菌的能力有关,且呈正相关[28]。菌株CYY-6和CYY-42的发酵液对尖孢镰刀菌菌丝和孢子生长有明显的拮抗作用,Pual等[29]和谢栋等[30]也表明芽孢杆菌能够使真菌菌丝畸形、断裂,细胞壁溶解,孢子不萌发,这可能与拮抗菌分泌的抗菌肽类或蛋白类物质有关。芽孢杆菌分泌的几丁质酶具有降解几丁质的能力,而几丁质是病原真菌细胞壁的主要结构组成,细菌菌株通过溶解植物病原真菌细胞壁来发挥拮抗作用[23],因此几丁质酶可能是生物防治植物病原真菌最重要的物质,Basha和Ulaganathan[31]也表现,新月弯孢菌(Curvularialunata)菌丝的断裂和细胞壁的溶解与芽孢杆菌菌株分泌的几丁质酶相关。
生防芽孢杆菌对植物病害的防治机制主要包括拮抗、竞争、诱导植物抗性等多种方式[21]。无生防菌株时,病原真菌依靠植物提供的生存条件进行生长繁殖,有生防菌株存在时,生防菌株与病原真菌竞争,争夺有利生态位,形成菌膜屏障,阻止病原真菌进一步侵染植物[19]。Lee等[32]筛选到的地衣芽孢杆菌对番茄灰霉病具有显著防治效果,张璐等[20]从黄瓜根际土分离到的短短芽孢杆菌DS-1对苗期黄瓜枯萎病的生防效果显著。虽然已经报道了地衣芽孢杆菌和短短芽孢杆菌对一些植物病害有生防活性,但本研究首次报道地衣芽孢杆菌和短短芽孢杆菌能显著减轻由尖孢镰刀菌引起的紫花苜蓿根腐病病情。李文英等[23]发现香蕉根际芽孢杆菌PAB-1和PAB-2对由尖孢镰刀菌引起的香蕉枯萎病的防效为18.8%和46.9%。本研究也表明,从紫花苜蓿根际筛选出的地衣芽孢杆菌菌株CYY-6和短短芽孢杆菌菌株CYY-42对由尖孢镰刀菌引起的紫花苜蓿根腐病的相对防效分别达到了57.55%和64.03%。
本研究筛选出2株紫花苜蓿根际芽孢杆菌CYY-6和CYY-42,它们对由尖孢镰刀菌引起的紫花苜蓿根腐病都表现出生防效果,这可能是嗜铁素、蛋白类或抗菌肽类物质等多种抗真菌代谢物共同作用的结果,其抗菌物质和抑菌机理的确定还有待于深入研究。由于本研究是在盆栽条件下进行的,紫花苜蓿的生长条件及生长期与大田存在一定差异,其实际的生防效果尚待后续田间试验验证。
References:
[1]Cao H, Zhang H L, Gai Q H,etal. Test and comprehensive assessment on the performance of 22 alfalfa varieties. Acta Prataculturae Sinica, 2011, 20(6): 219-229.
[2]Han H W, Sun L N, Yao T,etal. Effects of bio-fertilizers with different PGPR strain combinations on yield and quality of alfalfa. Acta Prataculturae Sinica, 2013, 22(5): 104-112.
[3]Peng L Q, Li X Y, Qi X,etal. The relationship of root traits with persistence and biomass in 10 alfalfa varieties. Acta Prataculturae Sinica, 2014, 23(2): 147-153.
[4]Meng Y, Li M Q. Research progress on alfalfa crown and root rot pathogeny and their control. Pratacultural Science, 2005, 22(5): 89-91.
[5]Cao L X, Zhao C H, Kong Q Q,etal. Research progress on alfalfa root rot pathogeny and their control. Inner Mongolia Agricultural Science and Technology, 2006, (3): 36-37.
[6]Chen Y J, Liu X M, Cui G W,etal. Research progress on alfalfa root rot. Grassland of China, 2000, (1): 51-56.
[7]Li M Q, Yang B S, Hou J,etal. Toxicity measurement of carbendazim onFusariumspp. in alfalfa. Acta Agrestia Sinica, 2002, 10(4): 270-273.
[8]Salter R, Miller-Garvin J E, Viands D R. Breeding for resistance to alfalfa root rot caused byFusariumspecies. Crop Science, 1994, 34(5): 1213-1217.
[9]Chen Y J, Cui G W. Research and pathogenic isolation on alfalfa root rot in Heilongjiang province. Grassland of China, 2001, 23(3): 78-79.
[10]Ongena M, Jacques P.Bacilluslipopeptides: versatile weapons for plant disease biocontrol. Trends Microbiol, 2008, 16: 115-125.
[11]Liu G H, Lin N Q, Lin Y Z,etal. Advances in taxonomy and application of genusBacillus. Fujian Journal of Agricultural Sciences, 2008, 23(1): 92-99.
[12]Manimaran P, Mohan K M, Sekar R. Antagonistic activity ofBacillusspecies against basal rot disease of onion. Journal of Mycology and Plant Pathology, 2011,41(2):241.
[13]Sicuia O A, Oancea F, Cornea C P. New screening methods for evaluation ofFusariumsporulationinhibition byBacillusbiocontrol strains. Scientific Papers, UASVM Bucharest, Series F Biotechnologies, 2012,16:67-72.
[14]Dong X Z, Cai M Y. Common Bacterial Identification Manual[M]. Beijing: Science Press, 2001.
[15]Buchanan R E, Gibbons N E. Bergey’s Manual of Systematic Bacteriology (Eighth Edition)[M]. Beijing: Science Press, 1984.
[16]Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 1987,160:47-56.
[17]Wang P, Dong B, Li F D,etal. Detection and determination of the siderophores produced by wheat rhizobacteria. Microbiology China, 1994, 21(6): 323-326.
[18]Fang Z D. Plant Disease Research Method(Third Edition)[M]. Beijing: Agriculture Press, 1998.
[19]Zhang S M. Screening of Antifungal Endophytic Bacteria Against Tomato Gray and Leaf Mold and Biocontrol Mechanism[D]. Harbin: Northeast Agricultural University, 2013.
[20]Zhang L, Ding Y Q, Du B H,etal. Identification and biocontrol effects of antagonistic bacterium DS-1 strain againstFusariumoxysporumf. sp. cucumerinum. Acta Horticulturae Sinica, 2010, 37(4): 575-580.
[21]Zhu M Y, Liu J, Du C M. Research progress of biological control in plant diseases byBacillusspp.Journal of Anhui Agricultural Science, 2012, 40(34): 16635-16658.
[22]Zhu Y J, Che J M, Xiao R F,etal. Growth characteristics ofFusariumoxysporumSchl.Chinese Agricultural Science Bulletin, 2007, 23(8): 373-376.
[23]Li W Y, Peng Z P, Yang S H,etal. Effects of plant growth-promoting rhizobacteria on growth and controllingFusarium-wilt disease of banana seedlings. Acta Horticulturae Sinica, 2012, 39(2): 234-242.
[24]Idris H A, Labuschagne N, Korsten L. Screening rhizobacteria for biological control ofFusariumroot and crown rot of sorghum in Ethiopia. Biological Control, 2007,40(1):97-106.
[25]Yu X M, Zheng F C. The development and utilization of siderophore on plant growth promotion and plant disease control. Chinese Agricultural Science Bulletin, 2007, 23(8): 507-510.
[26]Duijff B J, Meijer J W, Bakker P A H M,etal. Siderophore-mediated competition for iron and induced resistance in the suppression ofFusariumwilt of carnation by fluorescentPseudomonasspp. Netherlands Journal of Plant Pathology, 1993,99(5-6):277-289.
[27]Xu Y Q, Gao H, Tong G L,etal. Siderophore production and their activity againstPiriculariaoryzaebyPseudomonasJKD-2. Microbiology China, 1999, 26(3): 180-183.
[28]Chen S Y, Chen Z Y, Zhang R S. Screening and evaluation of antagonistic bacteria againstRhizoctoniasolani. Acta Phytophylacica Sinica, 2013, 40(3): 211-218.
[29]Paul D S, Joanne M W, Roberto K. Interactions betweenStreptomycescoelicolorandBacillussubtilis: role of surfactants in raising aerial structures. Journal of Bacteriology, 2006,188(13):4918-4925.
[30]Xie D, Peng J, Wang J H,etal. Purification and properties of antifungal protein X98III fromBacillussubtilis. Acta Microbiologica Sinica, 1998, 38(1): 13-19.
[31]Basha S, Ulaganathan K. Antagonism ofBacillusspecies (strain BC121) towardsCurvularialunata. Current Science, 2002, 82(12): 1457-1463.
[32]Lee J P, Lee S W, Kim C S,etal. Evaluation of figuretions ofBacilluslicheniformisfor the biological control of tomato gray mold caused byBotrytiscinerea. Biological Control, 2006,37(3):329-337.
参考文献:
[1]曹宏, 章会玲, 盖琼辉, 等. 22个紫花苜蓿品种的引种试验和生产性能综合评价. 草业学报, 2011, 20(6): 219-229.
[2]韩华雯, 孙丽娜, 姚拓, 等. 不同促生菌株组合对紫花苜蓿产量和品质的影响. 草业学报, 2013, 22(5): 104-112.
[3]彭岚清, 李欣勇, 齐晓, 等. 紫花苜蓿品种根部特征与持久性和生物量的关系. 草业学报, 2014, 23(2): 147-153.
[4]孟嫣, 李敏权. 苜蓿根和根颈腐烂病病原及防治研究进展. 草业科学, 2005, 22(5): 89-91.
[5]曹丽霞, 赵存虎, 孔庆全, 等. 紫花苜蓿根腐病病原及防治研究进展. 内蒙古农业科技, 2006, (3): 36-37.
[6]陈雅君, 刘学敏, 崔国文, 等. 紫花苜蓿根腐病的研究进展. 中国草地, 2000, (1): 51-56.
[7]李敏权, 杨宝生, 侯军, 等. 四种杀菌剂对苜蓿根和根颈腐烂病菌的室内毒力测定. 草地学报, 2002, 10(4): 270-273.
[9]陈雅君, 崔国文. 黑龙江省紫花苜蓿根腐病调查及病原分离. 中国草地, 2001, 23(3): 78-79.
[11]刘国红, 林乃铨, 林营志, 等. 芽孢杆菌分类与应用研究进展. 福建农业学报, 2008, 23(1): 92-99.
[14]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[15]布坎南R E, 吉本斯N E. 南伯杰细菌鉴定手册(第八版)[M]. 北京:科学出版社, 1984.
[17]王平, 董飚, 李阜棣, 等. 小麦根圈细菌铁载体的检测. 微生物学通报, 1994, 21(6): 323-326.
[18]方中达. 植病研究方法(第三版)[M]. 北京:农业出版社, 1998.
[19]张淑梅. 番茄灰霉病和叶霉病生防内生细菌的筛选及生防机理[D]. 哈尔滨:东北农业大学, 2013.
[20]张璐, 丁延芹, 杜秉海, 等. 黄瓜枯萎病病原拮抗细菌DS-1菌株鉴定及其生防效果研究. 园艺学报, 2010, 37(4): 575-580.
[21]朱明妍, 刘姣, 杜春梅. 芽孢杆菌生物防治植物病害研究进展. 安徽农业科学, 2012, 40(34): 16635-16658.
[22]朱育菁, 车建美, 肖荣凤, 等. 尖孢镰刀菌(FusariumoxysporumSch1)的生长特性. 中国农学通报, 2007, 23(8): 373-376.
[23]李文英, 彭智平, 杨少海, 等. 植物根际促生菌对香蕉幼苗生长及抗枯萎病效应研究. 园艺学报, 2012, 39(2): 234-242.
[25]余贤美, 郑服丛. 嗜铁素在促进植物生长及病害防治等方面的应用. 中国农学通报, 2007, 23(8): 507-510.
[27]许煜泉, 高虹, 童耕雷, 等. 假单胞菌株JKD-2分泌铁载体抑制稻瘟病菌. 微生物学通报, 1999, 26(3): 180-183.
[28]陈思宇, 陈志谊, 张荣胜. 水稻纹枯病菌拮抗细菌的筛选及鉴定. 植物保护学报, 2013, 40(3): 211-218.
[30]谢栋, 彭憬, 王津红, 等. 枯草芽孢杆菌抗菌蛋白X98III的纯化与性质. 微生物学报, 1998, 38(1): 13-19.
刘莎莎,程园园,张丹,王晓丹,刘佳莉,郭长虹. 两株紫花苜蓿根际芽孢杆菌的筛选及生防效果研究. 草业学报, 2015, 24(9): 96-103.
LIU Sha-Sha, CHENG Yuan-Yuan, ZHANG Dan, WANG Xiao-Dan, LIU Jia-Li, GUO Chang-Hong. Isolation, identification, and biocontrol effects ofBacillusspp. from the rhizosphere of alfalfa. Acta Prataculturae Sinica, 2015, 24(9): 96-103.
通讯作者*Corresponding author. E-mail:kaku3008@126.com
作者简介:刘莎莎(1988-),女,黑龙江鹤岗人,在读硕士。E-mail:liusha90923@163.com。 程园园(1987-),女,黑龙江大庆人,在读硕士。E-mail:cyy315335@163.com。**共同第一作者 These authors contributed equally to this work.
基金项目:国家自然科学基金项目(No.31470571;31170479),国家科技支撑计划项目(No.2011BAD17B04-2-1),黑龙江省科技攻关项目(No.GC12B304)和黑龙江省自然科学基金项目(No.C201142)资助。
收稿日期:2015-01-16;改回日期:2015-03-30
DOI:10.11686/cyxb2015026http://cyxb.lzu.edu.cn
