慢性肠道炎症促进肝癌的发展
2016-01-28易宏淦臧梦雅吴志远赵新明王维虎曲春枫
易宏淦,臧梦雅,吴志远,朱 正,赵新明,王维虎,曲春枫
(1.广州医科大学,广州 510182;2.中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京 100021;
3. 中国医学科学院肿瘤医院影像诊断科,北京 100021;4. 中国医学科学院肿瘤医院放射治疗科,北京 100021)
慢性肠道炎症促进肝癌的发展
易宏淦1,2,臧梦雅2,吴志远2,朱正3,赵新明3,王维虎4,曲春枫2
(1.广州医科大学,广州510182;2.中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京100021;
3. 中国医学科学院肿瘤医院影像诊断科,北京100021;4. 中国医学科学院肿瘤医院放射治疗科,北京100021)
【摘要】目的探讨慢性肠道炎症状态下菌群结构及构成改变对肝癌进展的影响。 方法 22只雄性乙肝病毒转基因小鼠在出生后第2周腹腔注射二乙基亚硝胺诱导小鼠原发性肝癌,随机分为慢性肠炎组(给予含2%葡聚糖硫酸钠的饮用水)和对照组(给予正常饮用水)。上述小鼠观察至22周龄。在此期间定期进行肝功能测定,收集粪便进行宏基因组测序。另将4只已发生肝癌的小鼠与7只8周龄肉眼及病理学未见肝癌的小鼠同笼(分2笼)饲养16周。 结果 DSS所诱导的慢性肠炎小鼠与正常饮用水小鼠相比肝功能无显著改变;DSS诱导的慢性肠炎组小鼠(n=10)在第22周龄时有9只发生弥漫性肉眼可见的肝癌,而正常饮用水小鼠(n=12)仅有2只发生肝癌,肿瘤发生率(P=0.002)和肿瘤数量(P=0.028)有显著差别;与正常饮用水小鼠相比,慢性肠炎组小鼠肠道菌群中,普雷沃氏菌属(P=0.022)和厌氧支原体属(P=0.014)显著减少;与已发生肝癌小鼠进行同笼饲养的小鼠(n=7)在24周龄时全部发生肉眼可见的肝癌。 结论 慢性肠道炎症状态下,肠道菌群改变可促进肝癌进展。
【关键词】慢性肠道炎症;肝癌;菌群改变
Chronic colitis induced by irritant dextran sodium sulphate
原发性肝癌(primary carcinoma of the liver,HCC)是世界范围内第三大恶性肿瘤。在我国,慢性乙肝病毒(hepatitis B virus,HBV)感染是肝癌发生的主要危险因素,生活环境的多种因素也影响着肝癌的发生发展[1-2]。近年来,欧美等国家的肝癌发病呈上升趋势,然而,亚洲包括我国的肝癌发病则呈下降趋势[3],有些临床的观察流行病学研究指出:这种肝癌的下降趋势与控制婴幼儿的慢性HBV感染相关[4-6]。毫无疑问,控制慢性HBV感染能够显著降低青少年肝癌以及其它肝病的发生[7],然而,我们以及其他研究者在江苏启东肝癌高发区现场人群中的研究表明,通过改善慢性HBV感染者的饮食结构及饮水水质,低年龄人群中肝癌发病率显著降低[8-9]。
饮食结构影响着肠道微生物种类及构成,由于肝脏与肠道的特殊解剖关系,肝脏经常接受来自肠道的多种抗原如细菌及其产物的刺激,在临床研究中发现,肠道的慢性炎症性疾病常伴有多个器官受累的肠外表现,肝胆系统是肠外病变所主要累及的器官[10]。肠道炎症常伴随肠道菌群紊乱,并随门静脉迁移至肝脏引起肝脏病变,表明肠道微环境中的协同因素将有可能影响着肝癌的发展进程,然而目前尚无直接的实验依据。
二乙基亚硝胺(diethylnirtosamine,DEN)是一种基因毒性肝脏致癌剂,在动物研究中,常用DEN来诱导动物的肝癌,以模拟人类肝癌发生过程[11-12]。1985年,Ohkusa等[13]报导了葡聚糖硫酸钠(dextran sodium sulphate,DSS)诱导的急性结肠炎,DSS结肠炎模型与人类炎症性肠病特别是溃疡性结肠炎的病理特征类似。本研究采用腹腔注射DEN在HBV转基因小鼠中诱导基因毒性以诱发原发性肝癌,通过给予含DSS饮用水造成慢性肠道炎症,探讨肠道慢性炎症时肠道菌群改变对肝癌发展的作用。
1材料和方法
1.1材料
1.1.1实验动物
无特定病原体级雄性HBV转基因小鼠,鼠龄6~8周,体重18~20 g,购自北京大学医学部实验动物中心【SCXK(京)2011-0012】,自行繁殖并饲养于中国医学科学院肿瘤医院实验动物中心【SYXK(京)2008-0025】。
1.1.2主要试剂
葡聚糖硫酸钠(DSS)相对分子量为36 000 ~ 50 000,购自美国MP Biomedicals公司。二乙基亚硝胺(DEN)粉末1 mg,购自美国Sigma公司。乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)购自上海科华生物工程股份有限公司。丙氨酸氨基转移酶(ALT)测定试剂盒(速率法)购自中生北控生物科技股份有限公司。粪便基因组DNA提取试剂盒(离心柱型)购自天根生化科技(北京)有限公司。λ DNA/Hind Ⅲ(即用型0.1 mg DNA/mL)购自天根生化科技(北京)有限公司。
1.2方法
1.2.1DEN诱导小鼠原发性肝癌
在HBV转基因小鼠在生后第2周按25 μg/g体重腹腔注射DEN,于小鼠5周龄时选择雄性小鼠进行尾静脉采血,采用乙型肝炎病毒表面抗原诊断试剂盒以确定小鼠体内存在乙型肝炎病毒表面抗原的持续表达。对于具有HBsAg持续表达的小鼠分别于小鼠第8周龄,14周龄和16周龄时,采用小鼠B超(visual sonics vevo770)进行肝脏扫描,并选择上述处理的5只小鼠,打开腹腔获取肝脏组织再检查是否存在肉眼可见肝脏结节,采用10%中性福尔马林将肝叶组织固定,石蜡包埋后进行组织切片,HE染色后显微镜下检查肝癌发生情况。
1.2.2DSS诱导慢性结肠炎
在小鼠第8周龄时将22只小鼠随机分成慢性肠炎组(n=10)和对照组(n=12),对照组给予正常饮用水。慢性肠炎组在第8周龄给予含2%DSS的饮用水,持续5 d,随后改用正常饮用水16 d,作为1个DSS周期,共给予4个DSS周期。
1.2.3粪便基因组提取
在第22周时,无菌条件下采集慢性肠炎组和对照组小鼠粪便,保存于-80℃。按照说明书操作提取粪便基因组DNA。应用NanoDrop 2000C(Thermo Scientific)检测提取的总DNA的浓度和纯度,并采用0.8%的琼脂糖凝胶电泳鉴定确定DNA的完整性。
1.2.4ALT测定
在每次给予DSS饮用水前后,尾静脉采血,分离血清。按照丙氨酸氨基转移酶测定试剂盒(速率法)说明书检测血清中ALT水平。
1.2.5小鼠肝脏组织学分析
小鼠二氧化碳麻醉后,在肝脏病变最明显处取1 cm×1 cm大小组织,固定于10%中性甲醛中,石蜡包埋切片后,进行HE染色。
1.2.6混合饲养(Cohouse)
小鼠在2周龄时注射DEN,将已发生肝癌的26周龄小鼠(n=4)与8周龄的雄性鼠(n=7,)进行混合饲养,共2笼:其中1笼包含2只已发生肝癌的小鼠和3只8周龄的雄性鼠,另1笼包含2只已发生肝癌的小鼠和4只8周龄的雄性鼠,共计16周。
1.2.7粪便微生物基因组测序
粪便基因组DNA在博奥生物有限公司扩增16S V4区,采用Ion Torrent平台进行宏基因组测序,并对测序结果进行生物信息学分析,包括群落结构分析,显著差异性分析等。
1.3统计学方法
采用SPSS17.0软件进行统计学分析。计量资料的比较采用t检验,检验水准α=0.05。计数资料的比较采用χ2检验,检验水准α=0.05。
2结果
2.1小鼠血清ALT的变化
DSS是一种肠道刺激物可导致小鼠肠炎,但不能进入血液,为排除其对肝细胞的直接损伤作用,通过血清丙氨酸氨基转移酶的测定,对照组和慢性肠炎组小鼠血清中ALT水平无统计学差异(图1),表明DSS没有直接引起肝细胞损伤。
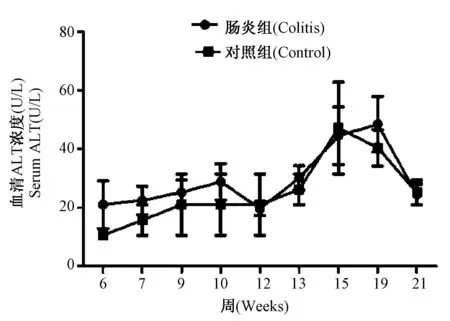
图1 小鼠血清ALTFig.1 The level of ALT in serum
2.2小鼠肝脏肿瘤进展的改变
通过饮用DSS导致的慢性肠炎小鼠(n=10)在22周龄时有9只发生弥漫性的肉眼可见的肝癌,肝癌发生率为90.0%(9/10),光镜下可见边界清晰的癌灶,瘤细胞间有丰富的血窦样间隙;对照组(n=12)小鼠仅有2只发生肝癌,发生率为16.7%(2/12),两组肝癌发生率有显著差别(P=0.002)。在已发生肿瘤的小鼠中,计数肿瘤数量,相较于对照组,慢性肠炎组小鼠肝脏肿瘤的数量明显增多(P=0.028)(封2图2)。该结果表明DSS通过诱导慢性结肠炎症的发生促进了肝癌的发展。
2.3小鼠肠道菌群改变
小鼠粪便微生物宏基因组测序结果显示,与HBV/DEN对照组(n=5)相比较,在DSS诱导慢性结肠炎组(n=3)中肠道菌群发生了明显的改变,其中普雷沃氏菌属(P=0.022)和厌氧支原体属(P=0.014)显著减少(彩插1图3),该结果表明DSS通过诱导结肠炎症的发生导致了肠道菌群的改变。
2.4混合饲养(Cohouse)影响肝癌进展
我们将已发生肝癌小鼠(n=4)与8周龄大小DEN处理的HBV转基因小鼠(n=7,肉眼及病理学未见肝癌)混合饲养(Cohouse)来改变肠道菌群,在第24周龄时全部小鼠发生肉眼可见的肝癌(封2图4)。
3讨论
肝脏是人体最大的实质性器官,有双重血液供应:肝动脉内是来自心脏的动脉血;门静脉收集消化道的静脉血。肝脏大约70%的血液来自门静脉。因此,肝脏经常接受来自肠道的抗原刺激,包括食物源性抗原和细菌相关抗原。肠道细菌在肠-肝轴中发挥重要作用。人体肠道中的细菌数(1×1013)大约是人体细胞数(1×1012)的10倍[14-15]。肠道细菌参与宿主的正常生理活动,包括营养、行为和应激反应。作为共生菌,这些微生物在人体消化吸收过程中起关键作用,肠道细菌通过活化或竞争机制阻止外来病原菌的入侵,当菌群稳态被打破时,肠道细菌通过影响附近和远端脏器,在疾病发生中起重要作用,此外,肠道细菌也能促进肠上皮细胞分化增殖,在维持肠道屏障功能中起关键作用[16]。
持续存在的慢性炎症在肿瘤发生中发挥重要作用,在人群中的研究发现,肠道细菌可以影响肠外肿瘤包括肝癌和乳腺癌的发展[17],肠道菌群易位能促进肝纤维化发生[18]。在肝癌的发生和化学剂诱导的炎性肿瘤中,肠道稳态发挥重要作用,Dianne H. Dapito等[19]研究表明,肠道微生物可能通过TLR4促进肝癌发生。本研究中,我们利用DEN诱发小鼠原发性肝癌,同时利用DSS诱导小鼠慢性结肠炎,结果发现慢性肠道炎症能促进肝癌的进展。利用宏基因组测序方法检测小鼠粪便细菌,发现在慢性肠道炎症存在下,肠道细菌有明显改变,其中普雷沃氏菌属和厌氧支原体属显著减少。同时,鉴于鼠类是嗜粪动物(coprophaga)[20],我们将已发生肝癌小鼠与肉眼及病理未见肝癌小鼠同笼饲养(Cohouse),结果发现Cohouse能促进肝癌的进展,具体原因还需进一步研究,根据Damman等[21]研究报道,我们推测Cohouse可能改变了肠道菌群,但还需进一步的研究证实。
参考文献:
[1]Poon D., Anderson B. O., Chen L. T.,etal. Management of hepatocellular carcinoma in Asia: consensus statement from the Asian Oncology Summit 2009[J]. Lancet Oncol, 2009,10(11):1111-1118.
[2]Tanaka M., Katayama F., Kato H.,etal. Hepatitis B and C virus infection and hepatocellular carcinoma in China: a review of epidemiology and control measures[J]. J Epidemiol, 2011,21(6):401-416.
[3]Zhang Y., Ren J. S., Shi J. F.,etal. International trends in primary liver cancer incidence from 1973 to 2007[J]. BMC Cancer, 2015,15(1):1113.
[4]Chang M. H., You S. L., Chen C. J.,etal. Decreased incidence of hepatocellular carcinoma in hepatitis B vaccinees: a 20-year follow-up study[J]. J Natl Cancer Inst, 2009,101(19):1348-1355.
[5]Chiang C. J., Yang Y. W., You S. L.,etal. Thirty-year outcomes of the national hepatitis B immunization program in Taiwan[J]. JAMA, 2013,310(9):974-976.
[6]Chien Y. C., Jan C. F., Chiang C. J.,etal. Incomplete hepatitis B immunization, maternal carrier status, and increased risk of liver diseases: A 20-year cohort study of 3.8 million vaccinees[J]. Hepatology, 2014,60(1):125-132.
[7]Qu C., Chen T., Fan C.,etal. Efficacy of neonatal HBV vaccination on liver cancer and other liver diseases over 30-year follow-up of the Qidong hepatitis B intervention study: a cluster randomized controlled trial[J]. PLoS Med, 2014,11(12):e1001774.
[8]Sun Z., Chen T., Thorgeirsson S. S.,etal. Dramatic reduction of liver cancer incidence in young adults: 28 year follow-up of etiological interventions in an endemic area of China[J]. Carcinogenesis, 2013,34(8):1800-1805.
[9]Chen J. G., Egner P. A., Ng D.,etal. Reduced aflatoxin exposure presages decline in liver cancer mortality in an endemic region of China[J]. Cancer Prev Res (Phila), 2013,6(10):1038-1045.
[10]Mendoza J. L., Lana R., Taxonera C.,etal. Extraintestinal manifestations in inflammatory bowel disease: differences between Crohn's disease and ulcerative colitis[J]. Med Clin (Barc), 2005,125(8):297-300.
[11]Vesselinovitch S. D. ,Mihailovich N. Kinetics of diethylnitrosamine hepatocarcinogenesis in the infant mouse[J]. Cancer Res, 1983,43(9):4253-4259.
[12]Druckrey H., Steinhoff D., Preussmann R.,etal. Induction of Cancer by a Single Dose of Methylnitroso-Urea and Various Dialkylnitrosamines in Rats[J]. Z Krebsforsch, 1964,66(1-10.
[13]Ohkusa T. Production of experimental ulcerative colitis in hamsters by dextran sulfate sodium and changes in intestinal microflora[J]. Nihon Shokakibyo Gakkai Zasshi, 1985,82(5):1327-1336.
[14]Guarner F. ,Malagelada J. R. Gut flora in health and disease[J]. Lancet, 2003,361(9356):512-519.
[15]O'Keefe S. J. Nutrition and colonic health: the critical role of the microbiota[J]. Curr Opin Gastroenterol, 2008,24(1):51-58.
[16]Rawls J. F., Samuel B. S. ,Gordon J. I. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota[J]. Proc Natl Acad Sci U S A, 2004,101(13):4596-4601.
[17]Rogers A. B. Distance burning: how gut microbes promote extraintestinal cancers[J]. Gut Microbes, 2011,2(1):52-57.
[18]Darnaud M., Faivre J. ,Moniaux N. Targeting gut flora to prevent progression of hepatocellular carcinoma[J]. J Hepatol, 2013,58(2):385-387.
[19]Dapito D. H., Mencin A., Gwak G. Y.,etal. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J]. Cancer Cell, 2012,21(4):504-516.
[20]Elinav E., Thaiss C. A. ,Flavell R. A. Analysis of microbiota alterations in inflammasome-deficient mice[J]. Methods Mol Biol, 2013,1040(185-194.
[21]Damman C. J., Miller S. I., Surawicz C. M.,etal. The microbiome and inflammatory bowel disease: is there a therapeutic role for fecal microbiota transplantation?[J]. Am J Gastroenterol, 2012,107(10):1452-1459.
〔修回日期〕2015-03-31
研究报告
promote hepatoma development in mice
YI Hong-gan1,2,ZANG Meng-ya2,WU Zhi-yuan2,
ZHU Zheng3,ZHAO Xin-ming3,WANG Wei-hu4,QU Chun-feng2
(1. Guangzhou Medical University, Guangzhou 510182, China; 2.State Key Lab of Molecular Oncology, Beijing 100021,China;
3. Department of Medical Imaging, Beijing 100021,China; 4. Department of Radiation Oncology, Cancer Institute/Hospital,
Chinese Academy of Medical Sciences, Beijing 100021, China)
【Abstract】ObjectiveTo investigate the effect of gut bacteria under chronic colitis on the progression of hepatoma in mice. Methods 22 hepatitis B virus (HBV)-transgenic mice (male, 8 weeks) were randomly divided into two groups, one group (n=10) was fed the drinking water containing 2% dextran sodium sulphate(DSS)to induce chronic colitis and the control group(n=12)was fed with normal drinking water. In order to investigate the effect of gut microbes,7 male HBV-transgenic mice(8 weeks, with no detectable hepatoma under microscopy) were cohoused with 4 mice with hepatoma for 16 weeks. ResultsNo significant liver cell damage was observed in the group of the mice fed with 2% DSS-containing drinking water. By the 22-week old,9 of the 10 mice(90.0%) fed with 2% DSS-containing drinking water, 2 of the 12 mice(16.7%) fed with normal drinking had hepatoma. Both the hepatoma incidence and the tumor numbers in the group of mice fed with DSS-containing water were significantly higher than that in the controls (P=0.002 and P=0.028respetively). Compared to controls, the bacteria family Prevotella (P=0.022) and Anaeroplasma (P=0.014) reduced significantly in the mice with induced chronic colitis. All the mice (n=7) cohoused with the mice with hepatoma had the liver tumor developed at 24-week-old. Conclusion Alterations of gut bacteria under chronic colitis may promote the development of liver cancer.
【Key words】Chronic colitis;Liver cancer;Gut bacteria
doi:10.3969.j.issn.1671.7856. 2015.005.001
【中图分类号】R332
【文献标识码】A
【文章编号】1671-7856(2015) 05-0001-04
[通讯作者]曲春枫,教授,博士生导师,E-mail: quchf@cicams.ac.cn。
[作者简介]易宏淦(1989-),男,硕士生,研究方向:慢性炎症与肿瘤免疫。
[基金项目]973课题“细胞微环境在肿瘤发生发展及侵袭转移中的作用及机制”(2011CB504205)。
