肢体缺血预适应减轻人脐静脉内皮细胞的氧化应激损伤*
2016-01-28张明升张轩萍梁月琴
陈 敏, 张明升△, 张轩萍, 梁月琴
(山西医科大学 1药理学教研室, 2机能实验室,山西 太原 030001)
肢体缺血预适应减轻人脐静脉内皮细胞的氧化应激损伤*
陈敏1,张明升1△,张轩萍1,梁月琴2
(山西医科大学1药理学教研室,2机能实验室,山西 太原 030001)
[摘要]目的: 探讨肢体缺血预适应对氧化应激损伤的血管内皮是否具有保护作用。方法: 人脐静脉内皮细胞分为5组:对照组不加任何处理;模型组给予过氧化氢损伤2 h;早期肢体缺血预适应组、晚期肢体缺血预适应组和假肢体缺血预适组这3组分别用5%大鼠早期肢体缺血预适应血清、晚期肢体缺血预适应血清和假肢体缺血预适应血清孵育12 h,再用过氧化氢损伤2 h。检测细胞凋亡情况,培养液中乳酸脱氢酶的活性,内皮细胞表面黏附分子的mRNA水平,血红素氧合酶1的mRNA和蛋白表达情况。结果: 大鼠早期肢体缺血预适应和晚期缺血预适应血清可以减轻人脐静脉内皮细胞氧化应激所导致的细胞死亡,减少乳酸脱氢酶的释放,减少内皮细胞表面黏附分子的表达,并能增加血红素氧合酶1的mRNA和蛋白的表达。结论: 肢体缺血预适应可以减轻血管内皮细胞的氧化应激损伤。
[关键词]肢体缺血预适应; 人脐静脉内皮细胞; 氧化应激
血管内皮细胞是紧贴血管内表面的单层细胞,最初认为血管内皮细胞只是起简单的屏障作用,将血液与血管壁的其它组织分隔开。随着研究的深入,研究人员发现血管内皮细胞是人体最大的腺体[1],通过产生各种血管活性物质,调节血管的张力、血小板的活化、白细胞的黏附等,对维持血管稳态起重要作用[2]。当器官发生缺血再灌注损伤时,血管内皮细胞首当其冲受到影响,而内皮功能的好坏又直接影响到器官的血液灌注和供氧,因此减轻血管内皮损伤也是减轻器官损伤的重要环节。
肢体缺血预适应(limb ischemic preconditioning,LIPC)不仅可以减轻心、脑等重要脏器的缺血再灌注损伤[3-4],LIPC还可以改善正常人的血管内皮功能[5],减轻经皮冠状动脉介入治疗患者的血管内皮损伤[6]。临床研究中,采用血流介导的舒张功能(flow-mediated dilation,FMD)评价血管内皮功能,指标单一,缺乏全面详细的实验数据支持。本实验通过体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),并用H2O2制造稳定的氧化应激损伤模型,采集大鼠LIPC的早期缺血预适应血清和晚期缺血预适应血清来观察LIPC是否可以减轻内皮细胞的氧化应激损伤,并初步探讨机制。
材料和方法
1动物、细胞和试剂
雄性SD大鼠,体重220~250 g,购自山西医科大学实验动物中心,动物合格证号为SCXK (晋) 2009-0001。饲养温度(22±2) ℃,相对湿度50%~60%,自由饮水及摄食。正常喂养2周后,将大鼠随机分为3组,每组5只。早期肢体缺血预适应组(early limb ischemic preconditioning,EPC),晚期肢体缺血预适应组(delayed ischemic preconditioning,DPC),假肢体缺血预适应组(sham ischemic preconditioning,SPC)。
HUVECs购自上海细胞所。用DMEM高糖培养基(HyClone)加10%的胎牛血清(杭州四季青)常规培养,2~3 d换液 1 次,待细胞长至80%时,0.25%胰酶(北京索莱宝)消化传代。
细胞总RNA提取试剂、逆转录试剂及荧光定量PCR试剂购自TaKaRa;引物由上海生工生物工程有限公司设计并合成;血红素氧合酶1 (heme oxyge-nase-1,HO-1)抗体购自Abcam;乳酸脱氢酶(laetate dehydrogenase, LDH)试剂盒购自南京建成生物工程有限公司;流式双染试剂盒购自南京凯基生物发展有限公司。
2方法
2.1大鼠肢体缺血预适应方法及血清的获取用改良的血压计套环套在大鼠右后肢,充气加压至200 mmHg,阻断大鼠右后肢血流,大鼠右后肢发紫,足背动脉搏动消失,造成后肢缺血,持续加压5 min。随后放气减压,大鼠右后肢恢复正常颜色,足背动脉搏动出现,右后肢血流恢复,右后肢再灌注,持续10 min[7-8]。重复3个循环。假肢体预适应组大鼠只将右后肢放入套环,并不充气加压阻断血流。
大鼠麻醉(25%乌拉坦,腹腔注射,1 g/kg)后,腹主动脉无菌采血,4 ℃静置30 min,3 000 r/min离心15 min,分离得血清,无菌分装后,置于-80 ℃保存。LIPC后1 h内采血,得到血清为早期肢体缺血预适应血清(early limb ischemic preconditioning serum,EPS),LIPC后24 h采血,得到晚期肢体缺血预适应血清(delayed limb ischemic preconditioning serum,DPS)。
2.2细胞分组HUVECs分为5组:正常对照组(control,C),常规培养,不加任何处理措施;模型组(model,M),用1 mmol/L的H2O2处理2 h;EPS组,用5%的EPS预孵育12 h,再用1 mmol/L的H2O2处理2 h;DPS组,用5%的DPS预孵育12 h,再用1 mmol/L的H2O2处理2 h;SPS组,用5%的SPS预孵育12 h,再用1 mmol/L的H2O2处理2 h。
2.3流式细胞术检测各组细胞处理结束后,用PBS清洗,胰酶消化,收集,离心后用Annexin V-FITC结合液重悬制成细胞悬液,加入Annexin V-FITC和PI室温避光孵育10 min后上机检测。
2.4细胞培养上清液中LDH活性的测定各组细胞处理结束后,收集细胞培养上清液,1 000 r/min,离心5 min弃去沉淀,用试剂盒检测LDH的活性。
2.5细胞总RNA的提取和实时荧光定量PCR反应按照试剂说明书提取细胞总RNA,经过1%琼脂糖凝胶电泳鉴定18 s和28 s的完整性,用分光光度计定量,按照TaKaRa反转录试剂盒说明书进行反转录实验得到cDNA。取一定量的cDNA按照说明书进行荧光定量PCR实验。所用引物如表1所示。设定反应条件为95 ℃ 10 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;95 ℃ 1 min,55 ℃ 30 s ;95 ℃ 30 s。反应结束,根据荧光反应的阈值,得到Ct值,根据2-ΔΔCt法计算相对表达量。
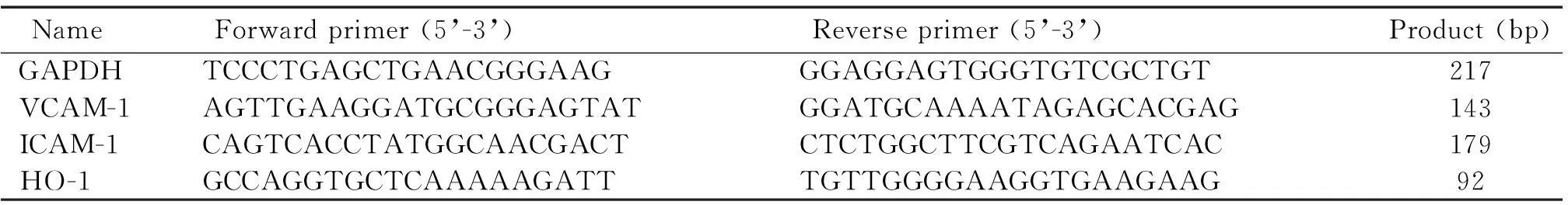
表1 引物序列
2.6Western blot实验细胞接种于25 cm2的培养瓶培养,各种处理结束后,弃去培养液,用PBS清洗2遍,加入含有PMSF的细胞裂解液,冰上裂解30 min,(10 000~14 000)×g离心15 min,取上清,分装于-80 ℃保存。BCA定量后,取50 μg的总蛋白上样电泳,转膜,封闭, I抗4 ℃孵育过夜, II抗孵育2~3 h,ECL曝光,底片拍照,用Bio-Rad凝胶成像系统分析条带灰度。用目的蛋白/β-actin的比值代表目的蛋白的相对表达量。
3统计学分析
用SPSS 13.0 软件进行统计分析。数据用均数±标准差(mean±SD)表示,组间差异的比较采用单因素方差分析,两组间比较采用 Bonferroni 法,以P<0.05为差异有统计学意义。
结果
1流式细胞术检测细胞凋亡情况
HUVECs各组细胞经过处理后,进行流式细胞术检测。M组的早期凋亡率、晚期凋亡率和总的死亡率与C组相比均显著增高(P<0.01),这表明1 mmol/L H2O2孵育2 h可以引起细胞损伤,模型构建成功。如果用5% EPS和DPS 提前孵育12 h,则细胞的早期凋亡率、晚期凋亡率和总的死亡率显著降低(P<0.01),而SPS组早期凋亡率、晚期凋亡率和总的死亡率与M组相比,无显著差异。
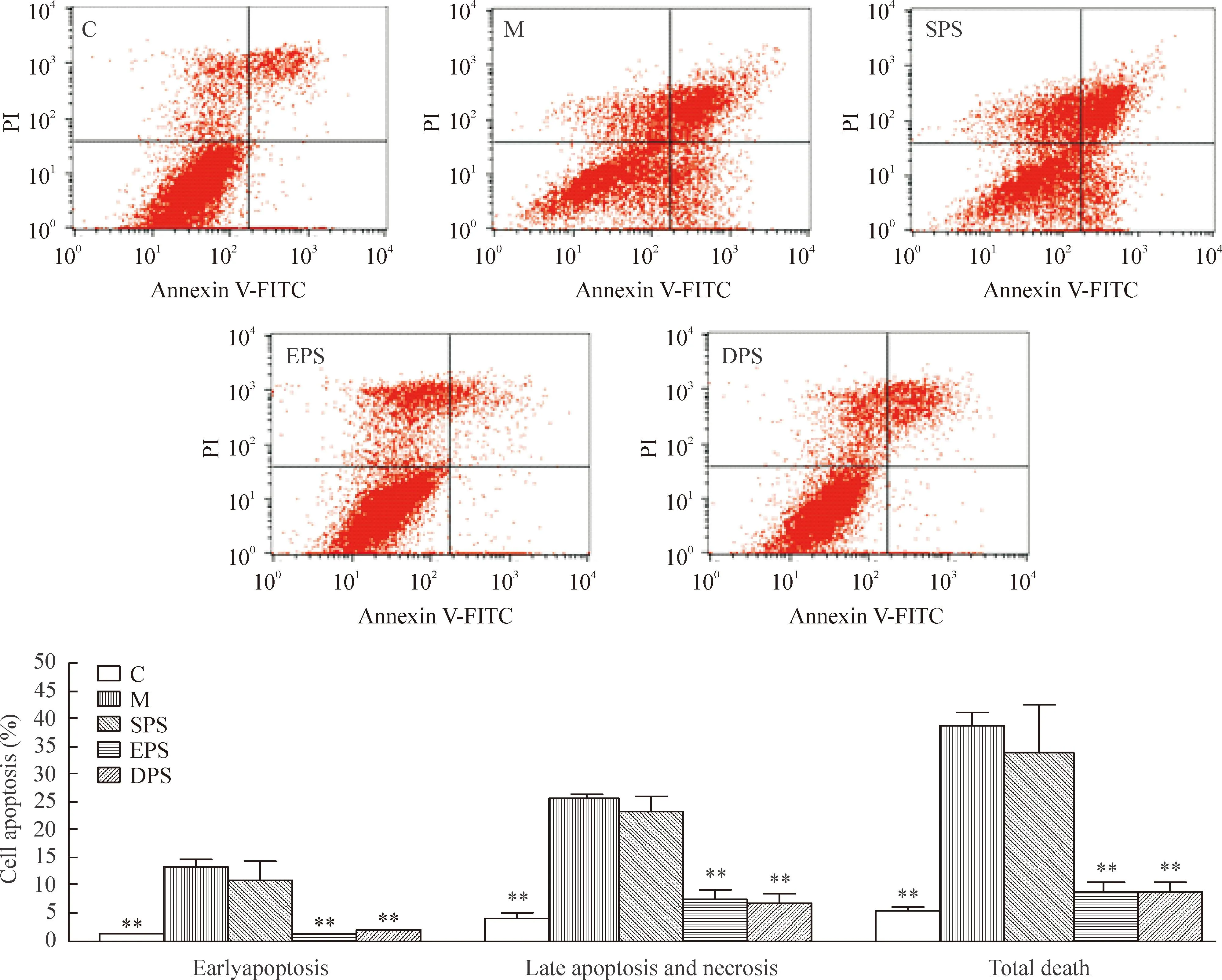
Figure 1.The cell viability of HUVECs in all groups analyzed by flow cytometry. Mean±SD.n=6.**P<0.01vsM.
图1流式细胞术分析各组细胞凋亡
2细胞培养上清液中LDH的活性
HUVECs细胞用1 mmol/L的H2O2处理2 h,细胞培养上清液中的LDH活性显著升高(P<0.01)。与M组相比,用5%的EPS和DPS预孵12 h,上清液中LDH的活性显著降低(P<0.01)。SPS组与M组相比差异无统计学意义。
3黏附分子的表达
经过1 mmol/L H2O2处理 2 h,与对照组相比,M组的ICAM-1和VCAM-1 mRNA的量增加,用EPS和DPS预处理的细胞ICAM-1和VCAM-1 mRNA的量减少。SPS组与M组相比差异无统计学意义。
4HO-1的mRNA和蛋白水平
通过荧光定量PCR的检测发现,经过EPS和DPS处理的细胞,HO-1的mRNA与M组相比,显著增高(P<0.01),而SPS组与M组相比差异无统计学意义。Western blot检测结果表明,与M组相比,EPS和DPS组细胞HO-1蛋白的表达量增高(P<0.05),而SPS组HO-1蛋白表达与M组相比差异无统计学意义,见图4。
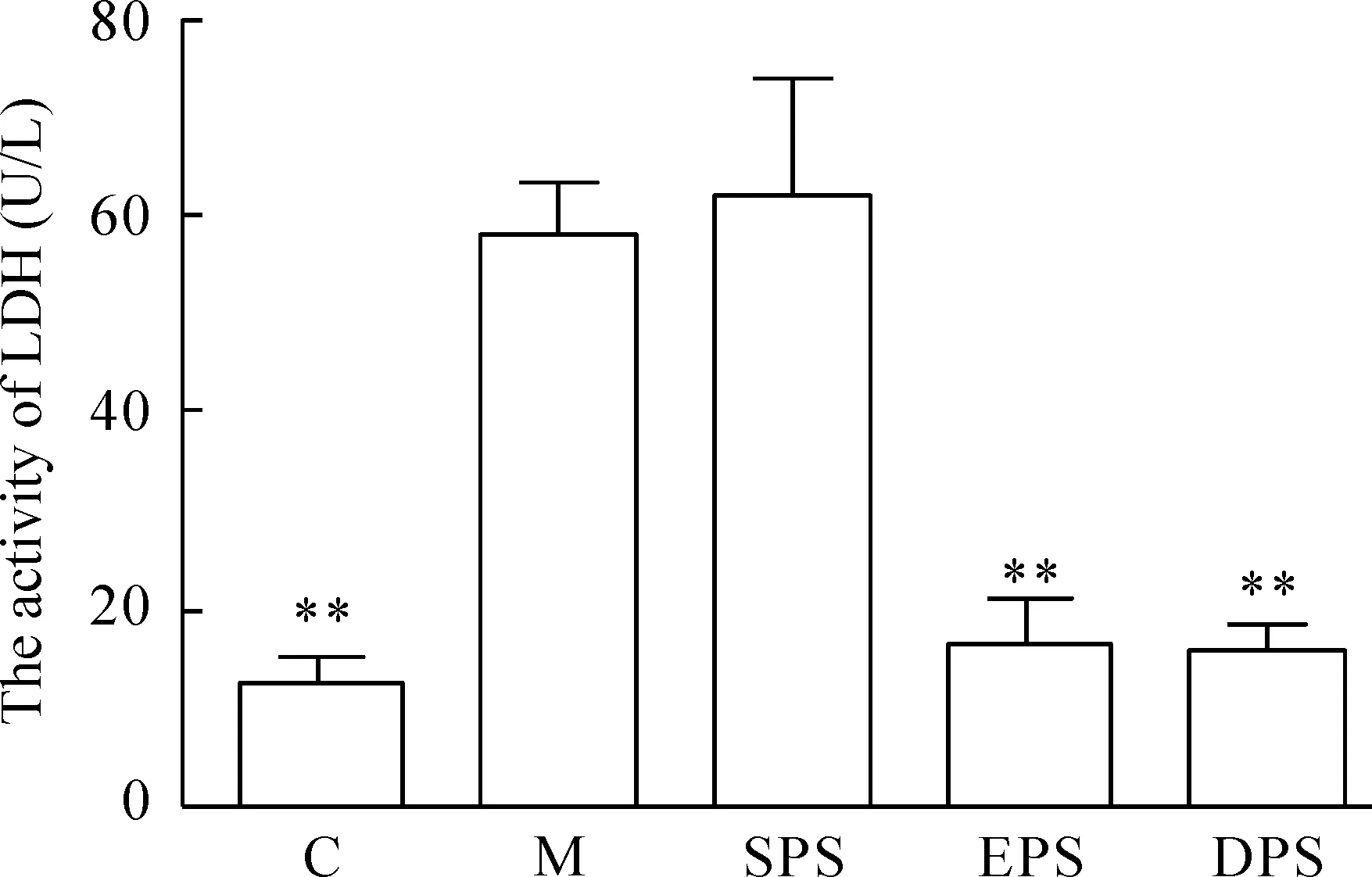
Figure 2.The activity of LDH in culture medium of all groups. Mean±SD.n=6.**P<0.01vsM.
图2各组细胞培养液中LDH的活性
Figure 3.The mRNA levels of VCAM-1 and ICAM-1 detected by real-time PCR. Mean±SD.n=6.**P<0.01vsM.
图3各组细胞黏附分子的mRNA 水平
讨论
本实验中用1 mmol/L的H2O2损伤2 h发现,HUVECs细胞早期凋亡和晚期凋亡及坏死的细胞增多,细胞培养上清液中LDH的含量也明显增加,HUVECs细胞损伤严重。将EPS和DPS加入HUVECs预孵12 h,可以明显减轻H2O2对内皮细胞的损伤,凋亡和坏死的细胞减少,LDH的释放减少,这表明肢体缺血预适应可以减轻内皮细胞的氧化应激损伤。
血管内皮细胞损伤,单核细胞黏附于血管内皮是动脉粥样硬化发生过程的初始因素。在此过程中,血管内皮细胞表面的黏附分子起重要作用。内皮损伤内皮功能障碍时,血管内皮细胞表面的黏附分子表达增加[9]。本实验用1 mmol/L的H2O2损伤HUVECs,血管内皮细胞的黏附分子ICAM-1和VCAM-1的mRNA水平显著增加,而EPS和DPS处理后,血管内皮细胞的ICAM-1和VCAM-1的mRNA降低,这表明LIPC可以减少血管内皮细胞黏附分子的表达,有助于减轻动脉粥样硬化。
Figure 4.The expression of HO-1 at mRNA and protein levels. Mean±SD.n=6.*P<0.05,**P<0.01vsM.
图4各组细胞HO-1的mRNA和蛋白表达水平
HO-1是一个内源性的保护酶,能够被氧化应激诱导表达增多[10]。HO-1的主要功能是催化血红素生成一氧化碳、铁离子和胆红素[11]。现在的研究证实HO-1可以抗氧化应激,产生细胞保护效应,能够减轻血管的重构和动脉粥样硬化的形成[12-13],是治疗血管疾病的一个重要靶点。HO-1还能够减轻多种因素,如吸烟[14]、PM2.5[15]所导致的内皮损伤。在本研究中,EPS和DPS预孵后能够诱导HUVECs表达HO-1,肢体缺血预适应可能通过诱导HO-1的表达而减轻过氧化氢造成的氧化应激损伤。
至今为止,肢体缺血预适应的机制并不完全清楚。目前有3个假设用来解释LIPC的保护作用:第一是肢体缺血预适应触发某些物质释放入血液,经血流到达靶器官发挥保护作用;第二是LIPC刺激后,神经系统调节靶器官产生保护作用[16],神经系统参与了LIPC过程;第三是LIPC触发细胞内抗炎和抗凋亡作用[17]。LIPC后,血液中成分确实发生了改变,如健康成人的上肢进行缺血预适应后,血液中有51种蛋白质发生变化,这些蛋白质涉及免疫反应,离子结合,渗透压维持及氧化应激反应等方面[18]。人类LIPC后血液中产生的这些物质甚至可以对兔心脏产生保护作用,这意味着LIPC存在种属交叉[19]。大鼠经过肢体缺血预适应之后,血浆中有7种蛋白发生改变,这些蛋白早已被证实参与器官保护、抗炎和抗缺血[20]。本研究则发现大鼠LIPC后的血清可以减轻人脐带静脉内皮细胞的氧化应激损伤,进一步证实了LIPC所产生的保护性物质在种属间有交叉性。
综上所述,本研究发现肢体缺血预适应通过诱导HO-1的表达,从而减轻内皮细胞的氧化应激损伤,减少黏附分子的表达。肢体缺血预适应产生的保护物质在种属间有交叉。
[参考文献]
[1]Rubanyi GM. The role of endothelium in cardiovascular homeostasis and diseases [J]. J Cardiovasc Pharmacol, 1993, 22(Suppl 4):S1-S14.
[2]Xu J, Zou MH. Molecular insights and therapeutic targets for diabetic endothelial dysfunction[J].Circulation, 2009, 120(13):1266-1286.
[3]Wu Q, Gui P, Wu J, et al. Effect of limb ischemic preconditioning on myocardial injury in patients undergoing mitral valve replacement surgery. A randomized controlled trial[J]. Circ J, 2011, 75(8):1885-1889.
[4]Jensen HA, Loukogeorgakis S, Yannopoulos F, et al. Remote ischemic preconditioning protects the brain against injury after hypothermic circulatory arrest[J]. Circulation, 2011, 123(7): 714-721.
[5]Loukogeorgakis SP, Panagiotidou AT, Broadhead MW, et al. Remote ischemic preconditioning provides early and late protection against endothelial ischemia-reperfusion injury in humans: role of the autonomic nervous system[J]. J Am Coll Cardiol, 2005, 46(3):450-456.
[6]Manchurov V, Ryazankina N, Khmara T, et al. Remote ischemic preconditioning and endothelial function in patients with acute myocardial infarction and primary PCI[J]. Am J Med, 2014, 127(7): 670-673.
[7]陈敏,宋二飞,张轩萍,等. 重复无创肢体缺血预适应对大鼠心肌缺血再灌注损伤的保护作用[J]. 中国药物与临床,2012, 12(10):1275-1278.
[8]高建波,张颖,娄建石,等. 无创性延迟肢体缺血预适应对大鼠缺血再灌注损伤心肌持续保护效应[J]. 中国病理生理杂志, 2013, 29(9):1691-1695.
[9]Rajendran P, Rengarajan T, Thangavel J, et al. The vascular endothelium and human diseases[J]. Int J Biol Sci, 2013, 9(10):1057-1069.
[10]Ryter SW, Choi AM. Heme oxygenase-1/carbon mono-xide: from metabolism to molecular therapy[J]. Am J Respir Cell Mol Biol, 2009, 41(3):251-260.
[11]Kikuchi G, Yoshida T, Noguchi M. Heme oxygenase and heme degradation[J]. Biochem Biophys Res Commun, 2005, 338(1): 558-567.
[12]Clinton Webb R, Lee ME, Nabel GJ, et al. Heme oxygenase-1 protects against vascular constriction and proliferation[J]. Nat Med, 2001, 7(6): 693-698.
[13]Durante W. Heme oxygenase-1 in growth control and its clinical application to vascular disease[J]. J Cell Physiol, 2003, 195(3):373-382.
[14]Yang G, Li Y, Wu W, et al. Anti-oxidant effect of heme oxygenase-1 on cigarette smoke-induced vascular injury[J]. Mol Med Rep, 2015, 12(2):2481-2486.
[15]Yang GZ, Wang ZJ, Bai F, et al. Epigallocatechin-3-gallate protects HUVECs from PM2.5-induced oxidative stress injury by activating critical antioxidant pathways[J]. Molecules, 2015, 20(4):6626-6639.
[16]Lim SY, Yellon DM, Hausenloy DJ. The neural and humoral pathways in remote limb ischemic preconditioning[J]. Basic Res Cardiol, 2010, 105(5):651-655.
[17]Sanada S, Komuro I, Kitakaze M. Pathophysiology of myocardial reperfusion injury: preconditioning, postconditioning, and translational aspects of protective measures[J]. Am J Physiol Heart Circ Physiol, 2011, 301(5):H1723-H1741.
[18]Hepponstall M, Ignjatovic V, Binos S, et al. Remote ischemic preconditioning (RIPC) modifies plasma proteome in humans[J]. PLoS One, 2012, 7(11):e48284.
[19]Shimizu M, Tropak M, Diaz RJ, et al. Transient limb ischaemia remotely preconditions through a humoral mechanism acting directly on the myocardium: evidence suggesting cross-species protection[J]. Clin Sci (Lond), 2009, 117(5):191-200.
[20]Hibert P, Prunier-Mirebeau D, Beseme O, et al. Modifications in rat plasma proteome after remote ischemic preconditioning (RIPC) stimulus: identification by a SELDI-TOF-MS approach[J]. PLoS One, 2014, 9(1):e85669.
(责任编辑: 林白霜, 罗森)

*[基金项目]深圳市重点资助科技计划(No.201201022)
Limb ischemic preconditioning protects human umbilical vein endothelial cells from oxidative stress induced by H2O2CHEN Min1, ZHANG Ming-sheng1, ZHANG Xuan-ping1, LIANG Yue-qin2
(1DepartmentofPharmacology,2MedicalFunctionalExperimentalCenter,ShanxiMedicalUniversity,Taiyuan030001,China.E-mail:4156589@sina.com)
[ABSTRACT]AIM: To investigate the effects of the sera from the rats after limb ischemic preconditioning (LIPC) on human umbilical vein endothelial cells (HUVECs) injured by hydrogen peroxide (H2O2). METHODS: The HUVECs were divided into 5 groups: the cells in control group were cultured without any intervention; the cells in model group (M) were damaged by 1 mmol/L H2O2for 2 h; the cells in early preconditioning serum (EPS) group, delayed preconditioning serum (DPS) group or sham limb ischemic preconditioning serum (SPS) group were treated with the corresponding serum at 5% for 12 h, respectively, and then treaed with H2O2for 2 h. The viability of the HUVECs was analyzed by flow cytometry. The lactate dehydrogenase (LDH) in the culture media was detected. The cell adhesion molecules in the HUVECs were detected by real-time PCR. The mRNA and protein expression of heme oxygenase-1 (HO-1) was also determined. RESULTS: The viability of HUVECs incubated with 1 mmol/L H2O2for 2 h significantly decreased compared with the control cells, which was accompanied with the augmentations of LDH in the medium and the cell adhesion molecules in cells, such as vascular cell adhesion molecule-1 (VCAM-1) and intercellular adhesion molecule-1 (ICAM-1). Preincubation with EPS and DPS derived from the rats subjected LIPC attenuated these injuries. Furthermore, pretreatment with EPS and DPS increased the expression of HO-1 at mRNA and protein levels. CONCLUSION: LIPC protects the HUVECs from H2O2-induced injury.
[KEY WORDS]Limb ischemic preconditioning; Human umbilical vein endothelial cells; Oxidative stress
通讯作者△Tel: 0755- 22943200; E-mail: dsp66@medmail.com.cn
[收稿日期]2015- 06- 29[修回日期] 2015- 09- 22
[文章编号]1000- 4718(2015)12- 2282- 05
doi:10.3969/j.issn.1000- 4718.2015.12.028
[中图分类号]R363
[文献标志码]A
