靶向沉默Mcl-1基因对感染不同毒力结核杆菌小鼠腹腔巨噬细胞凋亡的影响*
2016-01-28王飞雨王新敏王小芳张宇晴吴江东张万江
王飞雨, 王新敏, 王 婵, 王小芳, 张宇晴, 吴江东, 吴 芳, 张万江, 章 乐△
(石河子大学医学院 1病理生理学教研室, 2病原生物学与免疫学教研室, 3第一附属医院泌尿外科,4新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
靶向沉默Mcl-1基因对感染不同毒力结核杆菌小鼠腹腔巨噬细胞凋亡的影响*
王飞雨1,4,王新敏3,王婵2,4,王小芳1,4,张宇晴1,4,吴江东1,4,吴芳1,4,张万江1,4,章乐1,4△
(石河子大学医学院1病理生理学教研室,2病原生物学与免疫学教研室,3第一附属医院泌尿外科,4新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
[摘要]目的: 通过RNA干扰技术特异性沉默Mcl-1基因,探讨下调Mcl-1基因对感染不同毒力结核杆菌小鼠腹腔巨噬细胞凋亡的影响。方法: 分别用制备好的新疆地区流行的优势强毒结核分枝杆菌临床分离株(简称强毒株)、结核分枝杆菌国际标准强毒株p7Rv(简称p7Rv)、结核分枝杆菌国际标准无毒株p7Ra(简称p7Ra)和卡介苗(BCG)菌悬液感染BALB/c小鼠,再以筛选并构建好的Mcl-1-shRNA作用于感染的小鼠模型,同时设立相应对照组,于作用后1 d、3 d、5 d和7 d提取小鼠腹腔巨噬细胞,应用实时荧光定量PCR和Western blot检测各组小鼠腹腔巨噬细胞中Mcl-1 mRNA和蛋白的表达;应用流式细胞术检测各组巨噬细胞的凋亡水平。结果: 小鼠被不同毒力的结核杆菌感染后其腹腔巨噬细胞中Mcl-1 mRNA和蛋白的表达水平均有不同程度的升高,其中以感染了强毒株和p7Rv的腹腔巨噬细胞升高最为明显(P<0.05);应用RNA干扰技术沉默Mcl-1基因后,Mcl-1 mRNA和蛋白的表达水平明显低于对照组(P<0.05);流式细胞术分析显示,下调Mcl-1基因的表达可诱导小鼠腹腔巨噬细胞凋亡。结论: 应用Mcl-1-shRNA可有效沉默Mcl-1在感染了不同毒力结核杆菌小鼠腹腔巨噬细胞中的表达,并能上调巨噬细胞的凋亡水平。
[关键词]结核分枝杆菌; Mcl-1基因; 腹腔巨噬细胞; RNA干扰; 细胞凋亡
结核分枝杆菌(Mycobacteriumtuberculosis,MTB)是典型的胞内致病菌,其能通过多种机制逃避机体免疫细胞的杀伤及清除,从而影响其宿主细胞(单核巨噬细胞)的调控,导致巨噬细胞不能正常凋亡[1]。髓样细胞白血病1(myeloid cell leukemia-1,Mcl-1)基因隶属于Bcl-2家族,其主要作用是抑制细胞凋亡,目前大量的研究表明,与Bcl-2家族其它成员相比,在表达Mcl-1基因的细胞中,其表达水平可能是决定细胞生存的关键因素[2]。因此本研究以Mcl-1基因作为支点,通过靶向沉默其表达,借以探讨不同毒力结核杆菌感染小鼠后Mcl-1基因在宿主巨噬细胞凋亡中的调控作用和机制。
材料和方法
1菌株和实验动物
结核分枝杆菌国际标准强毒株p7Rv、结核分枝杆菌国际标准无毒株p7Ra和卡介苗菌株(Bacillus Calmette-Guerin vaccine,BCG)由中国药物生物制品检定所提供;新疆地区流行的优势强毒结核分枝杆菌临床分离株由本实验室前期鉴定并保存。实验小鼠为8周龄SPF级(无特定病原体动物)雌性BALB/c小鼠,重(18±2) g,共192只,购于石河子大学实验动物中心。
2主要试剂
Super RT cDNA Kit及TRIzol Reagent 购自Invitrogen;QuantiFast SYBR Green PCR Kit 购自Qiagen;无内毒素质粒大量抽提试剂盒购自TIANGEN;流式凋亡试剂盒(Annexin V-APC/7-AAD)购自联科生物技术有限公司;小鼠Mcl-1蛋白ELISA试剂盒购自Cloud-Clone;兔多克隆抗体Mcl-1购自Santa Cruz;β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗鼠IgG抗体及山羊抗兔IgG购自北京中衫金桥生物技术有限公司;ECL化学发光试剂盒购自Millipore。
3方法
3.1实验分组将实验小鼠随机分为强毒株组、p7Rv组、p7Ra组、BCG组、强毒株+Mcl-1-shRNA组、p7Rv+Mcl-1-shRNA组、p7Ra+Mcl-1-shRNA组、BCG+Mcl-1-shRNA组、Mcl-1-shRNA组和空白对照组,在模型建立后的第1、3、5、7天设置4个时点,每组每个时点各设3只小鼠。
3.2小鼠感染模型的建立在生物安全柜内,以灭菌接种环取改良罗氏固体培养基上生长2~3周、状态良好的结核杆菌菌落,置灭菌磨菌器中,加少量0.05% Tween-20 的生理盐水充分研磨,使其成均匀浑浊的菌悬液。利用麦氏比浊法调细菌浓度约1.0×1010/L。将不同菌悬液经小鼠腹腔分别注射到对应分组的每只小鼠体内,注射量约为0.3 mL[3]。将感染小鼠置生物安全三级实验室内,IVC笼具中饲养。
3.3小鼠腹腔巨噬细胞的收集在上述不同时点将小鼠脱颈处死,用75%乙醇消毒小鼠腹部皮肤,置于超净台中;用镊子将小鼠下腹部皮肤提起,剪开一个小口,将皮肤撕开,完全暴露腹膜;用镊子提起腹膜,用5 mL注射器向小鼠腹腔中注入5 mL 1640培养基,反复按摩腹部10 min,避开肠和脂肪,反复回抽腹腔液,不同的方向冲洗数次,最后吸出腹腔液;将细胞悬液1 200 r/min条件下离心5 min,弃上清,PBS液洗涤l次,用含10%胎牛血清的DMEM培养液将细胞悬起;将细胞接种到6孔细胞培养板中,置于37 ℃、5% CO2的培养箱中培养6 h,贴壁细胞即为小鼠腹腔巨噬细胞[4]。
3.4ELISA法筛选Mcl-1-shRNA最佳剂量及最佳处理时间按照质粒大量抽提试剂盒操作说明提取已筛选并构建好的Mcl-1-shRNA质粒[5],随机选取48只正常BALB/c小鼠,分为每只0 μg、50 μg、75 μg和100 μg 4个剂量组,同时设置1 d、3 d、5 d和7 d 4个时点,每组每个时点3只小鼠,将质粒DNA采用hydrodynamic技术注入各组小鼠体内[6],在上述不同时点,分别提取培养各组小鼠的腹腔巨噬细胞,用细胞裂解液抽提小鼠腹腔巨噬细胞总蛋白,按照ELISA试剂盒操作说明进行操作,计算各组中Mcl-1蛋白含量。随机选取24只BALB/c小鼠,在生物安全柜内经腹腔接种BCG菌悬液0.3 mL,于感染后的1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d分别提取培养小鼠的腹腔巨噬细胞,用细胞裂解液抽提小鼠腹腔巨噬细胞总蛋白,按照ELISA试剂盒操作说明进行操作,计算Mcl-1的蛋白含量。
3.5应用实时荧光定量PCR检测Mcl-1的mRNA表达用TRIzol法分别提取各组小鼠腹腔巨噬细胞的总RNA,分光光度法测定并计算提取的总RNA含量及浓度,按照逆转录试剂盒操作说明将各组细胞总RNA逆转录成cDNA,参照QuantiFast SYBR Green PCR Kit试剂盒说明书进行实时定量PCR检测Mcl-1的mRNA表达。PCR引物由上海生物工程公司合成,引物序列见表1。扩增条件为:95 ℃ 5 min;95 ℃ 10 s,57 ℃ 30 s,72 ℃ 1 min,共40个循环。应用2-ΔΔCt法对结果进行分析。
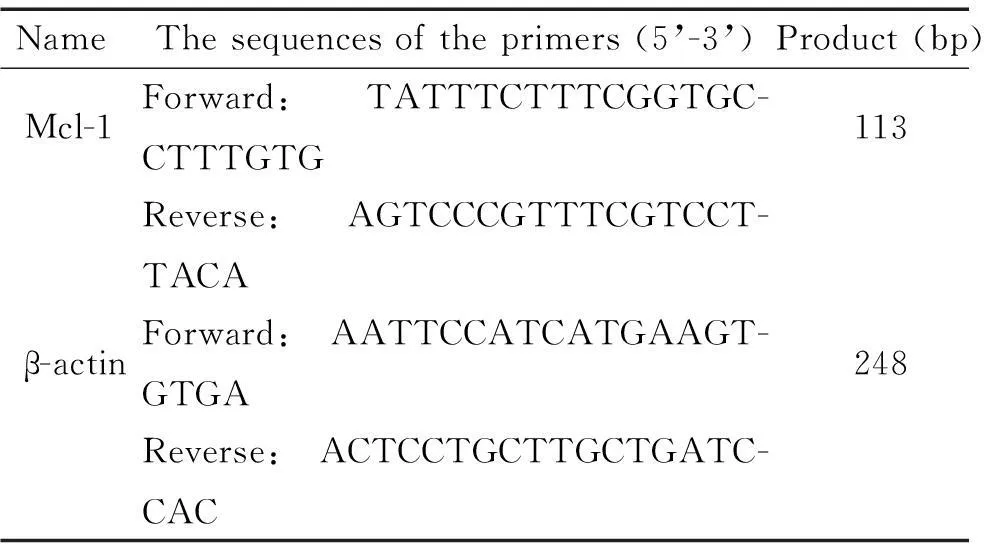
表1 引物序列
3.6应用Western blot检测Mcl-1的蛋白表达用蛋白裂解液裂解小鼠腹腔巨噬细胞后分别提取各组细胞总蛋白,BCA法进行蛋白浓度测定及配平,10% SDS-PAGE分离蛋白质,半干电转将蛋白转移到PVDF膜上(23 V,40 min),室温封闭2 h,与1∶1 000 兔抗鼠Mcl-1多抗反应后,用辣根过氧化物酶标记的相应 II 抗孵育1 h,ECL法显色压片曝光,用凝胶成像仪分析系统对Western blot检测条带进行灰度值扫描,计算Mcl-1与β-actin吸光度比值,进行半定量统计学分析。
3.7应用Annexin V-APC/7-AAD凋亡试剂盒检测细胞凋亡提取各组小鼠腹腔巨噬细胞,根据凋亡试剂盒操作说明进行操作,将收集的细胞用冷的PBS洗涤2次,用预冷的1×Binding Buffer重悬细胞调整细胞数至1×109/L,每管加入100 μL细胞,5 μL的Annexin V-APC和10 μL的7-AAD,混合后避光于冰上静止30 min,最后每管加入400 μL预冷的1×Binding Buffer,30 min内上机检测。
4统计学处理
数据以均数±标准差(mean±SD)表示,利用SPSS 17.0软件处理数据,实验所得数据资料进行单因素方差分析(one-way ANOVA),应用SNK-q检验进行多个样本均数间的两两比较,以P<0.05为差异有统计学意义。
结果
1Mcl-1-shRNA最佳剂量及最佳处理时间的筛选
ELISA法检测结果显示,与对照组相比,在3种质粒浓度作用下小鼠腹腔巨噬细胞Mcl-1蛋白的表达均有不同程度的下调(P<0.05),其中每只75 μg和100 μg作用最为明显,但二者差异无统计学意义,故以每只75 μg作为Mcl-1-shRNA作用的最佳剂量。小鼠予BCG菌悬液感染造模,在感染后第1天的Mcl-1蛋白已有表达,并呈上升趋势,于第3天达高峰,随后表达逐渐降低,故选择Mcl-1蛋白表达水平最高的第3天为质粒开始作用的最佳时点,见图1。

Figure 1.The protein levels of Mcl-1 in the mouse peritoneal macrophages treated with Mcl-1-shRNA at different concentrations (A) and infected with BCG (B) determined by ELISA. Mean±SD.n=3.*P<0.05vs0 μg;#P<0.05vs50 μg;△P<0.05vs75 μg;▽P<0.05vs100 μg.
图1ELISA法检测各组小鼠腹腔巨噬细胞内Mcl-1蛋白的表达
2Mcl-1 mRNA表达水平的测定
应用2-ΔΔCt法分析后结果显示,与空白对照组相比,不同毒力结核杆菌感染的小鼠腹腔巨噬细胞Mcl-1 mRNA的表达水平均有不同程度的增高,其中以强毒株组和p7Rv组增高最为明显(P<0.05),p7Ra组和BCG组虽Mcl-1的mRNA水平有所上升,但与对照组相比差异不显著,而Mcl-1的mRNA表达水平并未因作用时间的不同而表现出明显差异。应用Mcl-1-shRNA质粒干预组与未用质粒干预的对照组相比,Mcl-1-shRNA质粒干预后各组Mcl-1的mRNA表达水平明显下调,其中未感染组下调约80%,最为明显(P<0.05),感染了p7Ra和BCG的小鼠腹腔巨噬细胞分别下调约74%和75%(P<0.05),感染了强毒株和p7Rv的小鼠腹腔巨噬细胞下调趋势稍弱,分别下调约65%和70%(P<0.05),见图2。
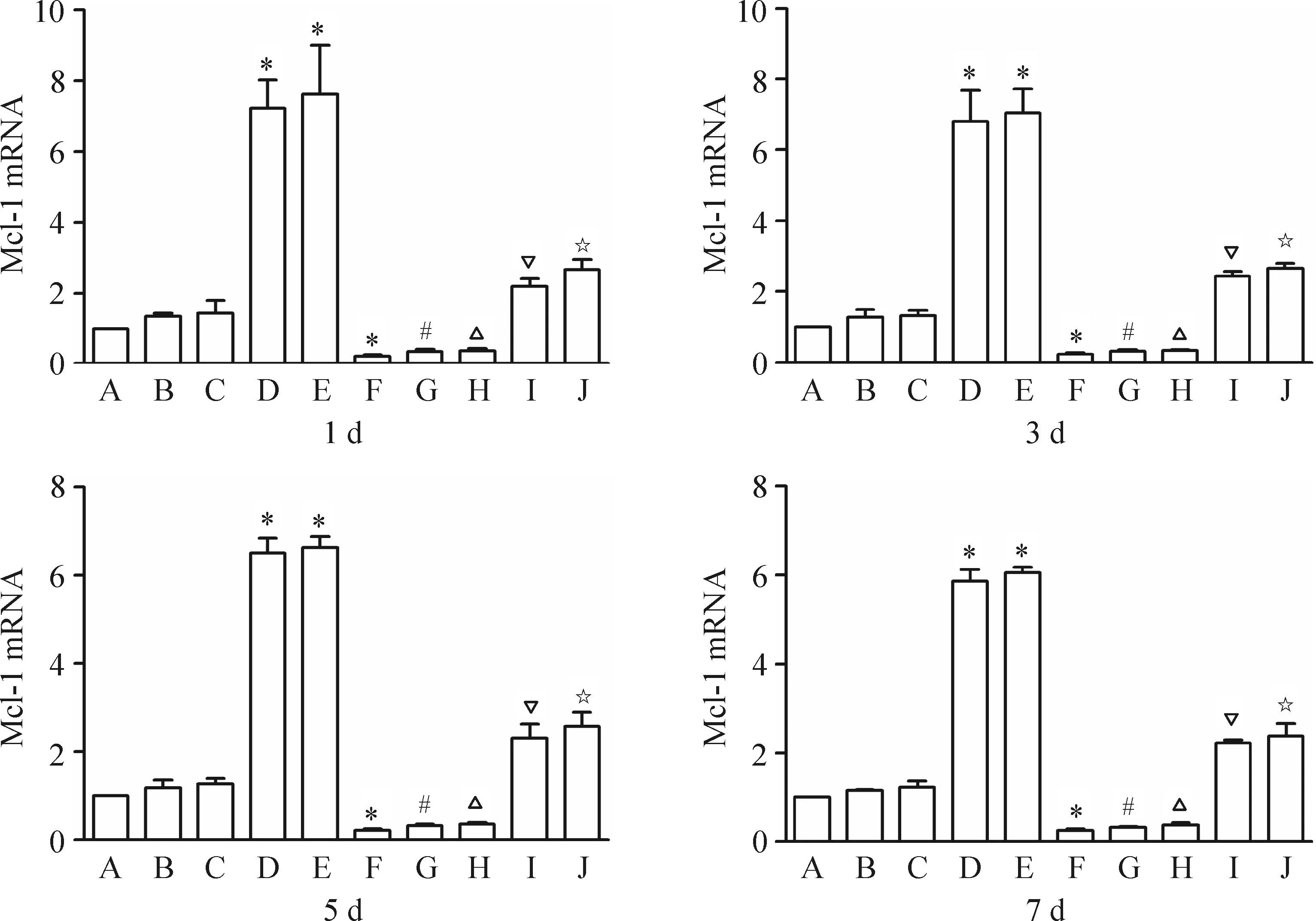
Figure 2.Real time-PCR was used to determine the mRNA expression of Mcl-1 in the mouse peritoneal macrophages infected with different virulence ofMycobacteriumtuberculosisand treated with or without Mcl-1-shRNA. A: control group; B: BCG group; C: p7Ra group; D: p7Rv group; E: virulence strains of Xinjiang group; F: Mcl-1-shRNA group; G: Mcl-1-shRNA+BCG group; H: Mcl-1-shRNA+p7Ra group; I: Mcl-1-shRNA+p7Rv group; J: Mcl-1-shRNA+virulence strains of Xinjiang group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsBCG group;△P<0.05vsp7Ra group;▽P<0.05vsp7Rv group;☆P<0.05vsvirulence strains of Xinjiang group.
图2实时荧光定量PCR检测Mcl-1的mRNA表达
3Mcl-1蛋白表达水平的测定
Western blot结果显示,与空白对照组相比,不同毒力结核杆菌感染后小鼠腹腔巨噬细胞的Mcl-1蛋白表达水平均有不同程度的增高,其中以强毒株组和p7Rv组增高最为明显(P<0.05),分别为对照组的4.32倍和3.63倍,p7Ra组和BCG组的Mcl-1蛋白表达与对照组相比差异不显著,且Mcl-1蛋白的表达水平未因作用时间的不同而表现出明显差异(P>0.05)。应用Mcl-1-shRNA质粒干预组与未用质粒干预的对照组相比,Mcl-1-shRNA质粒干预后各组Mcl-1蛋白的表达水平明显下调,其中未感染组下调约67%(P<0.05),感染了BCG组、p7Ra组、p7Rv组和强毒株组分别下调约77%、79%、57%和63%(P<0.05),见图3。
4Annexin V-APC/7-AAD细胞凋亡的检测
流式细胞术检测结果显示,与空白对照组相比,感染了强毒株组、p7Rv组、p7Ra组和BCG组的小鼠腹腔巨噬细胞凋亡率均有不同程度的升高(P<0.05),且以建模后第5天凋亡率最高(P<0.05),其中p7Ra组和BCG组的凋亡率上升最为明显,强毒株组和p7Rv组的上升程度稍弱。应用Mcl-1-shRNA质粒干预组与未用质粒干预的对照组相比,Mcl-1-shRNA质粒干预后各组细胞凋亡率明显上调,其中以p7Ra组和BCG组上调程度最为明显,强毒株组、p7Rv组次之,未感染组上调趋势稍弱,见图4、表2。
讨论
细胞凋亡是机体在进化过程中形成的一种保守死亡方式,其在维持组织动态平衡、机体正常发育、排除受损或病毒感染的细胞中有着不可或缺的作用。早前研究发现结核分枝杆菌感染机体后,主要寄居存活在宿主巨噬细胞内,若宿主巨噬细胞发生凋亡,便可杀死寄生于其内的结核分枝杆菌,阻止其在体内繁衍播散,同时亦可将邻近未感染的巨噬细胞激活,增强机体清除杀伤结核分枝杆菌的能力[7]。因此,宿主巨噬细胞的凋亡影响着结核分枝杆菌的命运。近年研究表明宿主巨噬细胞凋亡水平因其感染结核分枝杆菌毒力的不同而存在差异[8],有毒的结核杆菌可通过多种机制阻止宿主细胞的凋亡,其中被广泛研究的是增加可溶性TNF受体的活化、减少FasL的激活、诱导抗凋亡蛋白的表达来抑制宿主细胞的凋亡。
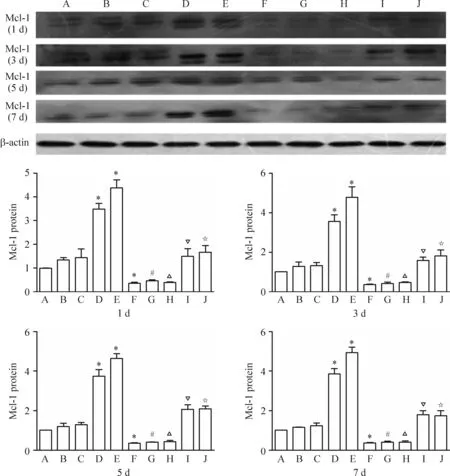
Figure 3.The protein expression of Mcl-1 in the mouse peritoneal macrophages infected with different virulence ofMycobacteriumtuberculosisand treated with or without Mcl-1-shRNA determined by Western blot. A: control group; B: BCG group; C: p7Ra group; D: p7Rv group; E: virulence strains of Xinjiang group; F: Mcl-1-shRNA group; G: Mcl-1-shRNA+BCG group; H: Mcl-1-shRNA+p7Ra group; I: Mcl-1-shRNA+p7Rv group; J: Mcl-1-shRNA+virulence strains of Xinjiang group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsBCG group;△P<0.05vsp7Ra group;▽P<0.05vsp7Rv group;☆P<0.05vsvirulence strains of Xinjiang group.
图3Western blot检测Mcl-1蛋白的表达
Bcl-2家族在凋亡过程中起着重要的调控作用[9],其由抗凋亡和促凋亡两类基因组成。Mcl-1是Bcl-2家族中的抗凋亡基因,与Bcl-2有着类似的结构和功能,其作用主要是维持细胞线粒体膜的稳定、抑制细胞色素C的释放、促进细胞的生存、抑制细胞的凋亡[10]。Mcl-1在多种细胞系的凋亡、分化和细胞周期调控中发挥着重要作用[11],由于它的半衰期短,可快速对细胞内外环境因素的改变做出反应,因此被认为是细胞内最为重要的抗凋亡因子[12]。Sly等[13]早期发现THP-1细胞和来源于人单核细胞系的巨噬细胞在吞噬结核分枝杆菌毒力株p7Rv后,其Mcl-1的mRNA表达水平均明显上调,并抑制了巨噬细胞的凋亡,用Mcl-1的mRNA反义寡脱氧核糖核酸处理后,被p7Rv感染的巨噬细胞的凋亡水平明显升高。随后有研究者用不同的细菌感染巨噬细胞,发现无论是长期的还是短暂的感染,巨噬细胞内Mcl-1的mRNA表达水平在感染前后均存在差异,并且这种表达的差异影响了巨噬细胞对细菌的清除[14]。

Figure 4.The apoptotic rates of the mouse peritoneal macrophages infected with different virulence ofMycobacteriumtuberculosisand treated with or without Mcl-1-shRNA analyzed by flow cytometry with Annexin V-APC/7-AAD staining.
图4细胞凋亡检测流式图

表2 各组小鼠腹腔巨噬细胞的凋亡率
*P<0.05vscontrol group;#P<0.05vsBCG group;△P<0.05vsp7Ra group;▽P<0.05vsp7Rv group;☆P<0.05vsvirulence strains of Xinjiang group;▲P<0.05vs1 d;▼P<0.05vs3 d;★P<0.05vs5 d;$P<0.05vs7 d.
目前对Mcl-1基因的研究主 要集中在肿瘤相关疾病中,Mcl-1高表达在多种肿瘤细胞系中, 并能阻碍肿瘤细胞凋亡, 对抗化疗药物的杀伤作用, 有研究者采用靶向沉默Mcl-1基因的方式, 通过RNA干扰技术下调肿瘤细胞中Mcl-1基因的表达,发现肿瘤细胞的凋亡率被显著上调, 并且正常细胞未受到明显影响[15]。基于以上研究结果,我们以动物体内实验为主,探讨不同毒力的结核杆菌感染在体内能否诱导Mcl-1基因的表达,并验证RNA干扰技术能否下调感染巨噬细胞内Mcl-1基因的表达水平。本研究发现小鼠感染的结核杆菌毒力越强所诱导的Mcl-1mRNA和蛋白的表达水平越高,感染p7Ra和BCG菌株后虽可诱导Mcl-1的表达,但与空白对照组相比并无显著差异,Mcl-1-shRNA质粒作用后明显下调了各组细胞内Mcl-1的表达,其中感染p7Ra和BCG组下调趋势明显高于强毒株和p7Rv组,由此我们推测Mcl-1主要被毒力强的结核杆菌所诱导,Mcl-1-shRNA可有效抑制Mcl-1基因的表达。此外,为了更详尽地探讨Mcl-1对感染不同毒力结核杆菌小鼠腹腔巨噬细胞凋亡的影响,本研究检测了各组细胞的凋亡率,结果发现结核杆菌毒力越强宿主巨噬细胞的凋亡率越低,这与早前的研究结果一致,Mcl-1-shRNA质粒作用后明显上调了各组细胞的凋亡水平,且感染了p7Ra和BCG组比感染了强毒株和p7Rv组更能显著地诱导宿主细胞的凋亡,并于第5天凋亡率最高,而Mcl-1的表达水平并未因作用时间的不同而出现差异,由此我们推测Mcl-1被毒力菌诱导可能是其一种抗凋亡机制;下调Mcl-1基因的表达可增强宿主巨噬细胞的凋亡水平; Mcl-1亦可能通过直接或间接影响其它抗凋亡途径来调控宿主细胞的凋亡水平; Mcl-1的抗凋亡作用可能是结核杆菌在宿主细胞内生存以及衍生扩散的重要原因。
本研究发现寄居于宿主巨噬细胞内的结核杆菌可通过诱导抗凋亡基因Mcl-1的表达来遏止宿主细胞的凋亡,并且Mcl-1的表达水平与结核杆菌毒力的强弱有关。Mcl-1-shRNA可明显沉默受结核杆菌感染的巨噬细胞内Mcl-1的表达,并上调宿主细胞的凋亡水平,由此阐明Mcl-1基因表达的高低影响着结核杆菌宿主细胞的凋亡,且有毒的结核杆菌所高表达的Mcl-1可能为其逃避宿主细胞的杀伤提供一个额外的保护。本研究为今后防治结核病提供了一个新方向,然而Mcl-1-shRNA作用在体内有无其它影响还有待进一步验证,且结核病的发生发展由诸多因素影响,毒力株通过何种机制诱导Mcl-1的表达还需深入研究。
[参考文献]
[1]Dhiman R, Indramohan M, Barnes PF, et al. IL-22 produced by human NK cells inhibits growth ofMycobacteriumtuberculosisby enhancing phagolysosomal fusion[J]. J Immunol, 2009, 183(10):6639-6645.
[2]Schacter JL, Henson ES, Gibson SB. Estrogen regulation of anti-apoptotic Bcl-2 family member Mcl-1 expression in breast cancer cells[J]. PLoS One, 2014, 9(6):e100364.
[3]Yamashita M, Shinohara T, Tsuji S, et al. Catalytically inactive cyclooxygenase 2 and absence of prostaglandin E2biosynthesis in murine peritoneal macrophages followinginvivophagocytosis of heat-killed mycobacterium bovis Bacillus Calmette-Guérin[J]. J Immunol, 2007, 179(10):7072-7078.
[4]Rahman A, Sobia P, Gupta N, et al.Mycobacteriumtuberculosissubverts the TLR-2-MyD88 pathway to facilitate its translocation into the cytosol[J]. PLoS One, 2014, 9(1):e86886.
[5]王婵, 王新敏, 王飞雨, 等. Mcl-1短发夹RNA在Raw264.7细胞内特异性的筛选[J]. 中国免疫学杂志, 2015, 31(2):151-155.
[6]McCaffrey AP, Meuse L, Pham TT, et al. RNA interfe-rence in adult mice[J]. Nature, 2002, 418(6893):38-39.
[7]Riendeau CJ, Kornfeld H. THP-1 cell apoptosis in response to mycobacterial infection[J]. Infect Immun, 2003, 71(1):254-259.
[8]董江涛, 徐芳, 田玺择, 等. 不同毒力结核分枝杆菌感染小鼠对肺泡巨噬细胞的凋亡率及其时相性变化的影响[J]. 中国免疫学杂志, 2012, 5(28):389-392.
[9]王倩, 邹健, 张秀芬, 等. GCS通过MEK/ERK通路调控白血病多药耐药细胞凋亡相关基因bcl-2的表达[J]. 中国病理生理杂志, 2015, 31(1):114-118.
[10]孙凤娥, 方浩. Mcl-1蛋白的结构、功能及其抑制剂的研究进展[J]. 中国医药工业杂志, 2013, 44(3):296-302.
[11]Petros AM, Swann SL, Song D, et al. Fragment-based discovery of potent inhibitors of the anti-apoptotic MCL-1 protein[J]. Bioorganic Med Chem Lett, 2014, 24(6):1484-1488.
[12]Akagi H, Higuchi H, Sumimoto H, et al. Suppression of myeloid cell leukemia-1 (Mcl-1) enhances chemotherapy-associated apoptosis in gastric cancer cells[J]. Gastric Cancer, 2013, 16(1):100-110.
[13]Sly LM, Hingley-Wilson SM, Reiner NE, et al. Survival ofMycobacteriumtuberculosisin host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2 family member Mcl-1[J]. J Immunol, 2003, 170(1):430-437.
[14]Marriott HM, Bingle CD, Read RC, et al. Dynamic changes in Mcl-1 expression regulate macrophage viability or commitment to apoptosis during bacterial clearance[J]. J Clin Invest, 2005, 115(2):359-368.
[15]张荣环, 赵菊. 髓样细胞白血病因子-1研究进展[J]. 现代中西医结合杂志, 2014, 23(6):680-684.

*[基金项目]国家自然科学基金资助项目(No. 81202949; No. 81370381);山东省自然科学基金联合专项(No. ZR2014HL013);山东省医药卫生科技发展计划项目(No. 2013WSB31009)
▲并列第1作者
Effects ofMcl-1 silencing on apoptosis of mouse peritoneal macrophages infected with different virulence ofMycobacteriumtuberculosisWANG Fei-yu1,4, WANG Xin-min3, WANG Chan2,4, WANG Xiao-fang1,4, ZHANG Yu-qing1,4, WU Jiang-dong1,4, WU Fang1,4, ZHANG Wan-jiang1,4, ZHANG Le1,4
(1DepartmentofPathophysiology,2DepartmentofPathogenBiologyandImmunology,3DepartmentofUrinarySurgery,FirstAffiliatedHospital,4KeyLaboratoryofXinjiangEndemicandEthnicDiseasesCooperatedbyEducationMinistrywithXinjiangProvince,MedicalCollegeofShiheziUniversity,Shihezi832002,China.E-mail: 1257067540@qq.com)
[ABSTRACT]AIM: To investigate the effect of inhibiting Mcl-1 gene expression on apoptosis of mouse peritoneal macrophages infected with different virulence of Mycobacterium tuberculosis using a technique of RNA interference. METHODS: The BALB/c mice were infected with prepared bacterium of the virulence strains of Xinjiang, p7Rv, p7Ra and BCG. Mcl-1-shRNA was applied to the mouse model of infection, and the control groups were set up. On 1 d, 3 d, 5 d and 7 d, the mouse peritoneal macrophages were collected. The expression of Mcl-1 at mRNA and protein levels was determined by real-time PCR and Western blot. The apoptotic rate of peritoneal macrophages was analyzed by flow cytometry. RESULTS: The expression of Mcl-1 at mRNA and protein levels was up-regulated in the peritoneal macrophages from the mice infected with different virulence of Mycobacterium tuberculosis, and the cells from the mice infected with virulence strains of Xinjiang and p7Rv expressed higher level of Mcl-1 than the uninfected control cells (P<0.05). The expression of Mcl-1 at mRNA and protein levels was reduced by RNA interference as compared with control group (P<0.05). Inhibition of Mcl-1 expression induced apoptosis of peritoneal macrophages in the mice. CONCLUSION: The Mcl-1 expression at mRNA and protein levels in mouse peritoneal macrophages infected with different virulence of Mycobacterium tuberculosis was effectively suppressed by Mcl-1-shRNA, which can induce macrophage apoptosis.
[KEY WORDS]Mycobacterium tuberculosis; Mcl-1 gene; Peritoneal macrophages; RNA interference; Apoptosis
通讯作者△秦树存 Tel: 0538-6237252; E-mail: shucunqin@hotmail.com; 姚树桐 Tel: 0538-6225010; E-mail: yst228@126.com
[收稿日期]2015- 07- 03[修回日期] 2015- 07- 22
[文章编号](责任编辑: 陈妙玲, 罗森)1000- 4718(2015)12- 2202- 07
doi:10.3969/j.issn.1000- 4718.2015.12.014
[中图分类号]R363.1
[文献标志码]A
