电动势测定在物理化学实验中的应用
2016-01-27赵会玲宋江闯
赵会玲 宋江闯 熊 焰
(华东理工大学化学实验中心,上海 200237)
电动势测定在物理化学实验中的应用
赵会玲宋江闯*熊焰
(华东理工大学化学实验中心,上海 200237)
摘要:电动势测定是重要的电化学测量技术之一,也是物理化学实验教学中的重要内容,通过原电池电动势的测定可以获得氧化还原反应的许多热力学性质,如反应的热力学函数变化值和反应的平衡常数,电解质溶液的活度系数、平衡常数、酸碱度,配合物的络合常数等。本文系统介绍电动势法在物理化学实验中的应用。
关键词:电动势;活度系数;热力学函数;pH值;电势-pH图
1引言
原电池电动势是外电路为零时电池各个相界面电位差的代数和,即等于正极的电极电势减去负极的电极电势。电动势法的测定是物化实验中的基本技能,通过电动势的测定可以获得获得多种化学反应及电解质溶液的性质参数,目前国内高校普遍开设电动势的测量及应用相关实验,本文系统总结了电动势测定不同物理化学实验中的应用。
2电动势测定原理
电动势的测定必需在可逆条件下进行,因而电动势测定方法中通常选择抵消法测定原电池电动势。抵消法是在测定装置中连接了一个与待测电池方向相反但电动势大小相等的外电势,如图1所示。当电位差计输出电压与原电池电动势量值相等、方向相反,检流计指针不偏转,即可认为原电池已处于电化学平衡状态。工作回路由工作电池E、可变电阻R和划线电阻AB组成。测量回路由双向开关S、待测电池Ex(或标准电池Es)、单向开关K、检流计G和均匀滑线电阻的一部分。这里,工作回路中的工作电池与测量回路中的待测电池并接,当测量回路中电流为零时,工作电池在滑线电阻AB上的某一段电位降恰好等于待测电池的电动势。
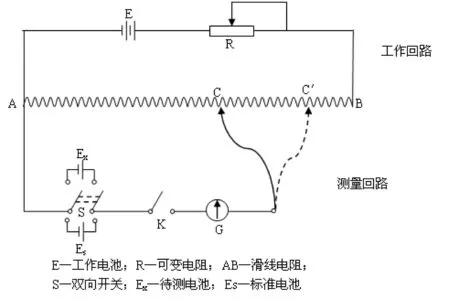
图1 抵消法测定原电池电动势的工作原理图
3电动势测定在物理化学实验教学中的应用
3.1 求化学反应的热力学函数
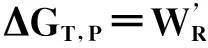
Δr=Gm=-zFE
由公式可以看出,只要测量电池的电动势即可得到电池反应的吉布斯自由能变。再根据公式
推出
因而可得公式:
根据热力学公式:
ΔrHm=ΔrGm+TΔrSm
可求得电池反应的摩尔焓变:
采用电动势法测反应的热力学函数,具有装置简单,操作方便,用时短等优点,且不会破坏被测物质,比如溶液及离子的结构和存在状态。能较好地加深学生对热力学和电化学知识的理解。
3.2 求电解质溶液平均活度及活度系数
电动势法的另一个重要的应用是测定电解质溶液平均活度和活度系数[6]。活度是离子的有效浓度,指离子在实际上做为完全独立的运动单位时所表现出来的浓度。活度是化学势的度量,为体系的强度性质,无因次量。从理想溶液的公式出发所到得的一些热力学公式,只要把其中的浓度项用相应的活度表示,就能用于理想或非理想的任何溶液。为了描述真实溶液与理想溶液的偏差以及活度与浓度间的关系,引入活度系数γi,它与活度a,质量摩尔浓度m之间的关系为:
对于电解质溶液,由于溶液是中性的,所以单个离子活度和活度系数是不可测量的,通过实验只能测量离子的平均活度系数γ±γ±,它与平均活度a±a±,平均质量摩尔浓度m±m±之间的关系为:
以氢电极与银-氯化银电极组成的单一液电池为例,电池表达式为
Pt|H2(g,pe)|HCl(m)|AgCl(s)-Ag
该电池反应式为:

电池电动势为:
上式中a+a+,a-a-分别表示H+H+和Cl-Cl-的活度,由于HCl是1-1型电解质,m+=m-=mm+=m-=m,因此
a+·a-=a±2=γ±2(m±/me)2=γ±2·(m/me)2
整理得
由公式可以看出,只要查得电池EeEe的值并测定不同HCl浓度下的电池电动势,即可求出不同HCl浓度时的γ±γ±值。通过此类实验可以加深学生对活度,活度系数,平均活度,平均活度系数等概念的理解。
采用电动势法测定电解质的活度系数在一定的浓度范围内是准确的,一般情况下较高浓度时的活度系数是用等压法进行测定的,但是由于等压法不如电动势法操作简便且标准溶液不易获得(尤其是混合溶剂的标准溶液)。
3.3 pH的测定
选择对氢离子有响应的氢离子指示电极,把氢离子指示电极(对氢离子可逆的电极)与参比电极(一般是用饱和甘汞电极)组成电池,由于参比电极的电极电势在一定条件下是不变的,原电池的电动势就会随着被测溶液中氢离子的活度而变化,因此,可以通过测量原电池的电动势,进而计算出溶液的pH值[7]。这也是电解质溶液活度测定实验的延伸。
常用的氢离子指示电极有氢电极,玻璃电极和醌氢醌电极。氢电极适用于 pH=0~14的整个范围,但实际应用起来不方便,故在实际工作中常用其他的氢离子指示电极如醌氢醌电极和玻璃电极。
醌氢醌电极构造和操作都很简单,反应较快,不易中毒,不易损坏。对溶有气体的溶液,氧化还原性不强的溶液,含有盐类及氢电位系以上金属的溶液和未饱和的有机酸都可以进行测定,准确度达到0.01 pH。
醌氢醌法测定溶液pH值的实验过程中需要注意:在25℃下待测液pH=7.7时,醌-氢醌电极电位与饱和甘汞电极电位相等;pH<7.7时醌-氢醌电极为正极, 7.7
醌氢醌电极不适用于碱性溶液和含有强氧化剂的溶液,而且醌氢醌的加入会污染溶液。这些都是醌氢醌电极的缺点。
当玻璃电极与另一甘汞电极构成原电池,通过测定原电池电动势求出溶液的pH值。由于玻璃电极不受溶液中存在的氧化剂、还原剂的干扰,也不受各种“毒物”的影响,使用方便,因而得到广泛的应用。
3.4 求反应的平衡常数
在长期实践中,定义了许多实用的平衡常数如Kp、Kc、Kx、Kf、Ka等[8],它们分别表示平衡时参与反应各物质的分压、浓度、摩尔分数、逸度和活度之间的关系。20世纪70年代以来,ISO推荐了标准平衡常数Kθ,它是无量纲的物理量, 其量值只取决于反应的特性,以及温度和标准状态的选择。通过物理性质的测定求出平衡体系的组成,然后计算出平衡常数,也可以利用化学分析的方法测定平衡体系中各物质的浓度,但加入试剂往往会干扰平衡,使所测得的浓度并非平衡时的真正浓度。另外一种计算平衡常数的方法是电动势法,由热力学可知,反应的标准吉布斯自由能变化和平衡常数有如下关系:
又因:
ΔrGm=-zFE
所以
-zFE=-RTlnKθ
这是电化学方法计算化学反应标准平衡常数的基本公式,通过测定电池电动势进而计算出反应的标准平衡常数。
3.5 离子浓度的测定
离子选择电极(ISE)是非常常见的一种电化学传感器,是专门用来测定溶液中某种离子浓度的指示电极,其电极电势与溶液中给定离子的活度符合能斯特方程,离子选择电极包含有由特殊的电活性物质组成的敏感膜,对溶液中某种离子的活度具有选择性响应,测定离子电极与参比电极组成的电池的电动势,就可以计算出被测溶液中某种离子组分的活度(浓度)。
由离子选择电极(作为指示电极)和参比电极构成无液接电势的原电池,其电动势为:
其中,n为离子的电荷数(阳离子n取正值,阴离子n取负值),x为待测离子,axax为待测离子的活度,当溶液浓度足够稀时活度等于浓度。
离子选择电极的使用可以大大简化物化实验步骤[9]。
难溶盐的活度积,弱电解质的电离度和配合物的络合常数实际上是它们在溶液中溶解过程的平衡常数,是无量纲量,也可以依此原理测定。以难溶盐的活度积为例,难溶盐活度积也称为溶度积,用Ksp表示。利用吉布斯自由能变和标准平衡常数的关系计算出Ksp的值。
其中,n为反应电荷数,Mn-和Mn+分别为微溶盐的阴阳离子。
测定配合物络合常数的方法经常采用分光光度法,但其所需试剂准备繁琐,也有报道用萃取法测定混配配合物稳定常数的方法,而采用电动势法也是测定配合物络合常数的重要方法之一[10]。
3.6 电势-pH图
电势-pH图也是高校物理化学实验内容之一[11-13]。在一定的温度、浓度之下,电极电势仅与溶液的pH有关,由此绘制出一系列的等温、等浓度的电势与pH的关系线,即为电势-pH图。研究电极电势、浓度和pH之间的函数关系,可以解决水溶液中发生的一系列反应及平衡的问题。从这些图可以知道各组分生成的条件以及这些组分稳定存在的范围,它对解决在水溶液中发生的一些了反应及平衡问题具有很好的应用价值。
物化实验中通常选择测定Fe3+/Fe2+-EDTA络合体系在不同pH条件下的电极电势,绘制电势-pH曲线,电极电势随pH值的变化有以下3种情况。
(1)在一定pH范围内,Fe3+/Fe2+能与EDTA生成稳定的络合物FeY2-和FeY-,其电极反应为
FeY-+e↔↔FeY2-
根据能斯特(Nernst)方程,其电极电势为
(2)当溶液pH值偏酸性时,电极反应为:
FeY-+H++e↔FeHY-
电极电势为:
在m(Fe3+)/m(Fe2+)m(Fe3+)/m(Fe2+)不变时,φφ与pH值呈线性关系。
(3)当溶液pH值偏碱性时,电极反应为:
Fe(OH)Y2-+e↔FeY2+OH-
电极电势为:
在m(Fe3+)/m(Fe2+)m(Fe3+)/m(Fe2+)不变时,φφ与pH值呈线性关系。
可以从电势-pH图上清楚地看出一个电化学体系中,可以发生各种电化学反应的反应条件,或者可以判断给定条件下某电化学反应发生的可能性。
3.7 细胞膜电势
细胞是生命活动的基本单位.生物体的每个细胞都被厚度约为(60~100)×10-10m的细胞膜所包围,细胞膜内、外都充满液体,在液体中都溶有一定量的电解质。在细胞膜内外的电解质中,K+离子比Na+和C1-离子更容易透过细胞膜,因此细胞膜两侧K+离子的浓度差最大,两边离子浓度不等而引起的电位差则形成膜电势。
细胞膜电势的存在意味着细胞膜上有一双电层,相当于一些偶极分子分布在细胞表面。比如心肌收缩和松弛时,心肌细胞膜电势不断变化,因此心脏总的偶极矩以及心脏所产生的电场也在变化。心动电流图,即心电图就是测量人体表面几组对称点之间由于心脏偶极矩的变化所引起的电势差随时间的变化情况,从而判断心脏工作是否正常。实验表明,我们的思维以及通过视觉、听觉和触觉器官接受外界的感觉,所有这些过程都与细胞膜电势的变化有关,了解生命需要了解这些电势差是如何维持以及如何变化的,这个研究领域正越来越为人们重视。
参考文献
[1]金丽萍,邬时清,陈大勇编.物理化学实验.2版,上海:华东理工大学出版社,2005:109.
[2]董超,李建平编.物理化学实验.北京:化工出版社,2011:57.
[3]庞素娟,吴洪达主编.物理化学实验.武汉:华中科技大学出版社,2009:140.
[4] 孙尔康,张剑荣,刘勇健,白同春.物理化学实验.1版,南京:南京大学出版社,2009:55.
[5]韩国彬主编.物理化学实验.1版,厦门:厦门大学出版社,2010年:103.
[6]韩国彬主编.物理化学实验.1版,厦门:厦门大学出版社,2010年:128 .
[7]叶大陆主编.物理化学实验. 北京:冶金工业出版社 ,1986:215.
[8]胡英.物理化学.5版,北京:高等教育出版社,2007:182.
[9]王明德,王耿,吴勇.物理化学实验.1版,西安:西安交通大学出版社,2013:126 .
[10]庞素娟,吴洪达主编.物理化学实验.武汉:华中科技大学出版社,2009:147.
[11]刘红,李锦莲,白术杰,李秀玲.混合溶剂中硫酸镁离子对缔合常数的测定及其影响因素.化学世界,2004, (7), 344-347.
[12]孙尔康,张剑荣,刘勇健,白同春.物理化学实验.1版,南京:南京大学出版社,2009:68.
[13]刘展鹏,易兵.物理化学实验.1版,湘潭:湘潭大学出版社 ,2009年:90.

信息简讯
赛智VI2010色谱工作站
中标福建省2015年“农产品质量安全监测大赛”招标项目
2015年1月26日,在福建林业职业技术学院举办的福建省2015年“农产品质量安全监测大赛”招标项目中,赛智科技生产的VI2010色谱工作站成功中标,成为这次大赛的唯一指定软件提供商。不仅为参赛方提供考试专用色谱软件(液相色谱及气相色谱),并且在考试环节中提供色谱相关的技术指导和维护工作。
这次竞赛指定的VI2010色谱工作站版本为考试专用版本,与赛智科技正常出售用于一般仪器使用的软件在版本和操作上有所区别。因此建议采购赛事软件的职业大专院校及事业单位等用户可与赛智科技直接联系,也可与这次大赛的公司合作经销商厦门亿辰科技有限公司联系。赛智科技将对通过正常渠道购买比赛软件的用户进行全程技术指导,并提供在线视频操作及日常维护服务。如有通过其他渠道购买的赛智科技VI2010色谱工作站,因版本不同可能会导致与比赛软件不兼容等造成用户不能正常使用等问题。(赛智)
大赛色谱工作站合作经销商及联系方式:
厦门亿辰科技有限公司
陈先生:13906019811
赛智科技(杭州)有限公司
全国服务热线:400-001-2010
公司总机:0571-28021919
技术热线:0571-28021930
Application of measuring electromotance in physicalchemistry experiment teaching.
ZhaoHuiling,SongJiangchuang*,XiongYan
(EastChinaUniversityofScienceandTechnology,Shanghai, 200237,China)
Abstract:Measuring electromotance is not only an important measurement in electrochemistry but also an important content of physicalchemistry experiment teaching. This measuring technique can be used to measure lots of thermodynamic properties, such as thermodynamic function, equilibrium constant, activity coefficient, pH value, complexation constant etc., they are obtained by measuring electromotance. In this paper, the application of measuring electormotance is introduced systematically.
Key words:electromotance; activity coefficient; thermodynamic function; pH value; potential-pH diagram
收稿日期:2014-10-24
DOI:10.3936/j.issn.1001-232x.2015.02.019
通讯作者:*宋江闯,女,1978出生,Email:misong@ecust.edu.cn。
作者简介:赵会玲:女,1974出生,博士,高级实验师,Email:huilingzhao@ecust.edu.cn。
基金项目:上海高校实验队伍建设计划(YJ0114210)
