薄壳山核桃愈伤组织诱导的影响因素
2016-01-27吕运舟窦全琴蒋泽平
吕运舟,窦全琴,蒋泽平
(江苏省林业科学研究院,江苏 南京 211153)
薄壳山核桃愈伤组织诱导的影响因素
吕运舟,窦全琴,蒋泽平
(江苏省林业科学研究院,江苏南京211153)
摘要:以薄壳山核桃品种马罕×波尼的杂交种子为材料,研究不同外植体来源、不同培养基成分及不同质量浓度的植物生长调节剂对愈伤组织诱导效率的影响。结果表明,MS较1/2 MS和WPM培养基更加有利于薄壳山核桃愈伤组织的诱导和继代培养;最佳植物生长调节剂组合为2.0 mg/L NAA+ 0.1 mg/L 6-BA;种子苗幼茎较胚根、胚轴、幼叶更适于作为愈伤组织诱导的起始外植体,愈伤诱导率为72.79%。
关键词:薄壳山核桃;组织培养;愈伤组织;诱导;胚根;胚轴
文章编号:1001-7380(2015)05-0029-04
收稿日期:2015-09-16;修回日期:2015-10-15
基金项目:江苏省林业科学研究院青年基金项目“美国薄壳山核桃组织培养研究”(JAF-2012-08);2013年江苏省林业三新工程项目“薄壳山核桃早果丰产栽培技术及模式集成示范”(lysx[2013]06)
作者简介:吕运舟(1983-),男,安徽六安人,博士,从事林木遗传育种及栽培工作。
中图分类号:S664.1;Q943.1
文献标志码:A
doi:10.3969/j.issn.1001-7380.2015.05.009
Impact factors of the callus inducement and growth
ofCaryaillinoensisin vitro culture
LYU Yun-zhou, DOU Quan-qin, JIANG Ze-ping
(Jiangsu Academy of Forestry, Nanjing 211153,China)
Abstract:The hybrid seeds between ‘Mahan’ and ‘Pownee’ were used to resarch the effect of different explant, different component of media and different concentration of plant growth regulators on the efficiency of callus induction. The results showed that MS basic medium was more suitable for callus induction and subculture of Carya illinoensis,and 2.0 mg/L NAA+ 0.1 mg/L 6-BA was the optimal combination. The tender stem segments were more suitable for callus induction compared with radicle, hypocotyls and spires, with the induction rate of 72.79%.
Key words:Carya illinoensis; Tissue culture; Callus; Induction; Radicle; Hypocotyl
薄壳山核桃[Caryaillinoensis(Wangenh. ) K. Koch. ]又名美国山核桃、薄壳山核桃、长山核桃, 属胡桃科(Juglandaceae)山核桃属( Carya Nutt)[1],原产北美,是世界著名干果之一, 也是优良的果材兼用树种[2]。
薄壳山核桃推广面积逐年增大,目前良种繁育主要依靠嫁接繁殖,但是需要大量砧木且技术要求高、人工成本大。组织培养快速繁育技术是保持薄壳山核桃优良性状和加快繁殖的有效手段,可促进该树种的推广和利用[3-4]。国外研究者开展薄壳山核桃组织培养研究较早,并取得了一定进展,但尚未建立成熟的再生体系[5-7]。Mathews等[5]利用未成熟胚成功诱导出薄壳山核桃体细胞胚,但是未能实现增殖和生根。已有多篇文献报道,利用带芽的茎段作为外植体,可以诱导分化不定芽,但都存在继代困难、生根困难等难题[6-7]。在国内,董筱昀等[8]、傅玉兰等[9]已开展了薄壳山核桃的外植体消毒及茎段诱导、增殖等相关技术的研究,但并未突破关键技术,实现扩繁体系。研发薄壳山核桃愈伤组织诱导,进而建立间接植株再生体系,可以为其扩繁提供新的思路,也为遗传改良奠定基础。
本试验研究了不同培养基组成,不同植物生长调节剂配比,不同外植体材料等因素对薄壳山核桃愈伤组织诱导的影响,初步建立了薄壳山核桃愈伤组织诱导方法。
1材料与方法
1.1 供试材料
采集人工控制授粉的马罕×波尼的杂交种子,采取恒温培养箱催芽(30 ℃), 出芽后移植育苗盘置于温室内生长(室温25 ℃,光照强度为1 500~2 000 lx,光照时间16 h/d),剪取胚轴、胚根及幼苗茎段(未木质化)、幼叶为接种外植体。
1.2 外植体灭菌方法
将外植体剪成3~4 cm长度,洗衣粉浸泡清洗,流水冲洗3 h以上,75%酒精溶液浸润30 s,无菌水冲洗1次,0.1% HgCl2溶液浸泡灭菌,期间不断摇晃,灭菌脱毒时间2~8 min,再用无菌水冲洗5~7遍,吸水纸吸干外植体表面水珠,剪成1~2 cm置于愈伤诱导培养基。
1.3 培养基及培养条件
愈伤诱导培养基包括(1)在附含2.0 mg/L NAA,0.5 mg/L 6-BA的MS,1/2 MS和WPM培养基。(2)以MS为基本培养基,附加0~3 mg/L NAA,0~3 mg/L 2,4-D和 0~0.5 mg/L 6-BA。所有培养基均附含30.0 g/L蔗糖,10.0 mg/L肌醇,500 mg/L水解酪蛋白(CH),10.0 mg/L维生素C,6.0 g/L琼脂。pH 5.80,于(23±1)℃下暗培养。
1.4 统计分析
培养30 d后统计愈伤分化率。每个组合每次接种不少于30个外植体,每组重复3次。愈伤诱导率(%)=分化愈伤外植体数/接种外植体总数×100。
2结果与分析
2.1 灭菌时间对不同外植体的影响
植物愈伤组织诱导过程是体细胞脱分化过程,与其细胞分裂活力紧密相关[10]。灭菌过程不仅清除了外植体表面微生物,同时也会对植物细胞产生一定伤害,影响分化能力。为了尽可能减少对薄壳山核桃外植体体细胞伤害,设置了从2~8 min灭菌时间。试验结果如表1,随着灭菌时间的增加,外植体胚根、胚轴、幼茎及幼叶的污染率递减,灭菌时间达到8 min,除幼茎外其他3种外植体污染率均为零,幼茎也只有4.4%。但是灭菌时间的增加对外植体褐化率呈正相关,特别是幼嫩组织胚轴与胚芽,灭菌8 min导致接种的45个外植体中分别有31个和33个发生褐化,褐化率为70%左右。因此,综合考虑对外植体污染率及褐化的影响,确定胚轴、胚根的灭菌时间为4 min,幼叶灭菌时间为6 min,而幼茎的灭菌时间最长,为8 min。

表1 不同处理时间的灭菌效果
每组试验接种45个外植体。
2.2 不同培养基成分对愈伤组织诱导效率的影响
薄壳山核桃愈伤组织的诱导培养分别采用MS, 1/2 MS和WPM培养基作为基础,采用蔗糖作为碳源并添加2.0 mg/L NAA,0.1 mg/L 6-BA植物生长调节剂。结果显示(如表2),薄壳山核桃幼茎在3种培养基中均可以形成愈伤组织,但愈伤诱导率存在明显差异,以含氮量高的MS作为基本培养基时幼茎愈伤诱导率为69.5%,显著高于1/2 MS,WPM时的53.7%和52.8%。此外,不同基本培养基来源的新生愈伤组织状态也存在差异。MS基本培养基上的愈伤组织质地致密,且颗粒较为均匀圆润,颜色淡黄; 1/2 MS培养基上生长的愈伤组织水质化较为严重,颜色较黄,不适于继代培养;而WPM培养基上诱导的愈伤组织颜色暗黄,呈松散颗粒状,继代之后容易褐化。多重比较结果可以看出,MS培养基上与其他2种培养基的愈伤诱导率差异显著,因此在外植体相同、外源调节剂相同的情况下,基本培养基成分对薄壳山核桃愈伤组织诱导率及愈伤状态的影响较大。
表2薄壳山核桃幼茎在不同培养基上愈伤诱导率及愈伤状态

处理愈伤诱导率/%愈伤状态MS69.5±4.1a 颜色淡黄,质地致密、水润1/2MS53.7±3.3b 颜色黄,水质化程度高WPM52.8±5.7b 颜色暗黄,呈松散颗粒状
以MS为基本培养基,每组合接种外植体不少于30个,每组重复3次。数值表示平均值±SD,不同字母表示在P<0.05时的Duncan多重范围的差异检验的显著性。
2.3 不同外植体的愈伤组织诱导特点
愈伤组织形成与外植体分化程度相关,一般生理年龄越小其脱分化能力越强。选择合适的外植体材料对于建立愈伤组织诱导体系具有重要意义。本试验选用4种薄壳山核桃外植体作为起始材料,于质量浓度2.0 mg/L NAA,0.1 mg/L 6-BA的MS培养基中暗培养,诱导愈伤组织,结果表明不同外植体的愈伤组织诱导率有所差异(如表3)。4种外植体在MS培养基上接种7~10 d后,均有愈伤组织形成,其中幼叶的愈伤诱导率最低,只有35.6%,另3种外植体的愈伤诱导率相近,胚根、胚轴及幼茎分别为55.6%,63.3%和54.4%。
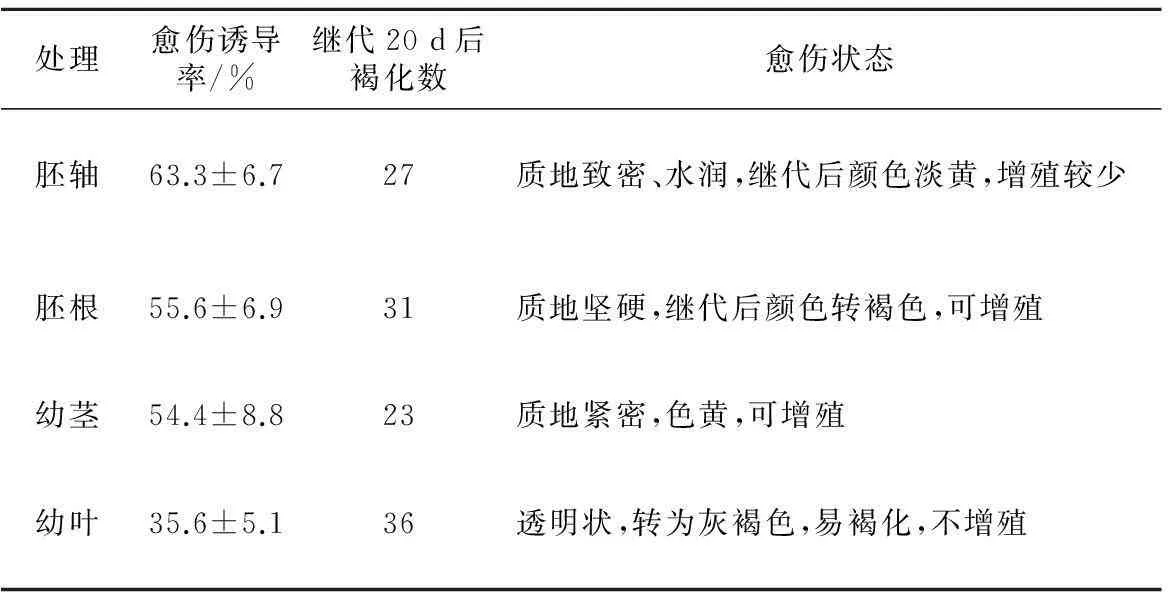
表3 不同外植体对薄壳山核桃愈伤组织诱导的影响
不同外植体形成的愈伤组织状态存在较大差异,以胚轴、幼茎诱导的愈伤组织状态较好(如表3),颜色淡黄、质地致密水润;胚根诱导的愈伤质地较硬,生长速度较慢;而幼叶在切口周围有少量愈伤生成,有透明装逐渐转变为灰褐色。此外,各种来源的愈伤组织继代后的生长特点也不同。分别接种50块愈伤,培养20 d后统计生长情况及褐化率发现,脱离外植体后幼叶产生的愈伤组织不能够增殖,36块愈伤组织团发生褐化,褐化率(褐化愈伤数/继代愈伤总数)达到72%,因此幼叶不能够作为薄壳山核桃愈伤组织诱导起始材料。较于胚根与胚轴,生理年龄更大的幼茎愈伤组织继代20 d的褐化率更低,为46%。因此,薄壳山核桃幼茎可作为愈伤组织诱导的外植体。
2.4 不同植物生长调节剂质量浓度对愈伤组织诱导的影响
在植物外植体在组织培养中产生愈伤的过程中,外源生长调节剂是影响诱导效率的重要因素。以MS为基本培养基,系统研究不同质量浓度生长素、细胞分裂素类物质对薄壳山核桃幼茎愈伤组织诱导率的影响,结果(见表4)显示,NAA为2.0 mg/L,6-BA为0.1 mg/L时的愈伤诱导率最高,为72.79%,而对照培养基不能诱导愈伤组织生成。在其他条件相同情况下,愈伤诱导率随着NAA质量浓度的提高而递增,当NAA增加至2.0 mg/L时,薄壳山核桃幼茎的愈伤诱导率略有下降,为56.12%,且愈伤组织结构变得松散,不利于后续分化。因此薄壳山核桃幼茎愈伤诱导NAA以2.0 mg/L为宜。
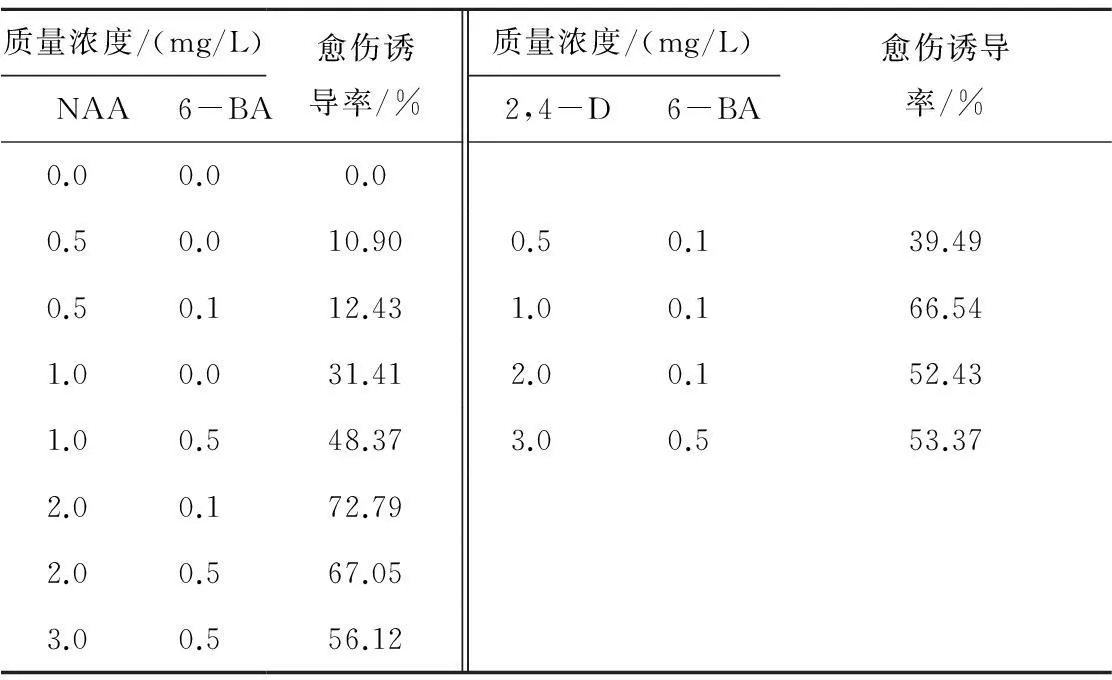
表4 幼茎在不同植物生长调节剂下的愈伤诱导率
此外,从表4可以看出,生长素类物质是诱导薄壳山核桃愈伤组织所必需的因素,而2,4-D在1.0 mg/L时诱导效率最高,为66.54%。适量添加6-BA可以增加薄壳山核桃愈伤组织诱导率,但其质量浓度增加到0.5 mg/L时,反而有一定的抑制作用,说明适度的生长素/细胞分裂素类物质配比可以有效提高愈伤形成及状态稳定。
3结论与讨论
本实验研究结果表明, 薄壳山核桃外植体在接种过程容易污染,选择温室萌发种子及幼苗为外植体来源,可以有效控制接种污染,但是取自萌发种子的胚轴、胚根的褐化率较高。而种子苗幼茎取材容易,接种污染率低,是薄壳山核桃愈伤组织诱导的理想材料。MS培养基较1/2 MS,WPM培养基更适于薄壳山核桃愈伤组织诱导,适当的生长素/细胞分裂素类物质配比比单一性诱导效果更好,因此,附含2.0 mg/L NAA,0.1 mg/L 6-BA的MS培养基为薄壳山核桃诱导愈伤的理想培养基。
基因型差异是影响植物愈伤组织诱导的重要因素[11],本试验为了减少遗传因素对实验结果的影响,选择马罕×波尼杂交子代群体作为研究材料,对于后续研究具有指导意义。薄壳山核桃在生长过程中容易积累多酚、醌类等次生代谢物质,可能是造成本实验中愈伤组织褐化的主要原因。鉴于愈伤组织继代过程中增殖较少、较易褐化的特点,笔者建议在以后的薄壳山核桃愈伤组织分化及遗传转化研究过程中,尽量减少继代次数,新生愈伤组织直接转入分化阶段,以提高不定芽分化率。
参考文献:
[1]董凤祥, 王贵禧. 美国薄壳山核桃引种及栽培技术[M].北京:金盾出版社,2003.
[2]陈芬,姚小华,高焕章,等.薄壳山核桃不同无性系开花物候特性观测和比较[J].林业科学研究,2015,28(2):209-216.
[3]吕运舟,董筱昀,黄利斌,等.不同育苗方式对薄壳山核桃苗木生长及根系结构的影响[J].江苏林业科技,2014,41(5):14-18.
[4]刘广勤,王秀云,生静雅, 等. 薄壳山核桃育种研究进展[J].林业科技开发. 2011, 25 (4):1-5.
[5]Mathews H,Wetzstein H Y.A revised protocol for efficient regeneration of somatic embryos and acclimatization of plantlets in pecan(Caryaillinoensis)[J].Plant Science,1993,91(1):103-108.
[6]Merkle S A,Wetzstein H Y,Sommer H E,et a1.Somatic embryogenesis in tissue cultures of pecan [J]. HortScience,1987,22(1):128-130.
[7]Cone-Olivares J,Phillips G C,Butler-Nance S A.Micropropagation of pecan [J]. HortScience,1990,25(10):1308.
[8]董筱昀,蒋泽平,蒋春,等.薄壳山核桃试管离体培养中不定芽诱导及增殖技术的研究[J].江苏林业科技,2013,40(3):10-14.
[9]傅玉兰,谷凤,吴炜.美国山核桃组培中材料灭菌的研究[J].安徽农业大学学报,2004,31(2):169-172.
[10]Tang W, Newton R J. Plant regeneration from callus cultures derived from mature zygotic embryos in white pine (PinusstrobusL.) [J]. Plant Cell Reports, 2005, 24: 1-9.
[11]Pazos-Navarro M, Del Río J A, Ortuo A, et al. Plant regeneration from different explant types ofBituminariabituminosaand furanocoumarin content along plant regeneration stages[J]. Plant Growth Regulation: An International Journal on Natural and Synthetic Regulators, 2013, 70 (2):123-127.

