金属离子对尖孢镰刀菌发酵液中果胶酶活性的影响
2016-01-27李文强吴菲菲李化强赵良忠卜宇芳彭玲慧尹锦辉
李文强,吴菲菲,2,3,李化强,2,3,赵良忠,卜宇芳,徐 纬,彭玲慧,尹锦辉
(1.邵阳学院 生物与化学工程系,湖南 邵阳 422000;
2.大连理工大学 生命科学与生物技术学院,教育部动物性食品安全保障技术工程研究中心,
辽宁 大连 116024;
3.大连赛姆生物工程技术有限公司博士后工作站,辽宁 大连 116620)
金属离子对尖孢镰刀菌发酵液中果胶酶活性的影响
李文强1,吴菲菲1,2,3,李化强1,2,3,赵良忠1,卜宇芳1,徐纬1,彭玲慧1,尹锦辉1
(1.邵阳学院 生物与化学工程系,湖南 邵阳 422000;
2.大连理工大学 生命科学与生物技术学院,教育部动物性食品安全保障技术工程研究中心,
辽宁 大连 116024;
3.大连赛姆生物工程技术有限公司博士后工作站,辽宁 大连 116620)
摘要:采用发酵产酶法脱脐橙囊衣过程中,为提高酶活在培养基中添加不同金属离子,接种尖孢镰刀菌经摇瓶发酵后,测定发酵液中果胶酶系三个组分酶(聚半乳糖醛酸酶PG、果胶酸裂解酶PL、果胶酯酶PE)酶活性,探讨不同金属离子种类、添加量对果胶酶活性的影响.实验结果表明:浓度为0.06% Mg2+、0.04% Fe2+提高PG酶活力达205.62 U/mL、297.33 U/mL,分别比对照组提高1.07倍、1.45倍;Fe2+浓度为0.08%时,PL酶活力达到283.31 U/mL,是对照组的2.83倍,Fe2+对PL酶活力起促进作用;Fe2+、Zn2+对PE酶活力的影响有显著的促进作用,浓度为0.06%时达到最大值255.67 U/mL、200.68 U/mL,是对照组的2.40倍和1.66倍.本实验结果对优化橙汁胞生产工艺,实现安全高效低成本去除柑橘囊衣提供参考。
关键词:果胶酶;金属离子;尖孢镰刀菌;聚半乳糖醛酸酶(PG);果胶裂解酶(PL);果胶酯酶(PE)
Effect of Metal Ions on Pectic Enzyme Activity in
果胶是植物中的多糖物质,主要由D-半乳糖醛酸以α-1,4糖苷键相连形成的直链和中性糖(鼠李糖、阿拉伯糖、半乳糖和木糖)形成的侧链所组成的分子量在5万-30万之间的高分子化合物[1-2].由于果胶的结构特性,在水溶液中形成凝胶,因此在工业化生产中常采用酸碱法降解果胶物质去除柑橘囊衣,这样处理虽可达到生产要求,但易造成资源浪费和环境污染,因此必须要找到实现清洁加工新的方法和途径以解决柑橘囊衣果胶难以降解的问题。
果胶酶是能降解果胶物质的复合酶类,主要包括果胶酯酶(Petinesterase,PE)、聚半乳糖醛酸酶(Polygalactuonatelyase,PG)和果胶裂解酶(Polymethylgalacturonatlyase,PL)[3].果胶酶的来源比较广泛,部分酶组分晶体结构也已查明[4-8],自然界植物中存在天然果胶酶,但由于产量少,提取困难,现阶段的果胶酶主要依靠微生物发酵所得.现已发现40多种微生物能产果胶酶,包括曲霉属、青霉属、镰孢属等[9-11].微生物发酵具有产量大、成本低、效率高等特点,符合工业化生产要求[12]。
果胶酶在食品以及果蔬汁加工等领域应用十分广泛[13-14],随着我国果蔬汁加工和果酒酿造的迅猛发展,生产加工对果胶酶的需求量与日俱增,国内生产果胶酶还存在一定缺陷,在一定程度上限制了果胶酶的广泛应用[15].金属离子是酶催化因子和活性中心,因此本研究在培养基中添加了不同浓度的金属离子(Mg2+、Ca2+、Fe2+、Zn2+),经过摇瓶发酵,以期提高发酵液中果胶酶酶活力.本文初步研究金属离子对尖孢镰刀菌发酵液中果胶酶活性的影响,为将其应用于柑橘脱囊衣提供理论依据,以期为果胶酶工业化生产提供助力。
1材料和方法
1.1 菌种和试剂
本实验室从柑橘园中取样,筛选菌种得菌株的ITS-rDNA序列(登录号:KF857541)经同源性比对鉴定此菌种为尖孢镰刀菌(Fusariumoxysporum)。
主要试剂:柠檬酸-柠檬酸钠缓冲溶液、3,5二硝基水杨酸试剂(DNS)、果胶粉、半乳糖醛酸标准液、NaOH溶液、Fe2SO4、CaCl2、MgSO4、ZnSO4
1.2 培养基
基础发酵培养基:0.2% 硫酸铵、0.5% 果胶粉、0.1%氯化钠、0.1% 磷酸氢二钾、0.1% 磷酸二氢钾。
发酵培养基:在基础发酵培养基上改变金属离子添加量,其余组分不变.灭菌条件121 ℃、20 min。
1.3 仪器设备
超净工作台(苏州净化SW-CJ-1D)、电热恒温培养箱(HPX-9272 MBE)、恒温水浴槽(SY-1210)、恒温震荡培养箱(IS-RDD3)、离心机(VELOCITY 18R)、紫外-可见分光光度计(UV-4802H)、pH计、电子分析天平(梅特勒-托利多仪器有限公司,EL204)、数码显微镜(麦克奥迪实业集团有限公司BA310Digital)
1.4 实验方法
甘油冻存的尖孢镰刀菌经过倒平板活化三代后,取5 mL无菌水洗脱孢子液,接种于发酵培养基中,固定孢子的接种量为1.0×107个/500 mL,经30℃、160 r/min摇床培养发酵72 h后,置于转速为4000 r/min、4℃冷冻离心10 min,取上清液为粗酶液,放置4 ℃冰箱冷藏备用,在基础培养基中分别添加不同浓度的金属离子,按照实验方法进行操作,比较不同金属离子、不同添加量对PG、PL、PE酶活力的影响.实验每组设定3个平行样进行测量。
1.5 分析方法[16]
1.5.1 聚半乳糖醛酸酶的测定
酶活力单位:每分钟产生1μg还原糖定义为一个酶活单位。
1.5.2 果胶裂解酶的测定
酶活力单位:每分钟分解果胶,使235 nm处消光值增加1.0的酶量定义为1单位果胶裂解酶酶活。
1.5.3 果胶酯酶的测定
取4.0 mL 1%果胶溶液,45 ℃水浴平衡5 min,加入1.0 mL待测酶液,45 ℃保温60 min.用0.02 mol/L NaOH滴定产生的羧基基团.酶活力单位:每分钟释放出1 μmol羧酸的酶量定义为1单位果胶酯酶酶活。
1.6 数据处理
DPS数据处理系统,采用Duncan新复极差法进行多重比较分析。
2结果与分析
2.1 金属离子添加量对PG活性的影响

金属离子添加量图1 不同浓度金属离子对PG酶活力的影响Fig.1 The effect of different metal ions concertration on PG enzyme activity
注:对照组为发酵基础培养基的发酵液
从图1可以看出Mg2+和Fe2+对PG酶活力具有促进作用,Zn2+的影响较小,Ca2+具有明显抑制作用,且随着钙离子浓度的升高抑制作用而增强.在亚铁离子浓度为0.06%时,PG酶活力达到高峰,为297.33 U/mL,与对照样对比,酶活力提高1.45倍,随着亚铁离子浓度的增大,酶活力呈下降趋势.初步方差分析得出不同离子浓度对酶活力的影响存在显著差异,利用Duncan新复极差法多重比较分析各金属离子在不同浓度下对酶活性的影响,如表1所示。

表1 不同浓度金属离子对PG活性的影响
注:表中数据以平均数±标准差表示,同列数据字母相同、相邻和相间分别表示差异不显著(P>0.05),显著(P<0.05)和极显著(P<0.01)。
由表1可以看出,不同浓度的Fe2+对酶活力的影响差异显著,与对照组相比不同浓度的Mg2+、Ca2+、Fe2+离子对酶活力影响均存在极显著差异,若不考虑离子添加量,将不同种类金属离子对酶活影响进行多重比较则可得出Mg2+、Ca2+、Fe2+三组不同金属离子对酶活力的影响存在极显著差异,锌离子对PG酶活力差异不显著。
2.2 金属离子添加量对PL活性的影响
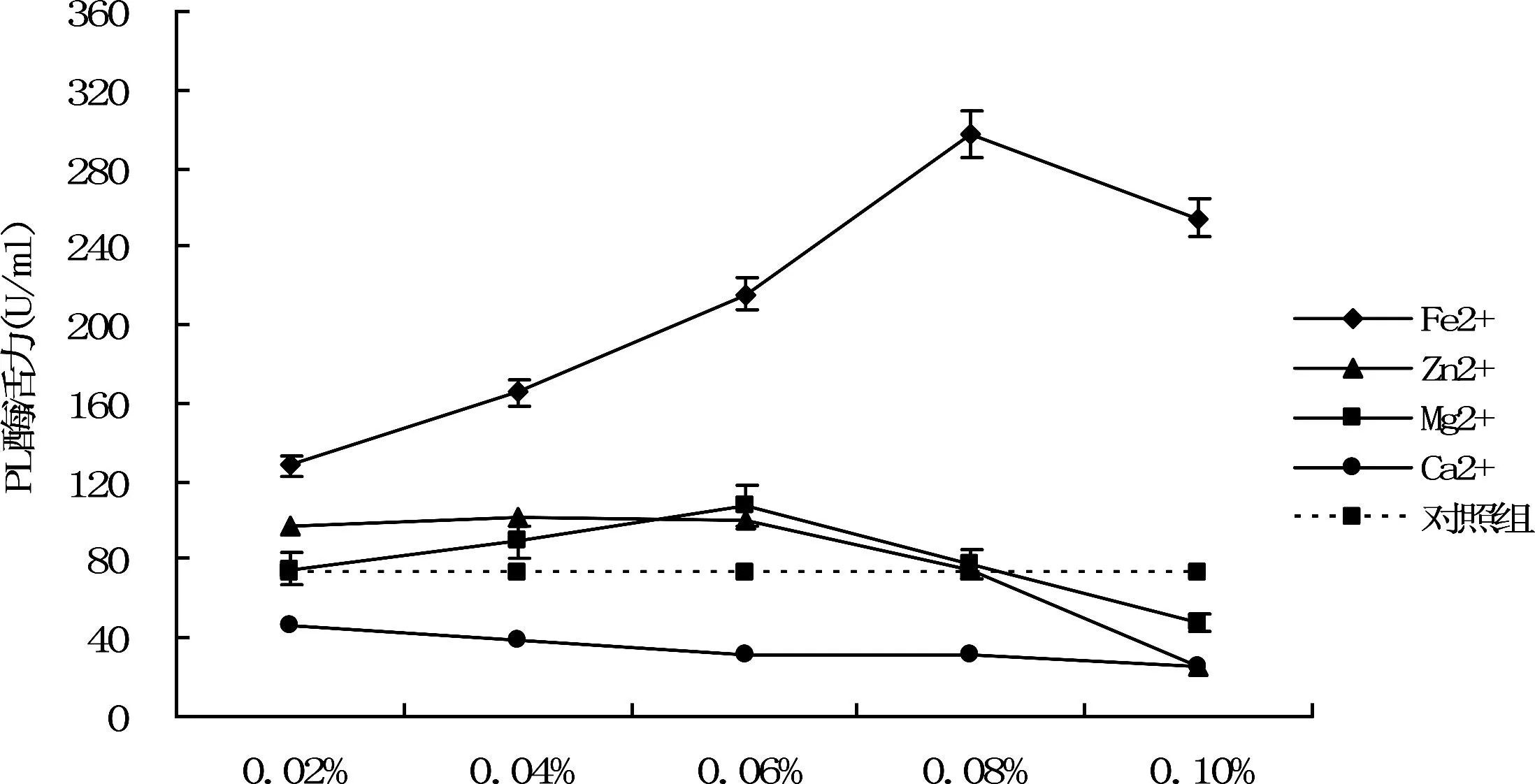
金属离子添加量图2 不同浓度金属离子对PL酶活力的影响Fig.2 The effect of different metal ions concertration on PL enzyme activity
从图2可以看出Fe2+对PL酶活力具有促进作用,在离子浓度为0.08%时,酶活力达到最高283.31 U/mL,与对照组相比酶活提高2.83倍.Mg2+和Zn2+对PL酶活力的影响较小,两种离子在0.08%的浓度以下,对酶活具有一定的促进作用,但高于此浓度时,对酶活力有抑制作用.Ca2+具有明显抑制作用,且随着离子浓度的升高抑制缓慢作用增强.初步方差分析得出不同离子浓度对酶活力的影响存在显著差异,利用Duncan新复极差法多重比较分析各金属离子、不同浓度对酶活性的影响,如表2所示。
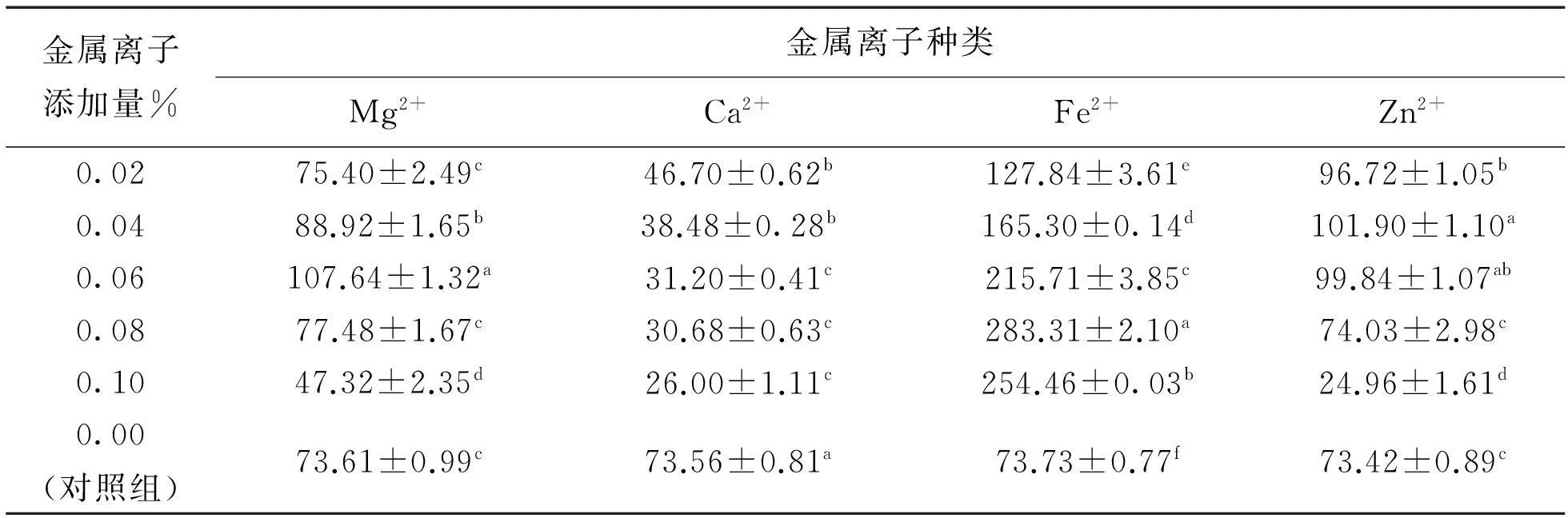
表2 不同浓度金属离子对PL活性的影响
注:表中数据以平均数±标准差表示,同列数据字母相同、相邻和相间分别表示差异不显著(P>0.05),显著(P<0.05)和极显著(P<0.01)。
由表2多重比较分析可以看出,不同浓度的Fe2+对酶活力的影响差异显著,与对照组相比,不同离子浓度的Ca2+、Fe2+离子对PL酶活力影响均存在极显著差异,若不考虑离子添加量,将不同种类金属离子对酶活影响进行多重比较则可得出Fe2+对酶活力的影响与对照组相比存在极显著差异,其他金属离子不存在显著差异。
2.3 金属离子添加量对PE活性的影响
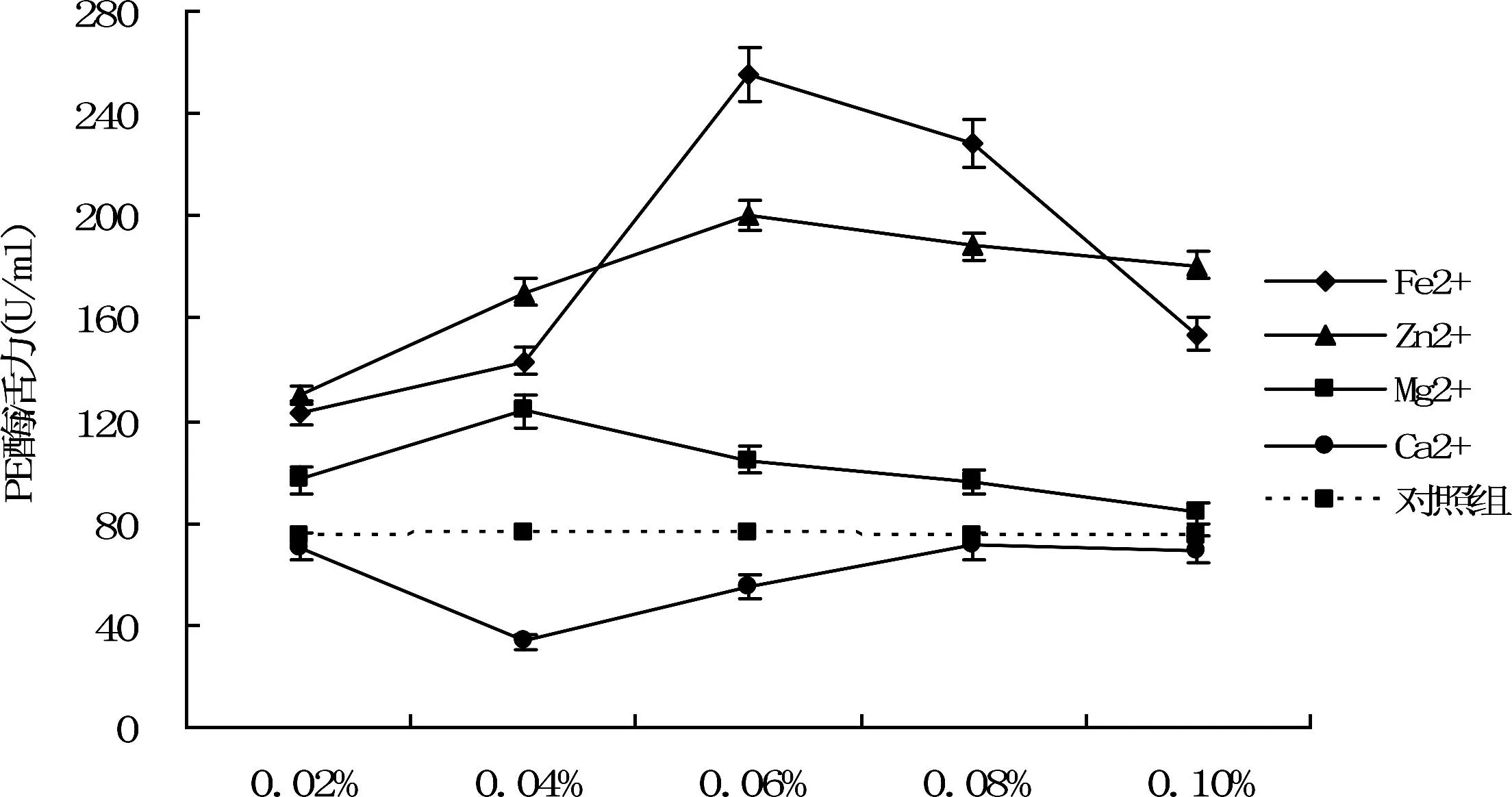
金属离子添加量图3 不同浓度金属离子对PE酶活力的影响Fig.3 The effect of different metal ions concetration on PE enzyme activity
从图3可以看出Fe2+、Mg2+、Zn2+三种离子对PE酶活力具有促进作用.在Fe2+浓度为0.06%时,酶活力达到最高255.67 U/ml,酶活提高2.40倍,随着Fe2+的浓度增大,酶活力下降.在该浓度下的Zn2+,酶活力也达到最高值200.68 U/m,提高1.66倍,Mg2+对酶活有促进作用,在0.04%浓度时达到最大值,相比对照组提高0.38倍.Ca2+对PE酶活力具有明显抑制作用,在Ca2+浓度为0.04%时抑制作用最强,随着浓度的增大与对照组酶活力相比差异减小.初步方差分析得出不同离子浓度对酶活力的影响存在显著差异,利用Duncan新复极差法多重比较分析不同浓度金属离子对酶活性的影响如表3所示。
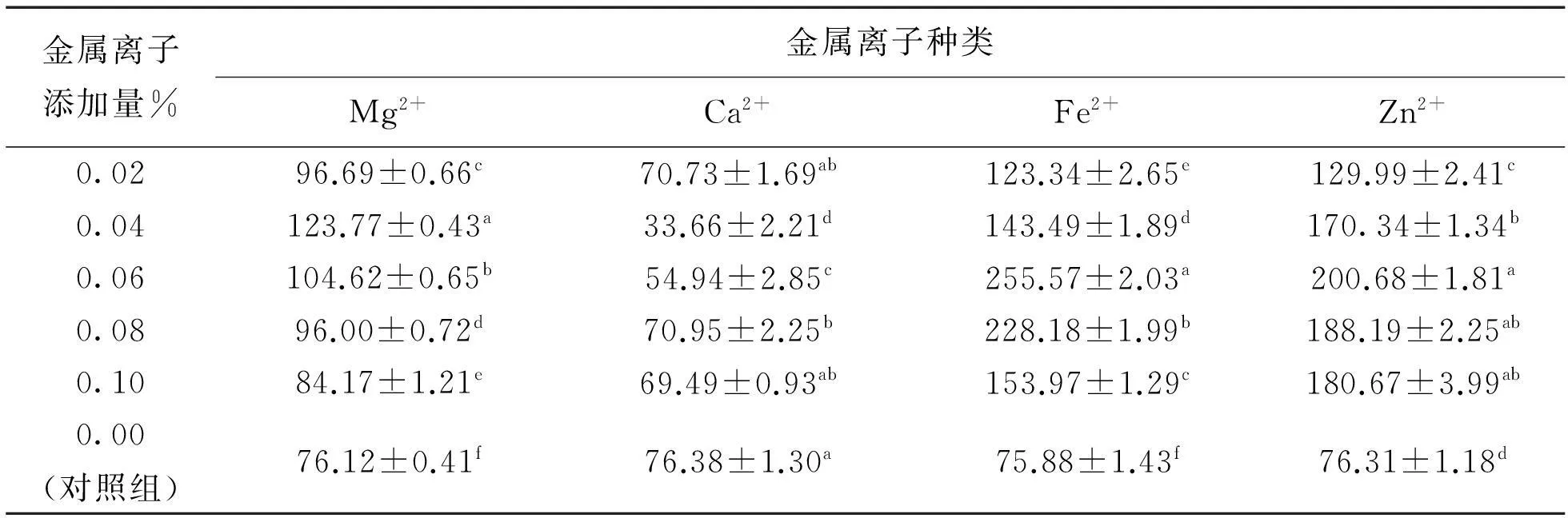
表3 不同浓度金属离子对PE活性的影响
注:表中数据以平均数±标准差表示,同列数据字母相同、相邻和相间分别表示差异不显著(P>0.05),显著(P<0.05)和极显著(P<0.01)。
由表3可以看出,不同浓度的Fe2+对酶活力的影响差异显著,与对照组相比不同离子浓度的Mg2+、Fe2+、Zn2+离子对PL酶活力影响均存在极显著差异,Ca2+添加量在0.04%时,对PL酶活力影响差异显著,若不考虑离子添加量,将不同种类金属离子对酶活性影响进行多重比较,则可得出Fe2+、Zn2+对酶活力的影响不存在显著差异,与对照组和其他金属离子相比存在极显著差异。
3结论与讨论
不同浓度的金属离子(Mg2+、Ca2+、Fe2+、Zn2+)对尖孢镰刀菌发酵液中果胶酶活性的影响差异显著.对于PG酶活力作用而言,Fe2+>Mg2+>Zn2+>Ca2+,0.04% Fe2+,酶活力达到最高,相比对照组提高1.45倍,0.06% Mg2+酶活力达到最高值205.62 U/mL,两者随着离子浓度的进一步增加酶活力出现下降趋势.Zn2+的添加对PG酶活力的影响较小,酶活力的大小与对照组无显著差异,而添加Ca2+则对PG酶活力具有抑制作用。
对于PL酶活力作用而言,与对照组相比,Fe2+对酶活力的影响有显著的促进作用,在0.08%浓度时达到最大值283.31 U/mL,Zn2+和Mg2+对酶活力的影响无明显差异,随着Mg2+浓度的增大至0.06%,PL酶活力升高,但离子浓度进一步增大,酶活力呈下降趋势,当离子浓度达到0.1%时,对酶活力存在显著的抑制作用.Ca2+对酶活力存在抑制作用,且随着离子浓度的增大,对酶活性的抑制缓慢增加。
对于PE酶活力而言,Fe2+浓度在0.04%时的酶活力为143.49 U/mL,在0.06%时快速上升至255.57 U/mL,Fe2+在此浓度区间对PE酶活力的影响差异极显著,Zn2+、Mg2+在最大值处分别提高2.4倍、0.63倍两者在达到最大值后,随着离子浓度的增大,酶活力呈下降趋势,Ca2+对酶活力存在抑制作用,在Ca2+浓度为0.04%时,与对照组对比,酶活力降低55.93%,随着离子浓度的增大,酶活力的大小与对照组间的差异呈逐渐减小趋势。
在培养基中添加促进三种酶活力的金属离子,提高酶活力,为实现果蔬清洁加工,利用果胶酶法快速降解柑橘囊衣,达到工业化要求水平提供参考.四种离子都是常见的非重金属离子,经过研究发现,Fe2+离子对酶活力有促进作用,且随着发酵液在使用时以及工艺流程过程中的稀释,符合图标对Fe2+离子规定要求.本文初步研究金属离子对酶活力的影响,还有几个问题值得后续的深入探究,第一:寻找更优的提高尖孢镰刀菌发酵液中果胶酶活力的活化因子;第二:探究果胶酶活力与柑橘囊衣降解效果间的关系,由于三种果胶酶作用方式各不相同,三种酶组分含量以及酶活力高低之间是否存在一定的关系,或者三种酶需要达到某种配比时,能快速的降解柑橘囊衣,达到工业化的要求;第三:探究柑橘囊衣的具体成分,清楚了解囊衣的内部结构,从而有针对性的找到降解囊衣的最佳方法,并结合生物酶的作用方式实现脐橙汁胞高效、安全、低成本的清洁加工。
参考文献:
[1]杨欣伟.黑曲霉EIM-6果胶裂解酶基因的克隆与表达[D].福州:福建师范大学,2009:2-5。
[2]Mohnen D.Pectin structure and biosynthesis[J].Current Opinion in Plant Biology,2008,11(3):266-277。
[3]潘霞.真菌果胶酶性质分析及分子改良[D].北京:中国农业科学院,2014。
[4]Bonivento D,Pontiggia D,Matteo AD,et al.Crystal structure of the endopolygalacturonase from the phytopathogenic fungus Colletotrichum lupini and its interaction with polygalacturonase‐inhibiting proteins[J].Proteins:Structure,Function,and Bioinformatics,2008,70(1):294-299。
[5]Pickersgill R,Smith D,Worboys K,et al.Crystal structure of polygalacturonase from Erwinia carotovora ssp.Carotovora[J].Journal of Biological Chemistry,1998,273(38):24660-24664。
[6]Cho SW,Lee S,Shin W.The X-ray structure of Aspergillus aculeatus polygalacturonase and a modeled structure of the polygalacturonase-octagalacturonate complex[J].Journal of Molecular Biology,2001,311(4):863-878。
[7]Fries M,Ihrig J,Brocklehurst K,et al.Molecular basis of the activity of the phytopathogen pectin methylesterase[J].The EMBO journal,2007,26(17):3879-3887。
[8]Mayans O,Scott M,Connerton I,et al.Two crystal structures of pectin lyase A from Aspergillus reveal a pH driven conformational change and striking divergence in the substrate-binding clefts of pectin and pectate lyases[J].Structure,1997,5(5):677-689。
[9]蒋红菊,杨加志,宋加妹,等.高产果胶酶菌株选育及发酵产酶条件优化的研究进展[J].中国酿造,2010,29(11):1-5。
[10]Doreen H,Sirma Y,Canan T,et al.Pectinase enzyme-complex production by Aspergillus spp.In solid-state fermentation: A comparative study[J].Food and Bioproducts Processing,2012,90(2):102-110。
[11]Rosane Schwan.Wheals.Endopolygalacturonase secretion by Kluyveromyces marxi-anus and other cocoa pulp-degrading yeasts[J].Enzyme and Microbial Technology,1997,21(4):234-244。
[12]殷志鹏.果胶酶产生菌HMDY-2诱变育种[D].哈尔滨:黑龙江大学,2008.
[13]Ahlawat S,Dhiman S;Battan B,et al.Pectinase production by Bacillus subtilis and its potential application in biopreparat ion of cotton and micropoly fabric[J].Process Bio-chemistry,2009,44(1):521-526.
[14]赵红岩. 果胶酶在果蔬汁加工中的应用研究[J].中国酿造,2012 ,31(12):18-19.
[15]郭育齐,赵良忠,尹乐斌,等.微生物果胶酶研究及其在食品加工中的应用进展[J].邵阳学院学报(自然科学版),2013,10(02):68-73。
[16]张浩森.果胶酶高产菌种的筛选及其酶学性质的研究[D].无锡:江南大学,2008.
Fusarium Oxysporum Fermentation
LI Wen-qiang,WU Fei-fei,LI Hua-qiang,ZHAO Liang-zhong,BU Yu-fang,
XU Wei,PENG Ling-hui,YIN Jing-hui
(1.DepartmentofBiologyandChemicalEngineering,ShaoyangUniversity,Shaoyang,Hunan422000,China;
2.CollegeofLifeScienceandBiotechnology,DalianUniversityofTechnology;TheMinistryofEducationCenter
forFoodSafetyofAnimalorigin,DalianUniversityofTechnologyDalian,Liaoning116024,China;
3.DalianSEMBio-EngineeringTechndogyCompanyPostdoctoralResearchCenter,Dalian,Liaoning116620,China)
Abstract:Through adding different metal ions in the culture medium,inoculated fusarium oxysporum after shaking flask fermentation,determination of pectinase are three components in fermented liquid enzyme (Polygalactuonatelyase PG,Polygalactuonatelyase PL,Petinesterase PE)enzyme activity,discuss different types of metal ions,adding amount on the influence of the pectic enzyme activity.The experimental results show that 0.06% Mg2+,0.04% Fe2+raise PG enzyme activity of 205.62U/mL,297.33U/mL,1.07 times,1.45 times higher than that of control group,respectively.When Fe2+concentration was 0.08%,PL enzyme activity reached 283.31U/mL,2.83 times of the control group,indicating Fe2+plays a role of promoting PL enzyme activity.Fe2+,Zn2+have a significant role in promoting PE enzyme activity,the influence of the concentration of 0.06% when the maximum 255.67U/mL,200.68U/mL,2.40 times and 1.66 times of the control group.The experimental results of metal ions enhance the vitality of pectinase different components has the reference value,in order to improve the enzyme activity to make it more efficient,fast,the degradation of citrus sacs,realize industrialization of fruit and vegetable cleaning and processing and production to provide the reference。
Key words:pectic enzyme;metal ions;fusarium oxysporum;polygalactuonatelyase;polymethylgalacturonatlyase;petinesterase
通讯作者:李化强(1984—),男,博士,硕士生导师,研究方向:食品安全,E-mail:huaqiangli.dalian@gmail.com
作者简介:李文强(1989—),男,湖南湘潭人,邵阳学院2013级硕士研究生,研究方向:果蔬清洁加工.
基金项目:湖南省科技厅项目(2014FJ4253);湖南省教育厅项目(14C1022)
收稿日期:2015-02-01
中图分类号:TS201.3
文献标志码:A
文章编号:1672-7010(2015)04-0050-07
