皮肤CD30+淋巴增殖性疾病的发病机制研究进展
2016-01-23谷晓广张春雷
谷晓广,张春雷
皮肤CD30+淋巴增殖性疾病的发病机制研究进展
谷晓广,张春雷

谷晓广
[摘要]皮肤CD30+淋巴增殖性疾病是仅次于蕈样肉芽肿的第二大类最常见的皮肤T细胞淋巴瘤,其发病率占原发性皮肤T细胞淋巴瘤的25%左右。该病是一种病谱性的疾病,临床上包括淋巴瘤样丘疹病和原发性皮肤间变性大细胞淋巴瘤以及其中的中间类型。近年来对皮肤CD30+淋巴增殖性疾病组织病理类型的细化、发病的病因学、淋巴细胞凋亡异常以及基
因异常的研究,为揭示皮肤CD30+淋巴增殖性疾病发病以及治疗提供了一些新的观点。
[关键词]皮肤CD30+淋巴增殖性疾病;淋巴瘤样丘疹病;原发性皮肤间变性大细胞淋巴瘤;凋亡
作者单位:100191,北京大学第三医院皮肤科(谷晓广,张春雷)
E-mail: guxiaoguangdr@126.com
[J Pract Dermatol, 2015, 8(3):208-211]
皮肤CD30+淋巴增殖性疾病 (CD30+CLPD)是第二大类最常见的皮肤T细胞淋巴瘤,其发病率占原发性皮肤T细胞淋巴瘤的25%左右。该病是一种病谱性的疾病,临床上包括淋巴瘤样丘疹病(lymphomatoid papulosis,LyP)和原发性皮肤间变性大细胞淋巴瘤(PCALCL)以及其中的中间类型。LyP的皮损大部分可以自行消退,一般不需系统治疗;但10%~20%的LyP患者反复迁延多年后,会出现持续增长的斑块和肿瘤,最后进展到原发性皮肤间变性大细胞淋巴瘤等侵袭性皮肤T细胞淋巴瘤。目前CD30+CLPD发生和发展的具体分子机制还不清楚,是近年来研究的热点,本文就CD30+CLPD发病机制的最新研究进展进行综述。
1 CD30+CLPD的临床表现和分类
CD30+CLPD的共同特点是表达CD30抗原,一种属于肿瘤坏死因子受体超家族的细胞因子受体。根据最新的世界卫生组织欧洲癌症研究组织(World Health Organization-European Organization for Research on Treament of Cancer,WHO-EORTC)分类,LyP丘疹病被认为是临床经过良性、但常常复发的惰性皮肤淋巴瘤[1],但也有研究显示20%的患者最终会发展成为恶性淋巴瘤[2]。根据最新的EORTC、国际皮肤淋巴瘤协会(International Society for Cutaneous Lymphomas,ISCL)、美国皮肤淋巴瘤联盟(United States Cutaneous Lymphoma Consortium,USCLC)达成的共识[3],LyP 的组织学类型被分为A,B,C、D 4类(表1)。其中A和C型真皮内有R-S细胞样的异形淋巴细胞。A型的特点为真皮内有大量的以组织细胞、中性粒细胞和嗜酸粒细胞组成的炎性细胞浸润,C型的特点为真皮内有大量的异形淋巴细胞浸润,伴有少量的炎性细胞。B型与经典的MF组织学表现类似,异形淋巴细胞的亲表皮性,以及真皮内小到中等的淋巴细胞浸润。D型为组织学表现为亲表皮性的小到中等的CD8+,CD30+的异形T细胞浸润[4]。上述A、B、C形中的异形淋巴细胞表达CD4+CD8-CD30+Th细胞表型,通常表达细胞毒性蛋白包括:颗粒酶B、细胞毒颗粒相关蛋白(TIA-1)、穿孔素。而CD7,CD15抗原通常缺失,个别患者CD56会出现阳性,但不能提示预后不良。最近还提出了一种E型LyP,即血管中心性淋巴瘤样丘疹病,此型临床表现为单发丘疹样皮损,其上迅速发生溃疡,并进一步发展为直径1~4 cm的坏死焦痂样损害。组织学表现为CD30+,通常CD8+的小到中等大小的异形淋巴细胞呈血管中心性或血管破坏性浸润。该皮损数周后会自发性消退,但复发比较常见,该型预后良好,需要与侵袭性血管中心性、血管破坏性细胞毒性T细胞淋巴瘤相鉴别[5]。原发性CD30+PCALCL的患者表现为孤立的或多发的红色或紫红色结节,结节表面有时会出现溃疡,约20%患者会出现身体的多发性损害。这些肿瘤结节有时也会像LyP皮损一样出现自发性消退,但大部分持续存在[1]。5%~10%患者会出现皮肤外转移,大部分为区域淋巴结转移。总的来说,PCALCL的临床预后很好,5年疾病特异性生存率(DDS)超过90%[6]。PCALCL的组织学表现为真皮内有大量的间变性、多形性或免疫母细胞性的异形淋巴细胞浸润,根据WHO-EORTC的分类标准,PCALCL中的大的淋巴细胞CD30+必须达到75%以上[1]。与LyP不同,PCALCL真皮内只有少量中性和嗜酸粒细胞浸润,但也有个别患者真皮内有大量的中性粒细胞浸润,呈现化脓性。还可以出现其他少见类型,如肉瘤样型和角化棘皮瘤型等[7]。PCALCL在临床表现、免疫表型和分子遗传等方面与系统性间变性大细胞淋巴瘤(ALCL)显著不同。与系统性ALCL相比,PCALCL因疾病的进展,皮肤外累及很少见,且一般不表达间变性淋巴瘤激酶(ALK),无t(2,5)基因异常。PCALCL的异形淋巴细胞表现为激活的CD4+Th细胞表型,伴随着不同程度的T细胞标志的丢失,50%细胞表达细胞毒蛋白:如颗粒酶B(granzyme B),细胞毒颗粒相关蛋白(TIA-1)和穿孔蛋白(perforin)等[8],CD25和HLA-DR也有表达。CD8+T-cell,CD4–CD8–双阴性,CD56和CD30共表达表型也有少量报道。
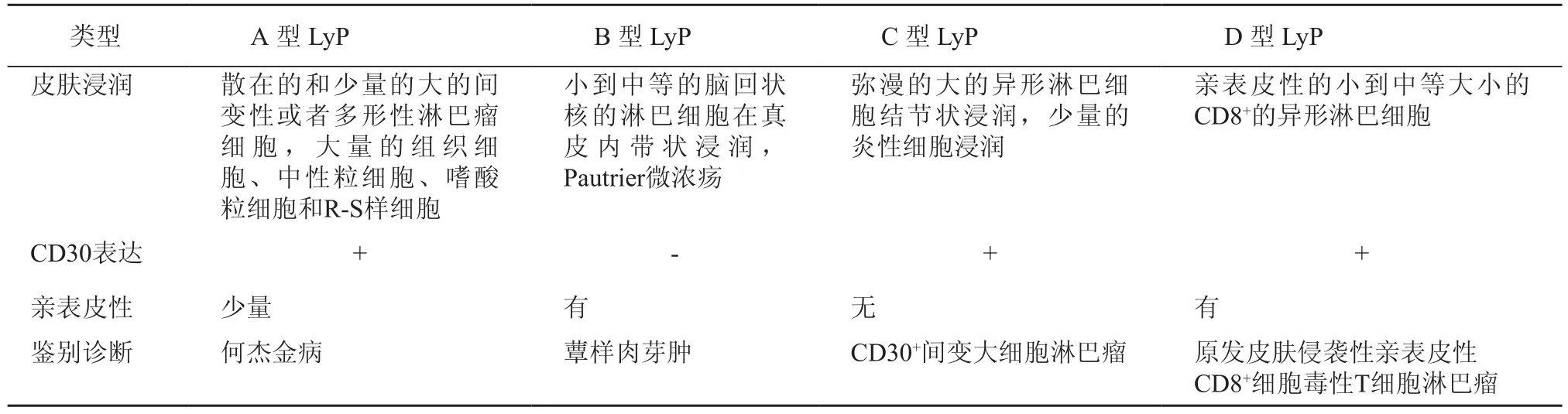
表1 淋巴瘤样丘疹病组织学分类诊断标准
2 CD30+CLPD的病因学研究进展
原发皮肤CD30+淋巴增殖性疾病的病因和发病机制还不清楚,但LyP和PCALCL中的异形淋巴细胞共同表达CD30,表明CD30在其疾病发生和发展中发挥重要的作用。研究显示一些病毒可以导致淋巴细胞CD30表达的上调,如:EB病毒(EBV)、人类疱疹病毒(HHV)、人类T淋巴细胞病毒1和2 (HTLV1/2)等,被认为是CD30+CLPD发生的原因。在一些LyP患者中,运用电镜技术在细胞核和细胞质中发现了病毒样颗粒,但进一步的相关研究到目前为止还没有阳性发现[9]。在一些经过免疫抑制治疗和免疫缺陷病毒感染的PCALCL和LyP患者中发现有EBV感染[10]。移植后免疫监视的降低和慢性抗原的刺激、免疫抑制药物的直接致癌作用、原癌基因的激活都被认为是CD30+淋巴增殖性疾病发病的可能机制,但是确切的病因学还不清楚。许多的研究表明,LyP和PCALCL的发病涉及到一系列的免疫和遗传学的异常。对LyP和PCALCL的病因和发病机制方面的研究将有助于开发针对性的新型治疗方法,特别是针对其发病机制的靶基因的生物治疗药物。
3 凋亡机制在CD30+CLPD发病过程中的作用
LyP的一个显著的临床特点是皮损的自发性消退,数周内单个皮损的自发性消退几乎见于所有的LyP患者,然而只有20%左右的PCALCL患者的肿瘤性结节经历自发性的消退。CD30+CLPD患者皮损自发性消退的机制尚不清楚,大量的研究认为凋亡通路在CD30+CLPD患者皮损自发性消退中发挥着重要的作用。Kikuchi等运用TUNEL技术检测了LyP、PCALCL、蕈样肉芽肿(MF)、皮肤B细胞淋巴瘤、皮肤假性淋巴瘤组织中细胞的凋亡指数,发现LyP与其他肿瘤相比,细胞的凋亡指数显著增高[11]。凋亡相关蛋白Bax普遍表达在CD30+CLPD组织的肿瘤细胞中和CD30+CLPD来源的细胞系中,但在临床经过呈侵袭性,肿瘤结节缺乏自发性消退的系统性ALCL中却表达缺失[12]。以上的研究均显示凋亡机制在CD30+CLPD患者发病中起到关键的作用,但其确切的分子通路尚不清楚。Mori等[13]研究结果显示,用免疫组化检测CD30+CLPD患者的进展期和自发性消退的皮损中CD30L,发现CD30L只表达在消退期的皮损中,进一步运用分子分析发现,CD30L在消退期皮损中的表达显著高于进展期的皮损。而又有研究显示,重组CD30L 对CD30+ALCL细胞系具有很强的抗增生作用[14]。因此CD30L和CD30的相互作用介导的细胞毒作用有可能参与了CD30+CLPD皮损的临床消退过程。Paulli等抗凋亡蛋白BCL-2在LyP皮损中的表达显著降低而在PCALCL皮损中却显著增高,而CD95/Fas在LyP和PCALCL皮损的表达均显著增加。表明BCL-2在肿瘤细胞的抗凋亡机制中发挥重要作用,而CD95/Fas的激活有可能参与了皮损的自发性消退[15]。Li等[16]利用全基因组表达分析系统发现,LyP患者在向PCALCL的进展中,与促进细胞增生和生存、药物抵抗相关的基因表现出显著的表达上调,而与细胞粘附、细胞凋亡、抑制细胞激活和细胞周期的基因却表现出明显的下调。
4 CD30+CLPD肿瘤细胞克隆的形成以及细胞遗传学的改变
检测克隆性增生的T细胞常常被用于CTCL 的诊断中。通过聚合酶链反应(PCR)检测TCR基因重排,可以在即使是很早期的CTCL中检测到克隆性扩增的T细胞[17]。LyP患者的肿瘤细胞是否具有克隆性一直存在争议,但现在已经取得共识,即依据TCR基因重排分析,并非所有LyP患者的肿瘤性T细胞都具有克隆性[18]。Weiss通过Southern blot的方法发现6例LyP患者有5例具有TCRβ和γ基因的克隆性重排。值得注意的是从同一患者的不同皮损获取的3份标本表现出不同的TCRβ基因重排。因此他们认为LyP是具有多克隆起源的克隆T细胞淋巴增生性疾病。最近单细胞PCR扩增TCRγ基因显示LyP患者皮损内的CD30+细胞是多克隆的,而单克隆T细胞来自皮损内的小的CD30-CD3+T细胞[19]。而几乎全部的CD30+PCALCL患者肿瘤细胞是克隆性的[19, 20],单个细胞PCR扩增TCRγ链基因显示克隆性T细胞来源于患者皮损内的CD30+异形淋巴细胞[20]。在LyP的消退期和LyP进展到PCALCL的患者中发现了染色体的不稳定性,但也有一部分LyP患者表现为染色体正常核型[21]。以上的研究表明LyP进展到PCALCL有可能经历了和结直肠肿瘤发生和发展相同的多重步骤如微卫星不稳定(MSI)、染色体不稳定以及TGF-β的突变等[22]。基因表达谱分析、蛋白组学以及功能学研究显示:遗传学的不稳定性导致了LyP基因表达的改变。通过全基因组表达分析系统,Reddy等研究发现在LyP进展到PCALCL的过程中与细胞增生和生存以及药物抵抗相关的基因出现5倍或更高的表达上调,而与细胞粘附、凋亡、细胞激活和细胞周期抑制子以及基因组完整性相关的基因出现了5倍或更高的表达下调[16]。蛋白组学研究显示参与信号转导、离子通道、凋亡、细胞粘附以及NF-kB和TGF-β信号通路相关的蛋白出现了1.5倍或更大的表达改变。而TGF-β信号通路在LyP 向PCALCL进展的过程中也出现了改变。研究表明,早期的LyP皮损内的恶性T细胞克隆仍然能够通过自分泌和旁分泌的形式对其自身的生长进展控制。但来源于进展期CD30+PCALCL的恶性T细胞克隆由于TGF-β的突变而导致了TGF-β介导的对其生长抑制作用消失,从而引起了细胞的生长加速[23]。而且由于TGF-β是强有力的免疫抑制因子,CD30+T细胞又可以通过分泌大量的TGF-β对周围环境产生抑制,从而有利于LyP皮损内CD30+T细胞逃逸周围环境对其的免疫抑制。
5 结语
近20年来,皮肤淋巴瘤领域的研究进展迅速,使人们对皮肤淋巴瘤的认识有了很大的提高,对皮肤淋巴瘤的分类有了初步的统一共识。其中由于CD30+CLPD组织病理学特征和表型特征之间具有重叠性,因此其最终的确诊需要综合临床、组织病理、表型特征以及分子基因诊断等。所以临床医师和皮肤病理医师或病理医师的密切合作对CD30+CLPD的诊断以及最后的治疗尤其重要。另外人们对皮肤淋巴瘤特别是CD30+CLPD的认识还非常局限,相信随着对其研究的深入,使我们对CD30+CLPD的认识和治疗都有一个较大的提高。
【参 考 文 献】
[1]Ralfkiaer E, Willemze R, Paulli M, et al. Primary cutaneous CD30-positive T-cell lymphoproliferative disorders [M]//Swerdlow SH, Campo E, Harris NL, et al. World Health Organization Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon, France: IARC Press, 2008:300-301.
[2]Newlove T, Loyd A, Patel R, et al. Primary cutaneous anaplastic large-cell lymphoma[J]. Dermatol Online J, 2010, 16(11):2.
[3]Kempf W, Pfaltz K, Vermeer MH, et al. EORTC, ISCL, and USCLC consensus recommendations for the treatment of primary cutaneous CD30-positive lymphoproliferative disorders: lymphomatoid papulosis and primary cutaneous anaplastic large-cell lymphoma [J]. Blood, 2011, 118(15): 4024-4035.
[4]沈小雁, 李可嘉, 施若非, 等. CD8+的淋巴瘤样丘疹病1例 [J]. 中国皮肤性病学杂志, 2010, 06): 553-555.
[5]Kempf W, Kazakov DV, Schärer L, et al. Angioinvasive lymphomatoid papulosis: a new variant simulating aggressive lymphomas [J]. Am J Surg Pathol, 2013, 37(1): 1-13.
[6]Woo DK, Jones CR, Vanoli-Storz MN, et al. Prognostic factors in primary cutaneous anaplastic large cell lymphoma: characterization of clinical subset with worse outcome [J]. Arch Dermatol, 2009, 145(6): 667-674.
[7]Kong YY, Dai B, Kong JC, et al. Cutaneous anaplastic large cell lymphoma: clinicopathologic, immunohistochemical and prognostic study of 44 cases [J]. Zhonghua Bing Li Xue Za Zhi, 2010, 39(4): 230-234.
[8]Kadin ME. Current management of primary cutaneous CD30+ T-cell lymphoproliferative disorders [J]. Oncology (Williston Park), 2009, 23(13): 1158-1164.
[9]Seckin D, Barete S, Euvrard S, et al. Primary cutaneous posttransplant lymphoproliferative disorders in solid organ transplant recipients: a multicenter European case series [J]. Am J Transplant, 2013, 13(8): 2146-2153.
[10]Ravat FE, Spittle MF, Russell-Jones R. Primary cutaneous T-cell lymphoma occurring after organ transplantation [J]. J Am Acad Dermatol, 2006, 54(4): 668-675.
[11]Kikuchi A, Nishikawa T. Apoptotic and proliferating cells in cutaneous lymphoproliferative diseases [J]. Arch Dermatol, 1997, 133(7):829-833.
[12]Li HL, Huang XP, Zhou XH, et al. Correlation of seven biological factors (Hsp90a, p53, MDM2, Bcl-2, Bax, Cytochrome C, and Cleaved caspase3) with clinical outcomes of ALK+ anaplastic largecell lymphoma [J]. Biomed Environ Sci, 2011, 24(6): 630-641.
[13]Mori M, Manuelli C, Pimpinelli N, et al. CD30-CD30 ligand interaction in primary cutaneous CD30(+) T-cell lymphomas: A clue to the pathophysiology of clinical regression [J]. Blood, 1999, 94(9): 3077-3083.
[14]Oflazoglu E, Grewal IS, Gerber H. Targeting CD30/CD30L in oncology and autoimmue and inflammatory diseases [J]. Adv Exp Med Biol, 2009, 647:174-185.
[15]Benner MF, Jansen PM, Meijer CJ, et al. Diagnostic and prognostic evaluation of phenotypic markers TRAF1, MUM1, BCL2 and CD15 in cutaneous CD30-positive lymphoproliferative disorders [J]. Br J Dermatol, 2009, 161(1): 121-127.
[16]Li S, Ross DT, Kadin ME, et al. Comparative genome-scale analysis of gene expression profiles in T cell lymphoma cells during malignant progression using a complementary DNA microarray [J]. Am J Pathol, 2001, 158(4): 1231-1237.
[17]Yang H, Xu C, Tang Y, et al. The significance of multiplex PCR/heteroduplex analysis-based TCR-gamma gene rearrangement combined with laser-capture microdissection in the diagnosis of early mycosis fungoides [J]. J Cutan Pathol, 2012, 39(3): 337-346.
[18]Akilov OE, Pillai RK, Grandinetti LM, et al. Clonal T-cell receptor β-chain gene rearrangements in differential diagnosis of lymphomatoid papulosis from skin metastasis of nodal anaplastic large-cell lymphoma [J]. Arch Dermatol, 2011, 147(8): 943-947.
[19]Gellrich S, Wernicke M, Wilks A, et al. The cell infiltrate in lymphomatoid papulosis comprises a mixture of polyclonal large atypical cells (CD30-positive) and smaller monoclonal T cells (CD30-negative) [J]. J Invest Dermatol, 2004, 122(3): 859-861.
[20]Gellrich S, Wilks A, Lukowsky A, et al. T cell receptor-gamma gene analysis of CD30+ large atypical individual cells in CD30+ large primary cutaneous T cell lymphomas [J]. J Invest Dermatol, 2003, 120(4): 670-675.
[21]Querfeld C, Khan I, Mahon B, et al. Primary cutaneous and systemic anaplastic large cell lymphoma: clinicopathologic aspects and therapeutic options [J]. Oncology (Williston Park), 2010, 24(7): 574-587.
[22]Duvic M. CD30+ neoplasms of the skin [J]. Curr Hematol Malig Rep, 2011, 6(4): 245-250.
[23]Droc C, Cualing HD, Kadin ME. Need for an improved molecular/genetic classification for CD30+ lymphomas involving the skin [J]. Cancer Control, 2007, 14(2): 124-132.
(本文编辑 敖俊红)
• 中医中药 •
Advances in the pathogenesis of cutaneous CD30+lymphoproliferative disorders
GU Xiao-guang,ZHANG Chun-lei
Department of Dermatology, Peking University Third Hospital, Beijing 100191, China
[Abstract]The spectrum of CD30+cutaneous lymphoproliferative disorders (CD30+CLPDs) includes lymphomatoid papulosis (LYP), primary cutaneous anaplastic large-cell lymphoma (PCALCL) and borderline cases that represent the second most common types of CTCL after mycosis fungoides (MF) and comprise approximately 25% of all CTCL. Recent years, refinement of histopathologic type, etiology research, abnormal lymphocyte apoptosis and abnormal gene expression provided new insights into the pathogenesis and therapy of CD30+CLPDs.
[Key words]CD30+cutaneous lymphoproliferative;Lymphomatoid papulosis;Primary cutaneous anaplastic large-cell lymphoma;Apoptosis
收稿日期(2014-08-19 修回日期 2014-10-31)
通讯作者:张春雷,E-mail: zhangchunleius@163.com
作者简介:谷晓广,医学博士,研究方向:皮肤T细胞淋巴瘤,
基金项目:国家自然科学基金面上项目(81372915);首都临床特色应用研究(Z131107002213028);国家自然科学基金青年项目(81402259);北京大学第三医院院临床重点项目(BYSY201209)
DOI:10.11786/sypfbxzz.1674-1293.20150315
[文章编号]1674-1293(2015)03-0208-04
[文献标识码]A
[中图分类号]R733.1
