厄贝沙坦氨氯地平片溶出度评价
2016-01-19李国琼,肖文礼,杨贵方等
厄贝沙坦氨氯地平片溶出度评价
李国琼1,肖文礼2,杨贵方2, 王俊2,刘启兵3*
(1.海南省药品审核认证管理中心,海口570216;2.海南中济医药科技有限公司,海口570208;3.海南医学院药学院,海口571199)
摘要:目的以国外原研的厄贝沙坦氨氯地平片为参比制剂,考察自研制剂与参比制剂在不同pH条件下溶出行为的相似性。方法依据2010 年版《中国药典( 二部)》和日本《医疗用药品品质情报集》中的溶出度实验条件,采用HPLC法,分别以盐酸溶液(pH=2.0)、醋酸盐缓冲液(pH=4.5)、磷酸盐缓冲液(pH=6.8)和水为溶出介质进行测定,溶出方法为桨法,转速为50 r·min`(-1),并通过f2相似因子法评价自制与参比厄贝沙坦氨氯地平片溶出曲线的相似性。结果3个批号自制片与原研片在不同溶出介质中溶出度相似因子均大于50%。结论自制片与参比片的溶出曲线相似,提示自制厄贝沙坦氨氯地平片处方合理,生产工艺稳定可靠。
关键词:厄贝沙坦;氨氯地平;溶出度;f2相似因子法
doi:10.3969/j.issn.1004-2407.2015.03.017
中图分类号:R944
文献标志码:A
文章编号:1004-2407(2015)03-0275-04
Abstract:ObjectiveTo investigate the similarity of dissolution behavior between the reference preparation tablets ( the listed abroad Irbesartan and Amlodipine Tablets, and the self-prepared(domestic) preparations in dissolution media with different pH. Methods The HPLC method was adopted to determine the dissolubility according to Chinese Pharmacopoeia (edition 2010) and referring to the dissolution test condition in Japan′s Medical Drugs Quality Informations Set. Water, hydrochloride acid(pH=2), acetate buffer(pH=4.5) and phosphate buffer (pH=6.8) were sepatately used as the dissolution media and the paddle method was adopted with the rotational speed of 50 r·min`(-1). The similarity of dissolution curve was evaluated by f2 similarity factor method. ResultsThe similarity factor of self-made tablets in different dissolution media to the imported tablets was above 50%.ConclusionThe dissolution curve of self-made and imported Irbesartan and Amlodipine Tablets is similar,which prompts that this test preparation has the rational prescription and the production technology is stable and reliable.
基金项目:海口市2013年科技计划项目(编号:HK2013-17)
作者简介:李国琼,女,主管药师
收稿日期:(2014-10-18)
Dissolution evaluation of Irbesartan and Amlodipine Tablets
LI Guoqiong1, XIAO Wenli2, YANG Guifang2, WANG Jun2, LIU Qibing3*(1. Center for Drug Evaluation and Certification of Hainan Province, Haikou 570216,China; 2. Hainan Zhongji Pharmaceutical Technology Limited Company, Haikou, 570208,China;3.Department of Pharmacy, Hainan Medical College, Haikou 571199,China)
Key words: irbesartan; amlodipine; dissolution;f2similarity factor
*通信作者:刘启兵,男,博士,副教授
厄贝沙坦和苯磺酸氨氯地平组成的复方片剂是由日本住友制药株式会社研发的,于2012年9月在日本上市[1]。其中,厄贝沙坦(irbesartan)为血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)受体抑制剂,能抑制AngⅠ转化为AngⅡ,特异性地拮抗血管紧张素转换酶1受体(AT1),对AT1的拮抗作用大于AT2 的8 500倍,通过选择性地阻断AngⅡ与AT1受体的结合,抑制血管收缩和醛固酮的释放,产生降压作用[2]。苯磺酸氨氯地平(amlodipine besylate)属于钙通道阻滞剂(CCB),其主要通过阻滞心肌和血管平滑肌细胞外的钙离子通道,发挥抗高血压及抗心绞痛作用[3],二者组成的复方制剂可协同降压,优势互补,能更好地平稳控制患者血压在正常范围[4-5]。
固体制剂的体外溶出度实验对评价其内在质量至关重要,其中不同溶出介质中溶出曲线的相似性研究已成为揭示不同制剂工艺差别和品质优劣的有效方法和手段[6-7]。溶出曲线相似性的评价方法有多种,自1999 年美国FDA 颁布采用f2因子比较法以来,该法己被普遍采用[8-9]。以国外上市的原研产品为参比制剂,参照日本“药品品质再评价工程”, 在溶出度研究中模拟人体消化道内体液的4 种基本介质,考察自研制剂与原研产品在不同介质中的溶出情况,采用f2因子法对溶出曲线的相似性进行评价,剖析自研制剂的内在质量。
1仪器与试药
1.1仪器LC-2010CHT高效液相色谱仪、LC Solution工作站(日本岛津公司);RC-6溶出度测试仪(天津市国铭医药设备有限公司)。
1.2试药厄贝沙坦氨氯地平片(日本住友株式会社,规格:100/5 mg,批号:1005C);厄贝沙坦氨氯地平片(自制,规格:100/5 mg,批号 121101);厄贝沙坦对照品(中国食品药品检定研究院,批号 100607-201202,HPLC法质量分数99.8%);苯磺酸氨氯地平对照品(中国食品药品检定研究院,批号 100374-200903,HPLC法质量分数99.4%);磷酸(广州化学试剂厂,分析纯,批号 20110301-1);三乙胺(广东光华科技股份有限公司,化学纯,批号 20120516);乙腈(TEDIA,色谱纯,批号 12115048)。
2方法与结果
2.1色谱条件色谱柱:Wondasil C18色谱柱(150 mm×4.6 mm,5 μm);流动相:磷酸缓冲液(取磷酸5.5 mL,置于950 mL水中,用三乙胺调节pH值至3.2,用水稀释至1 000 mL)-乙腈(50∶50);流速:1.0 mL·min-1;检测波长:237 nm;进样量:20 μL。
2.2溶出介质4种溶出介质分别为:盐酸溶液(pH=2.0)、醋酸盐缓冲液(pH=4.5)、磷酸盐缓冲液(pH=6.8)和水,溶出介质体积为1 000 mL。
2.3溶液制备
2.3.1对照品溶液制备取苯磺酸氨氯地平对照品约17 mg,精密称定,置于100 mL量瓶中,加甲醇5 mL使溶解,用溶出介质稀释至刻度,摇匀,作为氨氯地平对照品储备液;取厄贝沙坦对照品约50 mg,精密称定,置于50 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为厄贝沙坦对照品储备液。精密量取厄贝沙坦储备液5 mL,置于50 mL量瓶中,再精密加入氨氯地平储备液2 mL,用溶出介质稀释至刻度,摇匀,作为对照品溶液。
2.3.2供试品溶液制备在不同时间点,每次取样10 mL(同时补充相同体积、温度一致的溶出介质),经0.45 μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.4专属性实验分别取对照品溶液、空白辅料溶液和空白溶剂各20 μL注入液相色谱仪,记录色谱图,4种溶出介质同法测定。实验结果显示,在4种介质中,空白溶剂和空白辅料溶液在两个主成分峰处均无色谱峰,溶剂和辅料对测定无干扰。
2.5精密度实验照2.3项下的方法,分别用4种溶出介质制备对照品溶液,分别连续进样6次,记录色谱图,计算氨氯地平及厄贝沙坦主峰面积的RSD,结果见表1。实验结果表明,在4种介质中厄贝沙坦和氨氯地平主峰面积的RSD均小于2.0%,精密度良好。
表1厄贝沙坦氨氯地平片精密度实验
Tab.1 The measurement precision test of Irbesartan and Amlodipine Tablets
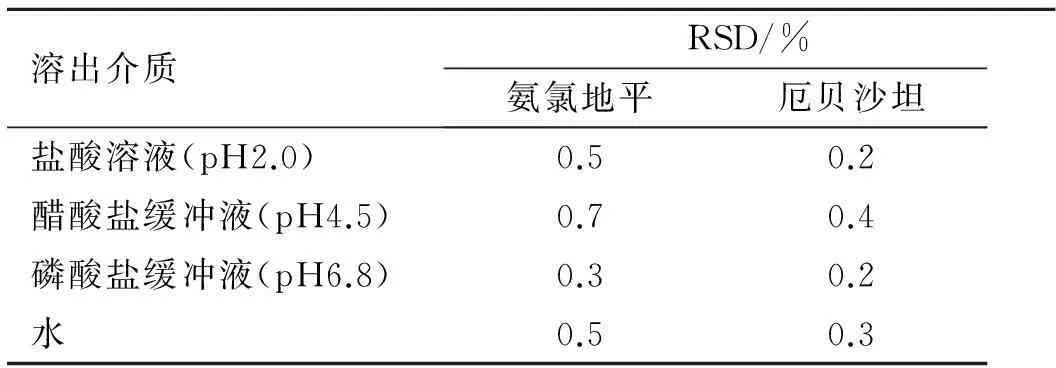
溶出介质RSD/%氨氯地平厄贝沙坦盐酸溶液(pH2.0)0.50.2醋酸盐缓冲液(pH4.5)0.70.4磷酸盐缓冲液(pH6.8)0.30.2水0.50.3
2.6滤膜吸附实验照2.3项下的方法,分别用4种溶出介质制备对照品溶液,分别直接进样和经0.45 μm微孔滤膜滤过后进样,计算滤膜的吸附量,结果见表2。实验结果表明,滤膜对氨氯地平和厄贝沙坦的吸附量均小于2.0%,滤膜吸附对溶出度测定的影响可以忽略不计。
表2厄贝沙坦氨氯地平片滤膜吸附实验
Tab.2 The filter membrane absorption test of Irbesartan and Amlodipine Tablets

溶出介质吸附量/%氨氯地平厄贝沙坦盐酸溶液(pH2.0)0.40.1醋酸盐缓冲液(pH4.5)0.60.2磷酸盐缓冲液(pH6.8)0.40.1水0.30.3
2.7线性关系考察照2.3项下的方法,分别制备氨氯地平对照品储备液和厄贝沙坦对照品储备液,精密量取氨氯地平对照品储备液1.0,2.5,4.0,5.0和6.0 mL,分别置于50 mL量瓶中,分别精密加入厄贝沙坦对照品储备液0.4,1.0,1.6,2.0和2.4 mL,用溶出介质稀释至刻度,摇匀,制成氨氯地平质量浓度(C1)分别为0.99,2.448,3.96,4.95和5.94 μg·mL-1及厄贝沙坦质量浓度(C2)分别为20.0,50.1,80.2,100.2和120.2 μg·mL-1的线性实验溶液。分别用4种溶出介质制备线性实验溶液,分别精密量取20 μL注入液相色谱仪,记录色谱图。以溶液质量浓度(X)为横坐标,以主峰面积(Y)为纵坐标进行线性回归,结果见表3。实验结果表明,氨氯地平在0.99~5.94 μg·mL-1、厄贝沙坦在20.0~120.2 μg·mL-1质量浓度范围内,溶液质量浓度与主峰面积线性关系良好。
表3厄贝沙坦氨氯地平片线性回归方程
Tab.3 The linear regression equations of Irbesartan and Amlodipine Tablets

溶出介质回归方程r盐酸溶液(pH2.0)Y=75464X+9211.30.9995Y=55051X+1666.40.9996醋酸盐缓冲液(pH4.5)Y=79222X-3358.30.9994Y=58128X-104220.9996磷酸盐缓冲液(pH6.8)Y=74773X+5540.50.9998Y=57985X-101160.9998水Y=79178X+5005.60.9992Y=54094X+106220.9997
2.8回收率实验照2.3项下的方法,分别制备氨氯地平对照品储备液和厄贝沙坦对照品储备液,精密量取氨氯地平对照品储备液1.0,1.6和2.0 mL,分别置于50 mL量瓶中,分别精密加入厄贝沙坦对照品储备液2.0,4.0 和5.0 mL,按处方比例加入空白辅料,用溶出介质稀释至刻度,摇匀,滤过,取续滤液作为回收率实验50%,80%和100%浓度的溶液,各浓度平行配制3份。分别精密量取20 μL注入液相色谱仪,记录色谱图。4种介质同法进行测定,将测得的峰面积代入线性方程计算氨氯地平和厄贝沙坦的实测质量浓度,以实测质量浓度/理论质量浓度计算回收率,结果见表4。实验结果表明,4种介质中各浓度水平下氨氯地平和厄贝沙坦回收率的平均值均在98%~102%范围内,RSD均小于2.0%,该测定方法准确度良好。
表4厄贝沙坦氨氯地平片回收率实验
Tab.4 The recovery test of Irbesartan and Amlodipine Tablets
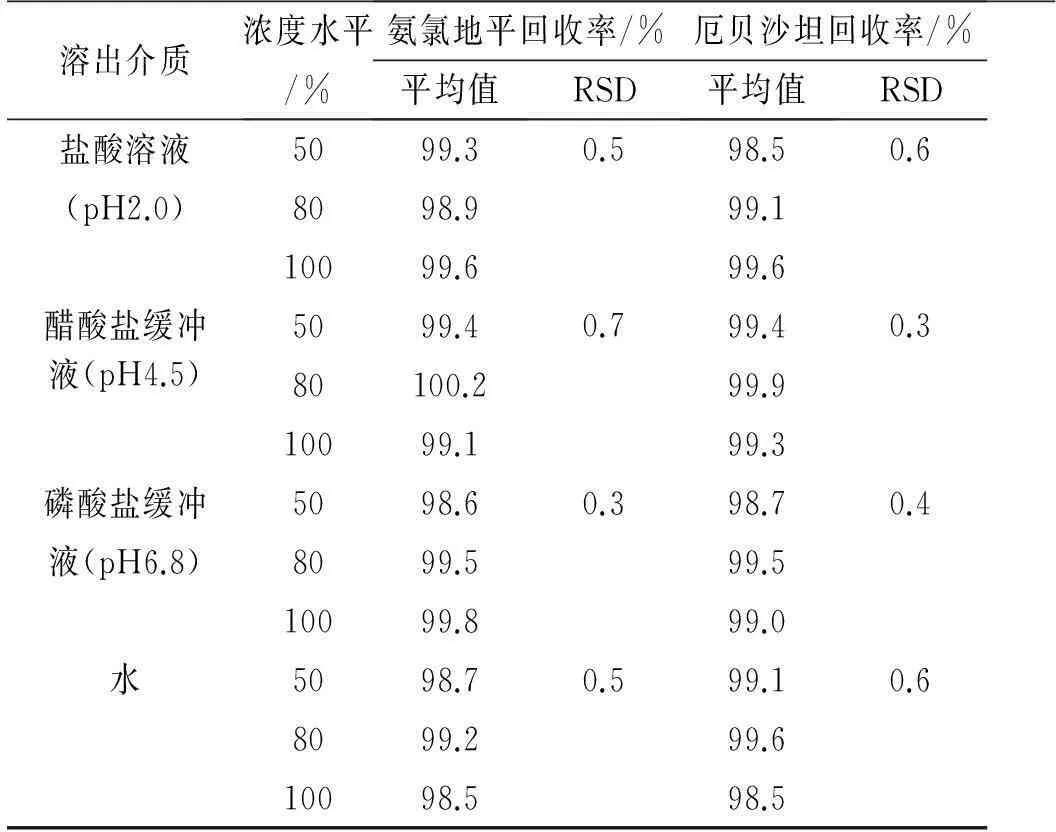
溶出介质浓度水平/%氨氯地平回收率/%厄贝沙坦回收率/%平均值RSD平均值RSD盐酸溶液(pH2.0)醋酸盐缓冲5099.38098.910099.65099.40.50.798.599.199.699.40.60.3液(pH4.5)磷酸盐缓冲液(pH6.8)水80100.210099.15098.60.399.999.398.70.48099.510099.899.599.05098.78099.210098.50.599.199.698.50.6
2.9溶液稳定性实验取不同溶出介质的供试品溶液,于室温下放置,分别于第0,2,4,6和8 h精密量取20 μL注入液相色谱仪,记录色谱图。计算氨氯地平和厄贝沙坦主峰面积的RSD,结果见表5。实验结果显示,在4种介质中氨氯地平和厄贝沙坦主峰面积的RSD均小于2.0%,供试品溶液室温下8 h内稳定。
表5厄贝沙坦氨氯地平片溶液稳定性实验
Tab.5 The solution stability test of Irbesartan and Amlodipine Tablets

溶出介质RSD/%氨氯地平厄贝沙坦盐酸溶液(pH2.0)0.30.9醋酸盐缓冲液(pH4.5)0.50.5磷酸盐缓冲液(pH6.8)0.80.6水1.00.7
2.10溶出曲线测定照《中国药典( 二部)》附录XC第二法,分别以pH 2.0盐酸溶液、pH4.5醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水1 000 mL为溶出介质,转速为50 r·min-1,分别于第5,10,15,30,45,60,90,120,180,240和360 min时取溶液10 mL(当连续2个时间点溶出量达90%,且差值小于5%,可提前结束实验;取样后补充相同体积:温度一致的溶出介质),滤过,取续滤液作为供试品溶液,分别精密量取20 μL注入液相色谱仪,记录色谱图。另照2.3项下的方法制备对照品溶液,同法测定,记录色谱图。按外标法以峰面积分别计算每片中氨氯地平和厄贝沙坦在各时间点的溶出度并计算累积溶出量。自制制剂与参比制剂在4种介质中的溶出曲线见图1。
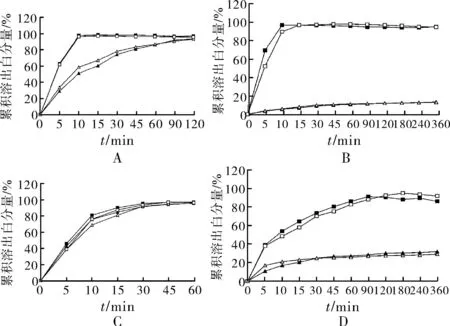
-■-参比制剂中的氨氯地平;-□-自制制剂中的氨氯地平
-▲-参比制剂中的厄贝沙坦;-△-自制制剂中的厄贝沙坦
图1自制制剂与参比制剂在4种不同溶出介质中的溶出曲线
A.盐酸溶液(pH2.0);B.醋酸盐缓冲液(pH4.5);C.磷酸盐缓冲液(pH6.8);D.水
Fig.1 Dissolution curve of self-prepared preparation and reference preparation in four different dissolution media
A. hydrochloric acid solution(pH2.0);B. acetate buffer (pH4.5); C. phosphate buffer pH(6.8);D. Water
2.11自制制剂与参比制剂溶出曲线的相似性评价采用相似因子(f2)法对自制制剂与参比制剂溶出曲线的相似性进行评价,若50≤f2<100,则判定2条曲线相似;当参比制剂与自制制剂在15 min内溶出量均达85%以上时,无需计算相似因子,直接判定2条曲线相似。自制制剂与参比制剂在4种介质中溶出曲线的相似因子测定结果见表6。实验结果表明,自制制剂与参比制剂在4种介质中的溶出曲线均相似。
表6自制制剂与参比制剂在4种介质中溶出曲线的相似性评价
Tab.6 The dissolution curve similarity evaluation of self-prepared preparation and reference preparation in four dissolution medium

溶出介质f2因子氨氯地平厄贝沙坦结论盐酸溶液(pH2.0)—*62.9相似醋酸盐缓冲液(pH4.5)—*95.8相似磷酸盐缓冲液(pH6.8)—*67.2相似水63.175.7相似
注:*15 min内溶出量达85%以上。
3讨论
f2因子法是美国食品与药物管理局( FDA) 推荐使用定量比较实验制剂与参比制剂溶出性质差异的方法,描述制剂体外溶出曲线相似性的非模型依赖方法[8]。该方法可判断不同处方对药物释放的影响程度,从而筛选出与进口片剂溶出性能优异的产品的相似处方,为新药申报注册的生物等效性实验做前瞻性预测。f2大于50 时即可认为曲线相似,f2越大表明曲线越相似[10-11]。
本品为复方制剂,包含氨氯地平和厄贝沙坦2种药物。分别对氨氯地平和厄贝沙坦进行了紫外扫描,结果显示,氨氯地平在237 nm波长处有最大吸收,厄贝沙坦在200~400 nm波长范围内未显示明显吸收峰,我们考虑到制剂中氨氯地平的量远小于厄贝沙坦,故选择以氨氯地平的最大吸收波长237 nm作为溶出度测定波长(厄贝沙坦在该波长下也具有较强吸收)。本实验评价了自制制剂与国外原研参比制剂在pH2.0盐酸溶液、pH4.5醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水等4种介质中溶出曲线的相似性。实验结果表明,自制制剂与参比制剂中的氨氯地平在pH2.0盐酸溶液、pH4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液中15 min内溶出量均达85%以上,在水中的溶出曲线f2因子大于50,可判定自制制剂与参比制剂中的氨氯地平在4种介质中的溶出曲线相似;自制制剂与参比制剂中的厄贝沙坦在4种介质中溶出曲线的f2因子均大于50,可判定自制制剂与参比制剂中的厄贝沙坦在4种介质中的溶出曲线相似。结果表明,自制制剂与国外原研参比制剂在4种介质中溶出曲线的一致性,在一定程度上反映了自制制剂与原研制剂质量的一致性[12]。
目前,我国药品申报中仿制药申请占据了较大比例,化药药品注册分类第3类的新药本质上也是仿制国外已经上市的药品。保证仿制药品与国外上市药品具有质量等同性,是仿制药研究应该遵循的共同准则,仿制研究时应进行多层面的质量对比研究,其中溶出度对比研究是工艺处方筛选的重要依据之一。同时,本实验还可为建立体内外相关性提供基础数据。自研制剂和参比制剂的体内生物利用度是否等效还有待进一步考察。
参考文献:
[1]Mori M, Takahashi S. Pharmacological and clinical
properties of AIMIX(R) combination tablets LD & HD, fixed-dose combination of irbesartan and amlodipine besilate[J]. Nihon Yakurigaku Zasshi, 2013, 142(1): 39-46.
[2]Lambers Heerspink H J, Weldegiorgis M, Inker L A,et al. Estimated GFR decline as a surrogate end point for kidney failure: a post hoc analysis from the reduction of end points in non-insulin-dependent diabetes with the angiotensin II antagonist losartan (RENAAL) study and irbesartan diabetic nephropathy trial (IDNT)[J]. Am J Kidney Dis, 2014,63(2): 244-250.
[3]Zhu D, Gao P, Holtbruegge W, et al. A randomized,double-blind study to evaluate the efficacy and safety of a single-pill combination of telmisartan 80 mg/amlodipine 5 mg versus amlodipine 5 mg in hypertensive Asian patients[J]. J Int Med Res, 2014,42(1):52-65.
[4]Bobrie G. I-combine study: assessment of efficacy and safety profile of irbesartan/amlodipine fixed-dose combination therapy compared with amlodipine monotherapy in hypertensive patients uncontrolled with amlodipine 5 mg monotherapy: a multicenter, phase Ⅲ, prospective, randomized, open-label with blinded-end point evaluation study[J]. Clin Ther, 2012, 34(8): 1705-1719.
[5]Bobrie G. I-add study: assessment of efficacy and safety profile of irbesartan/amlodipine fixed-dose combination therapy compared with irbesartan monotherapy in hypertensive patients uncontrolled with irbesartan 150 mg monotherapy: a multicenter, phase Ⅲ, prospective, randomized, open-label with blinded-end point evaluation study[J]. Clin Ther, 2012, 34(8): 1720-1734.
[6]脱鸣富,李新霞,林守峰,等. 盐酸氨溴索口腔崩解片溶出度测定方法的考察[J]. 西北药学杂志, 2010, 25(3):46-48.
[7]孔爱英,谢沐风,郭长君,等. 卡马西平片溶出度方法比较以及溶出曲线评价方法的探讨[J]. 中国药事, 2011, 25(2): 162-165.
[8]Costa P. An alternative method to the evaluation of similarity factor in dissolution testing[J]. Int J Pharm, 2001, 220(1): 77-83.
[9]陆步实,孙磊,周立新,等. 多条溶出曲线评价缬沙坦氨氯地平片的质量[J]. 中国医院药学杂志, 2012, 32(9): 704-707.
[10]Berry M R, Likar M D. Statistical assessment of dissolution and drug release profile similarity using a model-dependent approach[J]. J Pharm Biomed Anal, 2007, 45(2): 194-200
[11]Shah V P,Tsong Y,Sathe P,et al.Invitrodissolution profile comparison-statistics and analysis of the similarity factor,f2[J]. Pharm Res, 1998, 15(6): 889-896.
[12]Duan J Z, Riviere K, Marroum P.Invivobioequivalence andinvitrosimilarity factor (f2) for dissolution profile comparisons of extended release formulations: how and when do they match[J]. Pharm Res, 2011, 28(5): 1144-1156.
