Y-27632对低氧性肺动脉收缩的作用
2016-01-19刘蕾,沈歆,张志武等
·药理·
Y-27632对低氧性肺动脉收缩的作用
刘蕾,沈歆,张志武,肖雄,李小强*
(第四军医大学药学院药理学教研室,西安710032)
摘要:目的探讨Y-27632对低氧性肺动脉收缩的作用及其机制。方法建立小鼠低氧损伤模型;采用微血管张力实验测定肺动脉收缩力,WB检测TRPC6蛋白表达,离子影像技术测定平滑肌细胞全细胞钙变化。结果与对照组比较,CPA诱导低氧组肺动脉的收缩(加强到了167.9%±68.6%, `*P<0.05;Y-27632可显著抑制这一变化(抑制率为47.3%±17.8%, `#P<0.05);低氧可致肺动脉血管TRPC6蛋白表达显著增加(增加到154.8%±34.3%, `*P<0.05),这一变化可被Y-27632显著降低(降低到134.2%±18.2%, `#P<0.05);CPA诱导低氧组肺动脉平滑肌细胞[Ca`(2+)]i显著升高(荧光比率升高到188.9%±46.6%, `*P<0.05),此作用可被Y-27632显著抑制(荧光比率降低了46.7%±14.5%, `#P<0.05)。结论ROCK抑制剂Y-27632可通过调控TRPC6蛋白表达及其介导的[Ca`(2+)]i变化,重要性地参与低氧性肺动脉收缩。
关键词:钙离子;低氧性肺动脉收缩;经典瞬时受体电位通道蛋白;Y-27632
doi:10.3969/j.issn.1004-2407.2015.03.011
中图分类号:R965
文献标志码:A
文章编号:1004-2407(2015)03-0253-04
Abstract:ObjectiveTo investigate the effect of Y-27632 on hypoxic pulmonary vasoconstriction and the potential mechanism. Methods Hypoxia-induced injury model was made in mouse. CPA-induced muscle contraction was detected by capillary tension experiment. To explore the expression of TRPC6, WB and immunofluorescence staining experiments were performed. Ca`(2+) was measured using a fluorescence imaging system. Results CPA-induced muscle contraction was enhanced by 167.9%±68.6% in hypoxic pulmonary artery compared with control, which was markedly inhibited by Y-27632(inhibition ratio was 47.3%±17.8%, `#P<0.05). The expression of TRPC6 induced by hypoxia was markedly increased (to 154.8%±34.3%, `*P<0.05). After treatment with Y-27632, the expression of TRPC6 was significantly decreased compared with hypoxia mice (to 134.2%±18.2%, `#P<0.05). Ca`(2+) influx in pulmonary artery smooth muscle cells elicited by store depletion using CPA were dramatically augmented in hypoxia group by 188.9%±46.6% in the ratio of 340 nm/380 nm(`*P<0.05). However, Y-27632 obviously attenuated this change by 46.7%±14.5%(`#P<0.05).Conclusion Inhibition of ROCK by Y-27632 can importantly take part in HPV via the regulation of TRPC6 expression in pulmonary artery, which mediated extracellular Ca`(2+) influx.
基金项目:国家自然科学基金(No.81170107,No.30800433)
作者简介:刘蕾,女,硕士研究生
收稿日期:(2015-01-30)
Effect of Y-27632 on hypoxic pulmonary vasoconstriction
LIU Lei, SHEN Xin, ZHANG Zhiwu, XIAO Xiong, LI Xiaoqiang*(Department of Pharmacology, School of Pharmacy,the Fourth Military Medical University, Xi′an 710032, China)
Key words: calcium; hypoxic pulmonary vasoconstriction; TRPC channel; Y-27632
*通信作者:李小强,男,副教授,硕士研究生导师
低氧性肺血管收缩(hypoxic pulmonary vasoconstriction,HPV) 是低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)形成的基本病理生理特征之一[1,2]。寻找针对HPV的防治药物是肺动脉高压治疗的重要策略。研究发现[3],RhoA蛋白及其下游效应因子Rho激酶(Rho-kinase, ROCK)通路参与了HPH的发生、发展,ROCK抑制剂是一种很有希望的PH治疗药物。Y-27632作为一种ROCK抑制剂,是否能在HPV中发挥作用,目前尚不清楚,有待深入研究[4]。本研究通过检测Y-27632对环匹阿尼酸(CPA)诱导的肺动脉血管收缩,经典瞬时受体电位通道6(transient receptor potential canonical channel, TRPC6)的蛋白表达及其介导的细胞内Ca2+动员等的影响,以明确其对HPV的作用,探讨其可能的机制。
1仪器与材料
1.1仪器WB化学发光成像检测系统(Tanon公司);雷磁PHS-3C pH计(上海精密科学化学有限公司);AB135-S精密天平(METTLER公司);SCIENTZ-IID型超声波细胞粉碎仪(宁波新芝生物有限公司);5415R低温离心机(Eppendorf公司);TILL离子影像系统(TILL公司);Power Lab系统(AD公司);激光共聚焦显微镜(Olympus公司)。
1.2试药TRPC6抗体(Alomone labs公司,ACC017AN4102);化学发光剂(Millipore公司, 1201601) ;CPA(Cayman公司,45k8247);Y-27632(Sigma公司,040M1912V);木瓜蛋白酶(Sigma公司,110M7017V);Ⅱ型胶原酶(Sigma公司,45k8247);SKF-96365(Sigma公司,030M4622V)。
1.3动物8周龄SPF级雄性C57BL/6J小鼠,体质量18~20 g,由第四军医大学动物实验中心提供。
2实验方法
2.1缺氧模型的建立实验小鼠随机分为3组:对照组,缺氧条件下的模型组和Y-27632给药组。将小鼠置于缺氧舱中,通入100 mL·L-1氧气(空气与氮气体积比1∶1)的低氧条件下进行缺氧,每天持续8 h,持续6周。给药组在每天缺氧前腹腔注射Y-27632(剂量为10 mg·kg-1·d-1),对照组和缺氧组小鼠注射相当体积的生理盐水。
2.2细胞分离与培养麻醉小鼠,用750 mL·L-1乙醇消毒,开胸迅速取出心肺,置于无菌PSS中漂洗;显微镜下分离出肺动脉并剪碎,放入37 ℃木瓜蛋白酶(1 g·L-1)中消化20 min;吸去上清,加入Ⅱ型胶原酶(1 g·L-1)溶液,消化20 min;吸上清,加5 mL改良Eagle培养基(Dulbecco′s modified eagle medium,DMEM),吹打吹散细胞,过滤,以1 000 r·min-1离心5 min,弃上清,用含200 mL·L-1胎牛血清(FBS)的DMEM吹悬,接种于培养瓶/板。对照组置于37 ℃常氧培养箱中培养,缺氧组置于自制的有机玻璃盒内,密闭后放入培养箱,给药组按10 μmol·L-1给予Y-27632后,缺氧培养。
2.3微血管张力的测定分离肺动脉血管,剪成1 mm小段,将2根金属丝插入血管环管腔中,移入充满5 mL 含2 mmol·L-1Ca2+生理盐水(PSS)的37 ℃恒温浴槽,持续通以体积分数95%O2与5%CO2的混合气体[5-6];打开Powerlab生物信号采集系统,调用事先设置的肺动脉张力模板,调零后,调节肺动脉环负荷约2~3 mN的基础张力,平衡45 min后,用2 mmol·L-1Ca2+PSS冲洗3次,平衡后,换用0 Ca2+PSS溶液进行后续实验:依次向浴槽中加入硝苯地平(Nif, 5 μmol·L-1),CPA(10 μmol·L-1),2 Ca2+PSS,SKF-96365(10 μmol·L-1)。
2.4WB法检测蛋白表达采用WB法对肺动脉平滑肌细胞(PASMSs)TRPC6蛋白的表达进行检测。收集各组PASMSs,加入预冷的裂解缓冲液,裂解30 min,4 ℃以1 2000 r·min-1离心15 min。取上清测蛋白浓度。以每泳道20 μg蛋白等量样品上样,以100 mL·L-1SDS-聚丙烯酰胺水溶液进行凝胶电泳分离蛋白。电泳后将蛋白电转到NC膜上,将膜用50 g·L-1脱脂奶粉溶液37 ℃封闭2 h后,与TRPC6一抗在37 ℃反应2 h,PBST清洗3次,再与辣根酶标记的二抗37 ℃反应1 h,用PBST充分洗涤后,进行化学发光检测,以β-actin作为内参照,分析TRPC6蛋白的相对表达量。
2.5免疫荧光染色实验将消化所得的细胞,按每孔1×105的数量接种于无菌玻片上,于6孔板中培养,按2.2方法进行分组培养24 h;移去培养液,用PBS漂洗后,加入40 mL·L-1多聚甲醛水溶液室温固定20 min;再用PBS漂洗,用山羊血清封闭液(含1 mL·L-1Triton水溶液)封闭30 min;吸去封闭液,加一抗(1∶150)4 ℃过夜;取出后用PBS充分漂洗,37 ℃荧光二抗(1∶200)避光孵育2 h;再漂洗后,与Hoechest(1∶100)共孵育10 min;最后用PBS漂洗,500 mL·L-1甘油水溶液封片。应用激光扫描共聚焦显微镜(奥林巴斯)对细胞进行XY面扫描,记录并分析细胞TRPC6蛋白的表达情况。
2.6细胞内Ca2+浓度的测定将加微量细胞悬液置于浴槽中与等体积荧光染料 Fluo-2/AM(5 μmol·L-1)混合避光孵育40 min,用含2 mmol·L-1Ca2+的生理盐溶液(PSS)充分灌流冲洗细胞外多余染料,再用无钙(0 Ca2+)PSS平衡5 min。实验时,用340与380 nm的激发光激发胞内荧光探针Fura-2,用CCD拍摄荧光的动态变化。实验中,加入5 μmol·L-1Nif 以阻断电压依赖性钙通道(voltage-dependent calcium channel, VDCC),加入10 μmol·L-1CPA充分作用(抑制肌浆网Ca2+泵,以耗竭细胞内钙库中的Ca2+,激活钙库操纵性钙通道,最终引起[Ca2+]i显著升高),继而加2 mmol·L-1Ca2+PSS溶液,观察并记录肺动脉平滑肌细胞[Ca2+]i变化。
3结果
3.1Y-27632对CPA诱导的小鼠肺动脉收缩的影响应用10 μmol·L-1CPA耗竭肺动脉细胞钙库中的Ca2+,在2 mmol·L-1Ca2+PSS条件下,可诱导肺动脉收缩;结果见图1所示:与对照组比较,CPA诱导低氧组肺动脉产生了显著地收缩,*P<0.05;与低氧组比较,Y-27632可显著地抑制CPA诱导的肺动脉的收缩,#P<0.05;10 μmol·L-1TRPC通道阻断剂SKF-96365完全阻断了3个组的血管收缩反应。
3.2Y-27632对缺氧致TRPC6蛋白表达升高的影响TRPC6通道蛋白是钙库操纵性钙通道构成的重要成分[7]。如图2 WB结果所示,缺氧条件下,小鼠肺动脉平滑肌细胞TRPC6的蛋白表达与对照组相比显著增加,*P<0.05;而与缺氧组相比,Y-27632组小鼠肺动脉平滑肌细胞TRPC6蛋白表达显著降低,#P<0.05。免疫荧光染色实验结果进一步提示,低氧引起肺动脉平滑肌细胞TRPC6蛋白表达显著升高,这一变化可被ROCK抑制剂Y-27632显著抑制。

图1Y-27632对CPA诱导的小鼠肺动脉收缩的影响
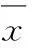
Fig.1 Effect of Y-27632 on CPA-induced muscle contraction in mouse pulmonary arteries.
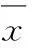
3.3Y-27632对平滑肌细胞全细胞钙变化的影响为确证Y-27632对低氧引起TRPC6蛋白表达抑制是否影响[Ca2+]i,采用离子影像技术测定了[Ca2+]i的变化。研究结果如图3所示,与正常组比较,CPA诱导缺氧组肺动脉平滑肌细胞[Ca2+]i显著升高,*P<0.05;而与缺氧组比较,CPA诱导的Y-27632组肺动脉平滑肌细胞 [Ca2+]i升高显著降低,#P<0.05。10 μmol·L-1TRPC通道阻断剂SKF-96365可显著阻断3个组[Ca2+]i的升高。
4讨论
本研究发现,低氧可引起CPA诱导的小鼠肺动脉血管收缩显著加强,ROCK抑制剂Y-27632可显著抑制这一过程,此作用与Y-27632抑制低氧诱导的TRPC6蛋白表达升高,进而减弱由TRPC6介导的细胞内[Ca2+]i的升高密切相关。
以往研究发现[3],ROCK信号通路磷酸化肌球蛋白轻链磷酸酶亚单位MYPT1可介导“钙敏感机制”,调控肺动脉的收缩。本研究中,ROCK抑制剂Y-27632可明显调控小鼠肺动脉血管收缩,以及低氧引起的小鼠肺动脉血管和肺动脉平滑肌细胞TRPC6蛋白表达的显著升高,提示ROCK信号通路可能也可通过钙依赖机制调控HPV。因为,TRPC通道是瞬时受体电位(TRP)超家族的成员之一,是具有Ca2+可渗透性的非选择性阳离子通道(non-selective cation channel, NSCC),是受体操纵性钙通道(receptor-operated calcium channel, ROCC)和库操纵性钙通道(store-operated calcium channel, SOCC)的重要组成部分[8-10]。
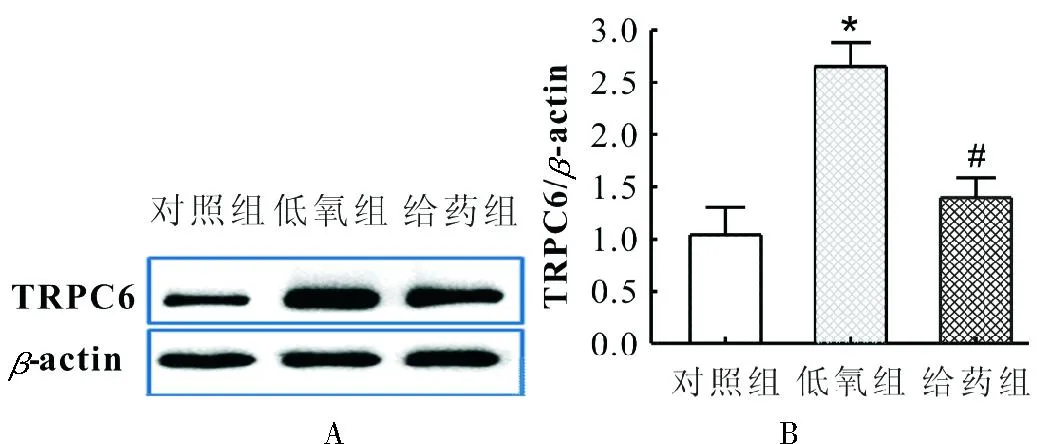
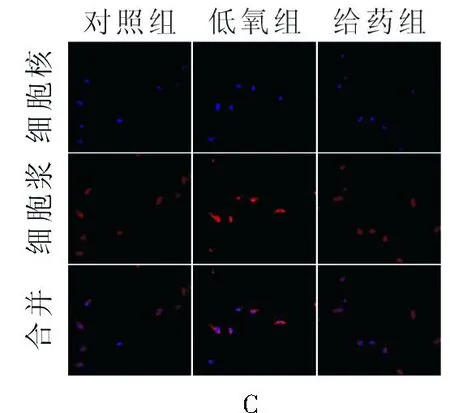
图2Y-27632对缺氧致肺动脉平滑肌细胞TRPC6蛋白表达升高的影响
A.WB实验结果;B.各组小鼠肺动脉血管TRPC6蛋白表达的相对量;C.各组肺动脉平滑肌细胞TRPC6蛋白表达的免疫荧光检测。n≥3;*P<0.05,表示与对照组相比;#P<0.05,表示与低氧组相比。
Fig.2 Effect of Y-27632 on the expression of TRPC6 in PASMCs under hypoxia
A. original images showing the expression of TRPC6 in mouse PASMCs by WB;B. normalized amount of TRPC6 protein harvested from mouse PASMCs;C. TRPC6 immunofluorescence staining in PASMCs images by using a confocal microscope.*P<0.05, compared with control,#P<0.05,compared with hypoxia group.
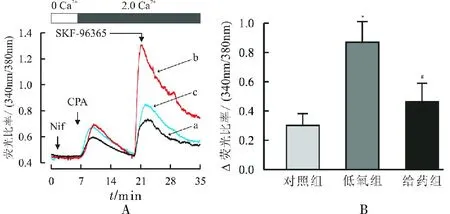
图3Y-27632对TRPC6介导的肺动脉平滑肌细胞全细胞钙变化的影响
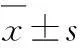
Fig.3 Effect of Y-27632 on CPA-induced increase in [Ca2+]ithrough TRPC in mouse PASMCs
TRPC激活时可介导NSCC电流,其主要成分为Ca2+流[11]。为此,本研究进一步采用离子影像技术测定了Y-27632对平滑肌细胞[Ca2+]i变化的影响。结果发现,TRPC通道阻断剂SKF-96365可阻断3个组[Ca2+]i的升高,尤其是显著阻断了低氧组细胞[Ca2+]i的升高,结合前述TRPC6蛋白表达的实验结果提示,TRPC6通道是低氧引起[Ca2+]i升高的重要来源。
综上所述,ROCK抑制剂Y-27632可通过调控TRPC6蛋白表达及其介导的细胞[Ca2+]i变化,重要性地参与低氧性肺动脉的收缩。本研究从新的视角对ROCK抑制剂Y-27632调控低氧性肺动脉收缩的分子机制进行了探索,是对ROCK信号通路通过“钙敏感机制”调控低氧性肺动脉收缩机制的重要补充,也为拓展ROCK抑制剂临床应用于肺动脉高压等相关疾病的治疗提供了实验依据。
参考文献:
[1]Swenson E R. Hypoxic pulmonary vasoconstriction[J]. High Alt Med Biol, 2013, 14(2):101-110.
[2]王萌,李志超,王剑波. 虎杖苷对低氧所致大鼠肺微血管内皮细胞损伤的保护作用[J]. 西北药学杂志, 2011,26(3):185-189.
[3]Duong-Quy S, Bei Y, Liu Z, et al. Role of Rho-kinase and its inhibitors in pulmonary hypertension[J]. Pharmacol Ther, 2013, 137(3):352-364.
[4]Connolly M J, Aaronson P I. Key role of the RhoA/Rho kinase system in pulmonary hypertension[J]. Pulm Pharmacol Ther,2011, 24(1):1-14.
[5]巫龙,卞筱泓,聂煜,等. 降压中药有效成分组合对大鼠胸主动脉的舒张作用[J]. 西北药学杂志, 2011,26(2):113-115.
[6]李兰娥,卞筱泓,许激扬,等. 牛膝总皂苷对大鼠离体胸主动脉环舒张作用的机制研究[J]. 西北药学杂志, 2012,27(3):223-226.
[7]Dietrich A, Gudermann T. TRPC6: physiological function and pathophysiological relevance[M]. Handb Exp Pharmacol, 2014, 222:157-188.
[8]Ong H L, de Souza L B, Cheng K T, et al. Physiological functions and regulation of TRPC channels[M]. Handb Exp Pharmacol, 2014, 223:1005-1034.
[9]Cheng K T, Ong H L, Liu X, et al. Contribution and regulation of TRPC channels in store-operated Ca2+entry[J]. Curr Top Membr, 2013, 71:149-179.
[10]Chow J Y, Estrema C, Orneles T, et al. Calcium-sensing receptor modulates extracellular Ca2+entry via TRPC-encoded receptor-operated channels in human aortic smooth muscle cells[J]. Am J Physiol Cell Physiol, 2011, 301(2):C461-468.
[11]Nelson P L, Beck A, Cheng H. Transient receptor proteins illuminated: current views on TRPs and disease[J]. Vet J, 2011, 187(2):153-164.
