SSR分子标记技术在甘蓝型油菜杂交种陕油16纯度鉴定中的应用
2016-01-17徐爱遐
卢 虹, 徐爱遐
(西北农林科技大学农学院旱区作物逆境生物学国家重点实验室, 陕西 杨凌712100)
油菜属于十字花科芸薹属,是世界四大油料作物(大豆、油菜、花生、向日葵)之一。中国是重要的油菜生产国,2013—2014年度中国的油菜籽产量占世界总产量的20.6%。2012—2013年度中国油料播种面积为1 402.3万hm2,油菜籽播种面积为753.1万hm2,占油料播种面积的53.7%。2012—2013年度较往年油菜播种面积、总产增加,但是单产降低[1],杂种优势的利用是一种有效的提高油菜产量的重要途径。
随着油菜杂种优势的利用,市场上的杂交油菜推广面积占油菜生产总面积的60%[2]。杂种利用的主要途径有:细胞质雄性不育(CMS)、细胞核雄性不育(GMS)、化学诱导雄性不育(CHA)和自交不亲和性(SI)等[3],但目前应用于生产的细胞质雄性不育主要是高温不育型,在低温条件下容易产生微粉,造成自交结实从而影响杂交种的纯度[4]。因此,对杂交种的纯度研究显得尤为重要。
目前,农作物杂交种纯度的鉴定方法主要有三大类:形态学鉴定、生化标记鉴定和DNA水平鉴定。形态学鉴定周期长,易受环境影响,相似形态特征的鉴定困难,鉴定者的经验制约设鉴定的准确性,而且花费高;生化标记鉴定不稳定受环境影响较大,具有严格的组织和时间表达特异性[5-6]。DNA水平鉴定有DNA分子标记技术和基因组DNA的光谱分析(Fourier transform infrared spectroscopy)[7],DNA 分子标 记技术可以有效的避免上述问题,具有简便、快速、准确的特点。DNA分子标记技术主要包括RAPD、SRAP、SSR、ISSR、EST-SSR、INDEL、AFLP 等[8-12]。其中,SSR分子标记技术广泛应用于油菜[13]、大豆[14]、向日葵[15]、棉花[16]、水稻[17-8]、玉米[19]等的杂交种纯度鉴定。
本试验利用SSR标记技术对甘蓝型油菜陕油16杂交种纯度进行研究,以期找到可以鉴定陕油16杂交种纯度的SSR标记。
1 材料与方法
1.1 试验材料
甘蓝型油菜杂交种陕油16及其双亲9A(♀)和530C(♂)均由西北农林科技大学油菜中心品种资源课题组提供。陕油16大田制种种子样本由杨凌金诺公司和杨凌高科公司提供。
1.2 试验方法
1.2.1 引物设计与合成
80对引物来源于白菜型油菜基因组已公布信息,下载网址 http://brassicadb.org/brad/geneticMarker.php?chr=ALL。所有引物均有上海生工生物技术服务有限公司合成。
1.2.2 DNA的提取与检测
杂交种陕油16及其亲本各取100粒,大田制种种子各取400粒,分别均匀放入铺有2层吸水纸的培养皿中,早晚各浇水1次,室温下发芽5~7d。取幼芽上半部分放入研钵中,随机选取实验材料父本、F1、母本标准样品10个单株的幼嫩子叶分别混合磨样,提取DNA用于标记筛选。陕油16大田制种材料分别取188株并编号,进行单株DNA提取,用于纯度鉴定。基因组DNA提取采用CTAB法进行[20]。
1.2.3 杂交种及其亲本的SSR分析
1)PCR扩增。PCR循环参数94℃预变性3 min,94℃变性1min,60℃退火30s,72℃延伸45s,此后每个循环退火温度降低0.5℃,共计9个循环;94℃变性1min,55℃退火30s,72℃延伸45s,29个循环;72℃延伸10min,4℃保存。

表1 PCR反应体系
2)电泳检测。样品从PCR中取出来后加入等体积的Loading buffer,放入水浴中变性5min,然后放入冰水混合物中冷却;然后在6%变性聚丙烯酰胺凝胶上电泳(U=2 000VI=200AP=85W)45min左右;电泳完成后,用10%醋酸固定20min后,蒸馏水漂洗2遍,每次10min;然后用硝酸银染色、碳酸钠显影,再用10%醋酸固定,经漂洗后自然风干,拍照保存。
1.3 种子纯度的鉴定
1.3.1 SSR分子标记鉴定
用80对SSR引物在构建的陕油16及其双亲的基因池中进行筛选,用筛选到的具有差异的SSR引物鉴定陕油16大田制种材料的纯度。杂交种纯度(%)=具有双亲特征条带的样本数/检测的样本总数×100%。
1.3.2 田间植株鉴定
陕油16种植于西北农林科技大学油菜实验基地,每个品种设2个小区,进行常规田间管理,不间苗,在盛花期统计总株数以及不育株数。
鉴定方法为:当天开的花中,如果有花朵的花药高于柱头、正常散粉且发育正常则记为可育株,花朵较小、花药等于或低于柱头且雄蕊退化不能散粉的单株记为不育株,其中未开花的单株不计数。
2 结果与分析
2.1 特征型引物的筛选
用80对SSR引物在陕油16杂交种及其亲本中进行筛选和群体验证后,确定有3对引物SSR 313、SSR 354、SSR 359在陕油16杂交种及其亲本中存在多态性,扩增带型清晰,容易分辨,且在陕油16及其双亲中表现共显性,见图1,引物序列见表2。
2.2 SSR标记用于陕油16杂交种种子纯度鉴定
试验中共检测了188个陕油16杂交种单株(如图2~图4箭头所示),与P1条带相同的记为母本(不育系),与P2条带相同的记为父本(恢复系),与F1条带相同的记为杂交种;图2,图3,图4分别是SSR 313、SSR 354、SSR 359用于陕油16大田制种种子纯度鉴定图(部分)。
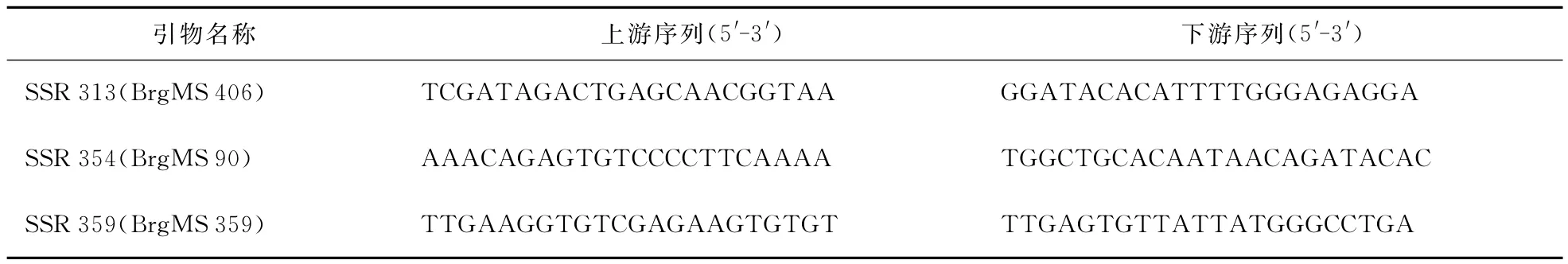
表2 SSR引物序列

图1 SSR引物对陕油16及其亲本的扩增结果

图2 SSR 313对陕油16部分单株及其亲本的扩增结果

图3 SSR 354对陕油16部分单株及其亲本的扩增结果
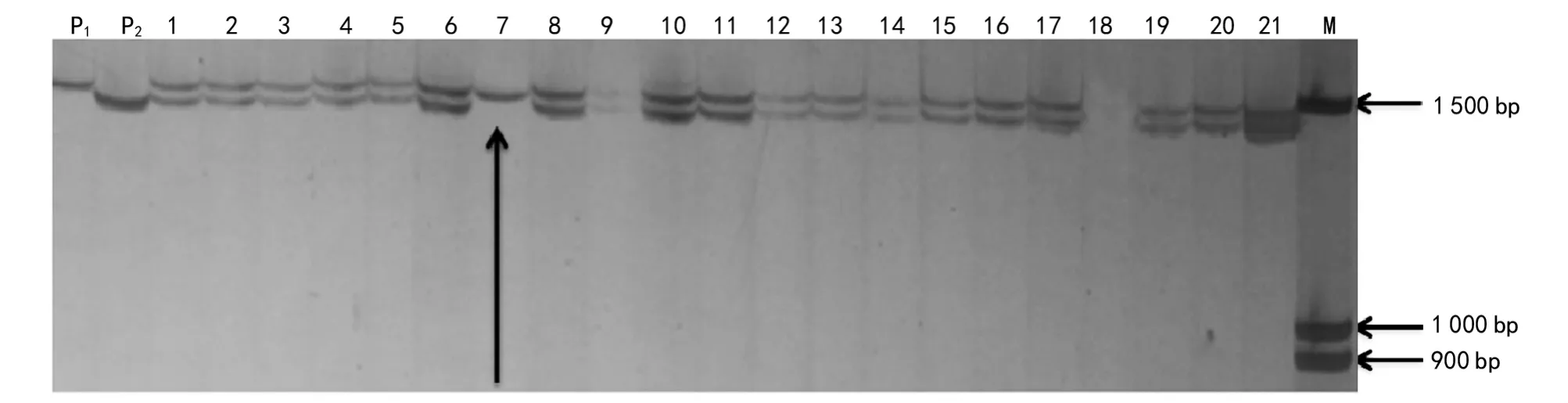
图4 SSR 359对陕油16部分单株及其亲本的扩增结果
统计2品种杂交种种子中不育系(母本)比率、恢复系(父本)比率和杂交种纯度鉴定结果见表3。从表3可以看出,SSR标记鉴定结果中不育株比率均大于恢复系比率。

表3 陕油16杂交种种子纯度鉴定结果
2.3 田间植株鉴定
于油菜盛花期(4月1日)在田间对陕油16鉴定圃材料进行全区逐株观察鉴定,鉴别育性。田间种植鉴定结果显示,陕油16品种的平均纯度为85.61%,结果见表4。
对陕油16的SSR鉴定结果与田间鉴定结果进行了比较分析,结果显示,田间鉴定的平均纯度高于SSR鉴定结果3.71%。
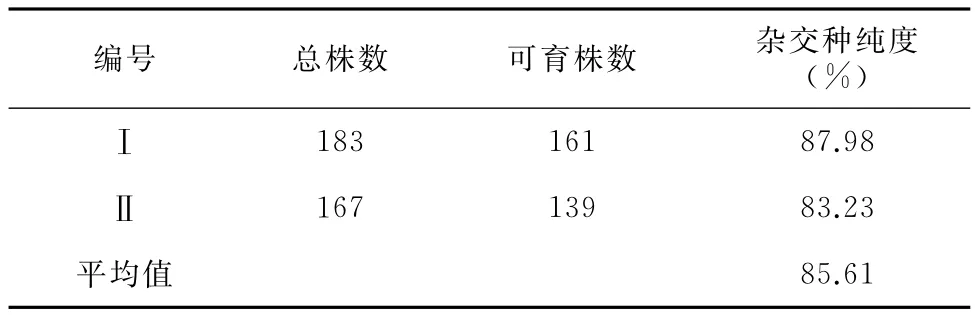
表4 陕油16的田间鉴定结果
3 讨 论
首先,本研究筛选的SSR引物在陕油16的F1代杂交种扩增结果均具有亲本的两条带,说明SSR标记有稳定的共显性,可以用来鉴定甘蓝型油菜的杂交种纯度。
其次,本研究发现,分子标记鉴定结果中,不育株率较父本株率高,说明母本因微粉导致的自交是杂交种种子纯度降低的重要原因。因此,在制种过程中要特别注意母本的育性,可采用化学杀雄的方法尽量避免由于微粉造成的杂交种纯度降低。
此外,本研究中SSR标记纯度鉴定结果均低于田间鉴定结果,与王同华等[21]的研究结果一致,出现这种现象的可能原因是田间鉴定主要通过形态学特征进行判断,由于材料间亲缘关系较近,很难做出准确的鉴定,而SSR分子标记技术可以准确识别非杂交单株,如由于母本因微粉导致的自交、花粉污染、机械混杂等原因造成的混杂,因此,SSR标记技术得到的纯度鉴定结果比种植鉴定的结果更为可靠、准确。
[1]王汉中,殷艳.我国油料产业形势分析与发展对策建议[J].中国油料作物学报,2014,36(4):414-421.
[2]傅廷栋.油菜的品种改良[J].作物研究,2007(3):159-162.
[3]傅廷栋.杂交油菜的育种与应用[M].武汉:湖北科学技术出版社,1995:124-129.
[4]苏英.甘蓝型油菜品种的细胞质育性类型初探[J].陕西农业科学,2012(6):181-182,246.
[5]梅眉,陆璐.DNA分子标记技术在农作物种子质量检验中的应用[J].分子植物育种,2005,3(1):129-134.
[6]刘子记,曹振木,杨衍.应用分子标记技术检测作物杂交种纯度研究进展[J].种子,2013,32(6):48-52.
[7]Song S Y,Eun Y J,Myung S A,et al.Fourier transform infrared(FT-IR)spectroscopy of genomic DNA to discriminate F1progenies from their paternal lineage of Chinese cabbage(Brassica rapasubsp.pekinensis)[J].Molecular Breeding,2013,33(2):453-464.
[8]Huang C Q,Liu G D.Bai C J,et al.Application of SRAP markers in the identification of Stylosanthes guianensis hybrids[J].Mol Biol Rep,2014,41(9):5 923-5 929.
[9]Ye S,Wang Y,Huang D Q,et al.Genetic purity testing of F1hybrid seed with molecular markers in cabbage(Brassica oleracea var.capitata)[J].Scientia Horticulturae,2013,155:92-96.
[10]Naresh V,Yamini K N,Rajendrakumar P,et al.EST-SSR marker-based assay for the genetic purity assessment of safflower hybrids[J].Euphytica,2009,170(3):347-353.
[11]王玲平,戴丹丽,吴晓花,等.AFLP分子标记技术在浙蒲2号种子纯度快速鉴定中的应用[J].浙江农业学报,2008,20(2):84-87.
[12]葛敏,蒋璐,张晓林,等.利用Insertion/Deletion(InDel)分子标记检测玉米互交种混杂的原理及应用[J].分子植物育种,2013,32(1):37-47.
[13]Chen F,Zhang J F,Chen S,et al.A Method for Rapid Identification of Ningza 11[J].Molecular Biology and Tissue Culture,2014,15(1):9-12.
[14]Zhang C B,Peng B,Zhang W L,et al.Application of SSR Markers for Purity Testing of Commercial Hybrid Soybean(Glycine max L.)[J].Journal of Agriculture Science and Technology,2014,16:1 389-1 396.
[15]Pallavi H M,Rame G,Shadashari Y G,et al.Identification of SSR markers for hybridity and seed genetic purity testing in sunflower (Helianthus annuus L.)[J].Helia,2011,34(54):59-66.
[16]Dongre A,Vilas P.Identification of Cotton Hybrid through the Combination of PCR Based RAPD,ISSR and Microsatellite Markers[J].J.Plant Biochemistry & Biotechnology,2005,14:53-55.
[17]Sundaram R M,Naveenkumar B,Biradar S K,et al.Identification of informative SSR markers capable of distinguishing hybrid rice parental lines and their utilization in seed purity assessment[J].Euphytica,2008,163(2):215-224.
[18]Hashemi S H,Sayyed A M M,Ghorban A N,et al.Identification of rice hybrids using microsatellite and RAPD makers[J].African Journal of Biotechnology,2009,8(10):2 094-2 101.
[19]李晓辉,李新海,李文华,等.SSR标记技术在玉米杂交种种子纯度测定中的应用[J].作物学报,2003,29(1):63-68.
[20]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19:11-15.
[21]王同华,陈卫红,李莓,等.基于SSR标记技术的油菜杂交品种沣油958的种子纯度鉴定[J].现代农业科技,2014,18:20,25.
