裸子植物种子发育过程及基因调控研究进展
2016-01-17李卫星何青松杨舜博
李卫星, 崔 慧, 何青松, 杨舜博, 王 莉
(扬州大学园艺与植物保护学院, 江苏 扬州225009)
裸子植物的种子裸露,外面没有果皮包被[1],为较原始的种子植物,包括苏铁类(cycads)、银杏类(Ginkgo)、松 杉 类 (Conifers)和 买 麻 藤 类 (Gnetales)[2]。目前认为裸子植物包含12个科,苏铁类和银杏类只有苏铁、银杏一科,被认为是裸子植物最原始的类群;松杉类包括杉科、南洋杉科、红豆杉科、三尖杉科、柏科、松科和罗汉松科;买麻藤类包括买麻藤科、麻黄科、百岁兰科,是裸子植物最进化的类群。由于裸子植物既保留孢子植物的部分特征(如苏铁和银杏可产生独特的多鞭毛精子[3]),又具有被子植物的进化特征(如买麻藤科具有双受精现象),所以裸子植物在植物系统演化中处于重要位置,具有重要的研究价值。
裸子植物的繁殖器官是种子,种子由胚珠发育而来,发育完全的种子包括种皮、胚和胚乳。其中,种皮是包围在胚和胚乳外部的保护组织,由珠被发育而来;胚由受精卵发育而来并最终发育为幼苗,是最重要的部分;胚乳是由雌配子体细胞发育而来,为胚的发育提供必需的营养物质。近年来,发现许多与种子发育相关的基因。本文从裸子植物种子的结构、发育过程及分子调控机制等方面进行综述。
1 裸子植物种子的结构特征
裸子植物是以种子进行有性繁殖的,种子为多细胞结构,由种皮、胚乳、种胚3部分组成,其中发育完全的胚包括胚根、胚轴、胚芽和子叶。被子植物和裸子植物的种子结构较为相似,但被子植物可根据种胚中子叶的数目分为单子叶植物和双子叶植物。而比裸子植物发育更为原始的孢子植物是以孢子进行繁殖,孢子的体积一般微小,且大多为单细胞[4]。裸子植物种子的形态较为简单,一般为圆球形,如柏科、罗汉松科;倒卵形,如苏铁科、松科;也有一些呈卵圆形,如杉科、南洋杉科。相反,较为进化的被子植物,种子的形态则多样化,有多角形、舟形、卵形、矩圆形等多种类型[5]。而孢子植物成熟的孢子结构甚至比裸子植物种子形态还要简单,大多近似球形。这说明从繁殖器官的形态来看,孢子植物到被子植物的进化过程中,形态逐渐变得复杂多样,而裸子植物作为中间过渡阶段,则兼具了孢子植物和被子植物繁殖器官的某些形态特征,既表现出原始的现象,又有进化的特征。
裸子植物种皮可明显的分为外种皮、中种皮和内种皮3部分,分别由授粉前珠被的外层区、中层区和内层区细胞分化发育而来。成熟后的外种皮为薄壁组织细胞组成,而有些植物的外种皮发育成肉质状,如罗汉松科由套被发育而来的肉质假种皮,三尖杉科由珠托发育而来的肉质假种皮,以及麻黄科由盖被发育而来的革质或稀为肉质假种皮[1]。中种皮由数层强烈木质化的厚壁组织构成。内种皮则为几层薄壁组织组成。不同的是,被子植物种皮结构则表现出多样性,有的具有坚硬的种皮,如豆科、棉花;有的植物种皮薄如纸状,如桃、花生。而孢子植物的孢子外面主要为较厚的细胞壁所包被,孢壁主要由内壁、外壁和周壁组成。这说明繁殖器官的结构会随着植物进化而复杂化,裸子植物经历了简单到复杂的过渡阶段,各科之间既有共性又存在差异(表1)。
2 裸子植物种子的发育过程
裸子植物种子由胚珠发育而来,胚珠主要是由珠心(nucellus)、珠被(integument)、合点(chalaza)、珠孔(micropyle)和珠柄(funiculus)5部分组成[6]。胚珠细胞平周分裂形成胚珠原基,随后,原基的前端逐渐发育成为珠心,基部成为珠柄;在胚珠发育早期,在珠心基部产生一环状的突起,被称为珠被;珠被向上生长包围珠心,珠被在珠心顶端形成孔隙,称为珠孔;珠被、珠心和珠柄的结合部位称为合点[7]。裸子植物与被子植物种子的发育进程主要有以下几点不同:
1)珠被的发育。珠被最后发育为种皮,裸子植物一般为单珠被,是靠近珠心的1层片状结构[8],最终分化为3层种皮,如银杏。不同的是被子植物大部分都有双珠被,如拟南芥[9],一般可分为外珠被和内珠被,外珠被的原基通常是由下皮层或皮层细胞平周分裂形成,而内珠被的原基由珠心基部的原表皮层平周分裂而来,大多数被子植物的内珠被在胚胎发育后期退化消解,如豆科[10]、厚皮香科[11]。
2)胚乳的发育。裸子植物胚乳来源于雌配子体,受精作用前就存在,由大孢子叶直接发育而来,为单倍体。而被子植物胚乳是双受精过程中精细胞与2个极核融合的营养组织,为三倍体。
3)受精场所。裸子植物具有特殊的颈卵器结构,在颈卵器中进行受精作用,从传粉到受精的时间较长,受精卵分裂发育成胚胎。裸子植物精细胞进入颈卵器的方式也有所不同,有的花粉管将全部内含物释放入颈卵器中,随后不具功能的细胞会解体消失,如白皮松、油松等松科植物[12-13],有的花粉管在接近颈卵器的地方开始分裂形成两个精细胞,精细胞进入颈卵器完成受精作用,如银杏、苏铁[14-15]。而被子植物受精过程在珠心内完成,且传粉后即可完成受精。
4)胚胎发育进程。裸子植物胚胎发育过程可分为原胚阶段、早期胚阶段和后期胚阶段[16],如银杏和苏铁的合子分裂后首先进入游离核时期,后逐渐细胞化并有胚柄细胞形成及发育,后期胚阶段胚柄组织逐渐退化,种胚进行组织的分化、器官的形成和营养物质的积累。而买麻藤科植物的受精卵不经历游离核时期而直接发育形成胚[17]。不同的是,被子植物胚胎发育过程一般可分为原胚、球形胚、心形胚、鱼雷形胚和成熟胚5个阶段[18-19],合子不均等分裂成顶细胞和基细胞,顶细胞直接发育为原胚而基细胞发育为胚柄,胚柄在胚成熟后期退化,成熟胚会达到形态、结构和生理上的成熟。
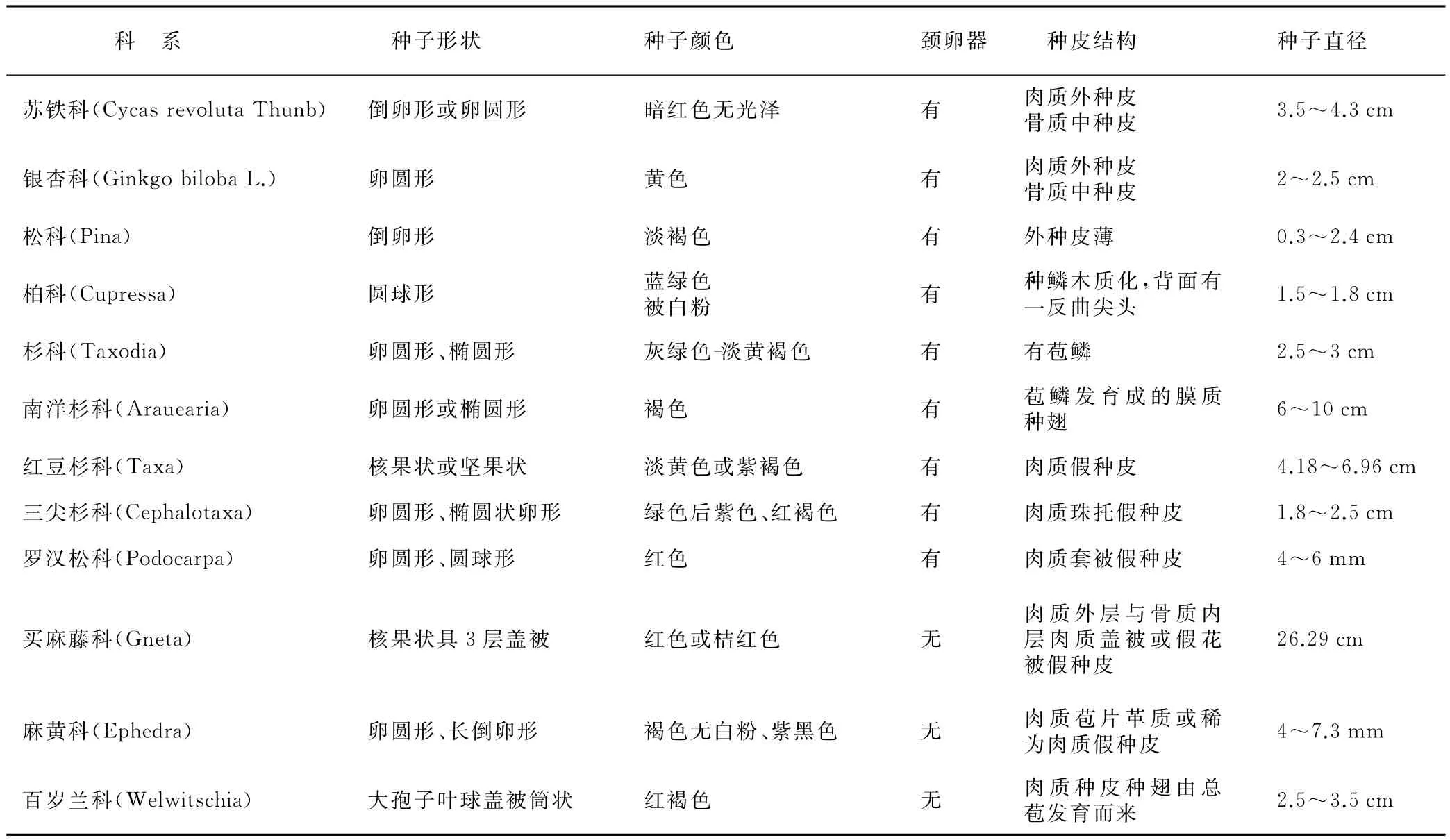
表1 裸子植物各科种子结构特征比较
裸子植物与被子植物胚胎发育不仅在形态发生上有差异,其生理发生也不同,主要是营养物质的积累与代谢。裸子植物营养物质主要贮存在胚乳中,胚胎发生初期,积累的营养物质主要包括可溶性糖、可溶性蛋白及脂肪酸等,如松科[20]、马尾松[21]、东北红豆杉[22]等。而随着胚胎的分化发育,淀粉等可溶性糖的含量不断变化,如东北红豆杉的可溶性糖含量先升高再下降而后小幅度上升并在种子成熟时下降至最低[22],可溶性蛋白和脂肪酸等呈上升趋势[20-21]。被子植物中,单子叶植物营养物质主要贮存在胚乳中,双子叶植物营养物质主要贮存在子叶中,而其营养物质的变化趋势与裸子植物基本一致[23]。这表明裸子植物在种子的发育进程及营养物质的贮存方式上存在差异。
3 裸子植物种子发育过程中的转录调控
转录组是指特定细胞或组织在特定阶段转录出来的所有RNA的总和,包括编码RNA和非编码RNA(non-coding RNA)[24-26]。转录组是基因组与蛋白质组之间生物信息传递的桥梁,可表示每个表达基因的转录水平。其反映的是特定条件下表达水平较高的基因,能有效推测未知基因的功能,揭示细胞及组织的分子组成及调控基因的作用机制。
转录因子是一群能与基因5′端上游特定序列特异性结合,从而保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子,是生物发育过程中重要的调控因子。研究表明,一些植物所特有的转录因子在种子以及胚胎的发育过程中起到非常重要的作用(图 1),如 SPL (SQUAMOSA promoter-binding proteinlike)是由80个氨基酸残基组成的一个高度保守的SPB结构区域,结合下游的靶基因,从而调控靶基因的表达。它可以参与到植株的形态建成、发育阶段的形成、孢子发生、花和果实发育、外界胁迫应答以及激素信号转导等多个生理生化过程[27]。研究发现,拟南芥中过表达SPL10或SPL11可引发DCL1突变体表型,而DCL1功能缺失可导致胚柄细胞和分生组织的增殖,由此可见,SPL主要是在早期胚胎发育中发挥作用[28]。此外,Colombo等在拟南芥的研究中还发现,Ⅰ型的MADS-box 基因AGL23可以通过控制器官的生物合成从而来调控雌配子和胚胎的形成过程[29]。在此后的研究中又发现,AGL61在雌配子体的中央细胞表达水平较高,其蛋白靶向极核及中央细胞的次生核。在拟南芥胚胎中插入AGL61等位基因片段发现雌配子体中没有表达,这说明I型MADS-box 基因AGAMOUSLIKE61(AGL61)也与胚囊形成及种子发育相关[30]。然而,从植物系统发育的观点来看,种子的形成本质是高等植物胚胎发育的后期嵌入一个成熟阶段所引起的。有些转录因子在植物基因组发展成一个超家族,由此它们相互之间形成一个调控网络,从而调节种子成熟发育的过程。比如,B 3类转录因子是含有一个能编码110个氨基酸组成的蛋白质结构域,结合特异性DNA调控植物的生长发育过程;它是一种广泛存在于高等植物基因组中的超家族,包括:LAV家族、ARF家族、RAV家族和REM家族。其中,在AFL亚家族成员中,AB13、FUS3和LEC2被认为是调控种子成熟发育的主要转录因子[31-33],拟南芥胚胎中发现大量表达的ABI3、FUS3和LEC2,研究发现,这些转录因子的表达源于胚胎的表皮原且在野生型胚胎中发现有FUS3因子的表达。但是,相对于被子植物而言,由于裸子植物基因组非常庞大,并且仍存在许多重复基因,因此到目前为止还没有可以被利用的裸子植物全基因组数据库,仅有火炬松、挪威云杉、红杉、扭叶松等完成了全基因组的测序,而裸子植物数据及信息却对我们研究种子转录调控是必不可缺少的。对裸子植物EST数据库进行搜索,发现两条分别与拟南芥AB13和FUS3较为相似的EST序列在银杏EST数据库中存在[34]。另外,有的研究结果证实了至少有2个类群(银杏纲和松杉纲)在裸子植物中都存在AFL亚家族成员AB13和FUS3,这也再次证明了AB13是所有维管植物共同的基因,而FUS3是随着裸子植物分化产生的,是种子成熟发育重要转录调控因子。这些研究都表明,转录因子对裸子植物种子发育过程中起到重要调控作用。
4 关键miRNA在裸子植物种子发育过程中的作用
MicroRNA(miRNA)是一类长度为20~25nt的内源性非编码单链小分子RNA,其基因以单拷贝、多拷贝或基因簇等多种形式存在于基因组中,并通过与特定mRNA结合或抑制特定mRNA的蛋白质翻译,最终达到抑制特定基因表达的目的[35]。miRNA主要通过信号转导(脱落酸、生长素等)、抗氧化、糖转化、细胞生长等作用及途径来调控种子的发育过程[36]。目前在油菜[37]、水稻[38]、小麦[39]、玉米[40]等主要的被子植物中都鉴定出与种子发育相关的miRNA,如miR 156、miR 159、miR 167、miR 408等。此外,研究还发现,MYB33和MYB101转录因子可调控脱落酸(ABA)的含量及其表达水平[41],从而引起种子的休眠与成熟,而MYB33和MYB101转录因子都是miR 159的靶基因[42-43]。ARF 是生长素响应因子,也是生长素信号转导通路的重要组分,可通过生长素信号转导途径,从而参与种子形态形成、细胞分裂等过程[44],如在拟南芥、水稻、玉米中都已鉴定出 ARF 6和ARF 8都为 miR 167 的靶基 因[40,45-46]。研究 还发现,miR 156靶向SPL10和SPL11基因,能够导致不正常的细胞分裂[28],调控种子的发育过程[47-48]。这些研究都表明,miRNA在种子的发育过程中发挥着关键作用(图1)。
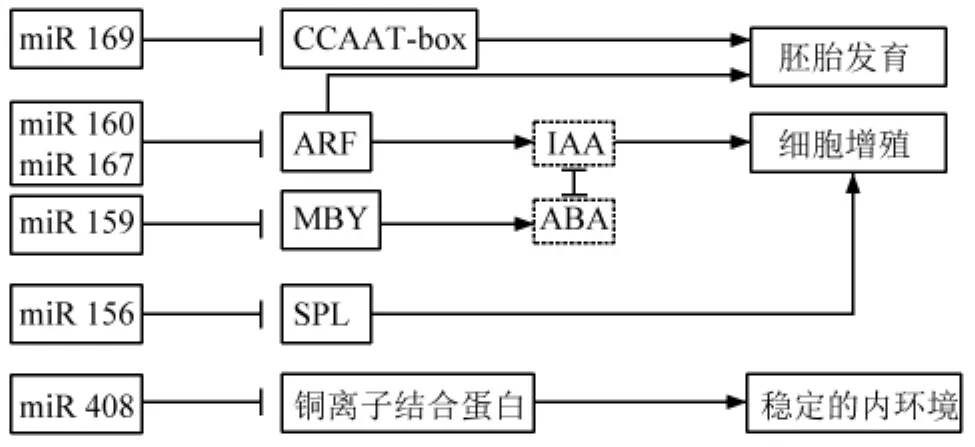
图1 种子发育过程中miRNA的作用
miRNA不仅可以调控种子的发育过程,还为种子发育提供稳定的内环境。比如,铜超氧化物歧化酶能特异地清除自由基,维持氧自由基的平衡[49],而研究发现,miR 408的保守靶基因是铜离子结合蛋白及漆酶[50],植物miR 408可通过调节铜离子的浓度和催化氧化作用,为种子的发育提供了一个稳定的内环境。研究表明,miRNA还可调控胚胎发育,如HAP转录因子可与CCAAT-box结合控制基因的表达,从而在植物胚胎发育、叶绿素合成等方面发挥重要作用[51],这已 在 玉 米[52]、水 稻[53]、小 麦[54]中 得 到 了 证 实;而miR 169则通过靶基因CCAAT-box转录因子参与胚胎发育过程[39,55]。此外,Mallory等在拟南芥中发现miR 164表达量突变会引起胚胎、营养器官及花器官的败育[56];miRNA合成过程中功能基因的突变也会影响胚胎发育,如功能基因DCL 1的突变可减少成熟miRNA的产量,最终出现胚胎发育停滞[57]。这些研究都表明,miRNA不仅可以通过调控靶基因影响种子发育及胚胎发育,其自身也对胚胎发育有重要的调控作用。裸子植物中也鉴定了相关miRNA的存在,如吴涛[58]对日本落叶松5个时期的种胚miRNA测序,而后作qRT-PCR验证,分析不同发育阶段种胚的miRNA相对表达量,发现29个miRNA的表达水平会随着发育过程呈现出一定的变化趋势,如miR 159、miR 166等逐渐升高;miR 172、miR 408等逐渐降低;miR 156、miR 167等则变化较平缓,说明这些 miRNA有可能也参与了落叶松种子发育过程。万里川研究比较杉木种子、幼苗、叶和茎中miRNA的表达情况,发现miR 156和miR 157在种子中高表达,但在茎和叶中表达量很低;而 miR 408、miR 165在4个样品中表达水平都比较高。这些研究证实了miRNA参与了裸子植物种子的发育,但因为裸子植物和被子植物在种子的结构和发育进程上具有显著不同,所以要真正弄清楚miRNA是如何调控裸子植物种子发育进程的,还需要进一步验证这些miRNA的功能和作用机制。
5 DNA甲基化及其它基因在裸子植物种子发育过程中的功能
DNA甲基化(DNA methylation)在生物界普遍存在,是一种重要的表观遗传修饰形式,是指DNA复制后,在甲基转移酶(DNA methyltrans-ferase,DNMT)的催化下,以S-腺苷甲硫氨酸(S-ade-nosylmethionine,SAM)为甲基供体,将甲基转移到特定的碱基上;甲基化在植物基因组防御、调控基因表达及控制植物生长发育中起重要作用[59-60]。DNA甲基化主要参与转录、复制、DNA修复、转基因和细胞分化等遗传功能的调控,在配子体发育、种子发育等方面也有重要作用[61-62](图2)。此外,Jullien等在对拟南芥的 DNA 甲基化动态变化研究时发现,在雌配子发生过程中,维持甲基化方式几乎不发生,而受精后在胚胎中从头甲基化与维持甲基化明显发生,并且维持一定甲基化水平直到成株[63]。同样是对拟南芥的DNA甲基化,Xiao等[60]研究却发现,在拟南芥中MET基因对CpG位点的DNA甲基化修饰会导致胚中不能形成正常的生长素浓度梯度,从而使得胚的特异基因表达异常,影响胚胎发育,并在胡萝卜[64]、玉米[65]等植物中得到证实。另外在水稻种胚中也发现了高度甲基化的基因,而胚乳基因甲基化水平相对较低,这说明DNA甲基化对水稻种胚的发育具有调控作用,对胚乳调控作用不明显[66]。这些研究表明,DNA甲基化可调控被子植物种子的发育,同样有研究发现DNA甲基化对裸子植物种子发育的影响。对落叶松体细胞胚胎采用MSAP方法研究,发现其发育过程中甲基化水平变化多样,早期阶段DNA甲基化水平变化较为复杂,而后期变化较简单,这说明胚胎发育过程中有DNA甲基化参与调控。同时,Fraga等[67]提取4年生和15年生松针种子的DNA,量化后进行高效毛细管电泳和可见光谱检测,通过核苷的检测和特异性DNA的量化发现DNA甲基化水平可能与辐射松种子的形态建成相关,并且DNA甲基化水平会随着种子的发育呈上升趋势,进而验证了DNA甲基化对裸子植物种子发育具有重要作用,但是其作用原理还有待进一步研究。
另外,还有一些基因在种子的发育过程中发挥作用,主要包括胚和胚乳的发育。如Grebe等研究发现,拟南芥中GNOM基因主要可编码鸟嘌呤核苷酸交换因子(GEF),作用于 ADP核糖基化因子(ARF)-G型蛋白,调控受精卵分裂成一个顶细胞核一个基细胞,从而参与胚的发育[68];而Liu等在研究拟南芥时则发现,RING-H 2族RHFla和RHF2a两种E 3连接酶通过调控形成配子体的有丝分裂退化过程来参与胚的发育[69];此外,Sabelli等[70]在拟南芥胚珠中只发现了一种RBR基因;而Jaana等研究发现,虽然欧洲赤松中的RBR基因较少,但其在成熟胚胎中表达量明显高于早期胚胎,并且都发现了ATG5基因的存在[71]。这些研究表明,有很多基因参与种胚发育的调控,同样胚乳发育过程也需要基因的参与调控,如在玉米胚乳中发现一些编码小蛋白质的Esr(embryo surrounding region)基因[72],Tanaka等发现,编码类枯草杆菌蛋白酶的ALE1(abnormal leaf shape 1)基因在胚和紧接胚的胚乳中均有表达,进而猜测其可能参与胚和胚乳接触面的表皮的形成[73]。然而,裸子植物的研究较少,刘缙[74]将银杏种仁研磨并用缓冲液作一系列处理后透析纯化出抗真菌蛋白Gnk2-1,进而作抗菌蛋白基因克隆与序列分析鉴定出Gnk2基因。这些研究都表明,不管是胚或胚乳的发育,都有基因参与调控(图2),并且调控胚和胚乳发育的基因并不相同。
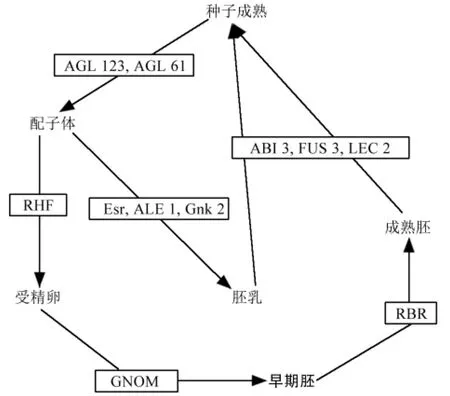
图2 种子发育过程中转录因子及基因的作用
6 展 望
植物胚胎发育过程的调控机制一直是人们关注的热点之一,而不同发育阶段的胚和胚乳的结构特征、发育过程中的生理生化过程、转录因子及miRNA调控机制、DNA甲基化水平和其他基因等方面都存在差异。对于被子植物模式植物种子发育过程中的分子生物学研究较深入,而对裸子植物种子发育的研究还很缓慢,这主要是因为裸子植物起步较晚,绝大部分裸子植物缺乏参考基因组信息,许多调控机制无法深入研究。因此,还需加采用新的技术方法,从转录组、miRNA、DNA甲基化等方面对裸子植物种子发育进行深入研究,以揭示裸子植物种子发育的分子调控机制。
[1]李新华.裸子植物的种子是否都是裸露的[J].生物学通报,2005,40(8):25.
[2]Maarten JM Christenhusz,James L Reveal,Aljos Farjon,et al.A new classification and linear sequence of extant gymnosperms[J].Phytotaxa,2011,19,55-70.
[3]滕俊琳,翟中和.银杏精子细胞生毛体及其它细胞器的超微结构[J].植物学报,1996,38(6):421-425.
[4]戴绍军.蕨类植物孢子与种子植物花粉萌发的比较[J].植物学通报,2008,25(2):140.
[5]马骥,李新荣,张景光,等.我国种子微形态结构研究进展[J].浙江师范大学学报(自然科学版),2005,28(2):122.
[6]王自芬.被子植物胚珠研究进展[J].植物学通报,2007,24(1):49-69.
[7]邓华,贾桂霞.裸子植物有性生殖过程中的细胞程序化死亡[J].西南林学院学报,2004,24(4):62-67.
[8]Kelley D,Gasser C.Ovule development:genetic trends and evolutionary considerations[J].Sex Plant Reprod,2009,22:229-234.
[9]Shi D Q,Yang W C.Ovule development in Arabidopsis:progress and challenge[J].Plant Biology,2011,14:74-80.
[10]Chehregani A,Mohsenzadeh F,Tanaomi N,et al.Comparative study of gametophyte development in the some species of the genus Onobrychis:Systematic significance of gametophyte futures[J].Biologia,2011,66(2):229-237.
[11]徐涛,王跃华,司马永康,等.厚皮香大孢子发生与雌配子体形成[J].云南大学学报(自然科学版),2005,27(3):261-266.
[12]曹玉芳,许方,姚敦义,等.松杉类植物雌雄配子体的发育与胚胎发生[J].莱阳农学院学报,1995,12(3):206-212.
[13]张华新,李凤兰,沈熙环,等.油松无性系雌雄配子体的形成及胚胎发育[J].北京林业大学学报,1997,19(3):1-7.
[14]吴先军,李平,黄荣.攀枝花苏铁受精作用及胚胎发生的研究[J].四川大学学报,1999(6):150-157.
[15]吉成均,安尼瓦尔·买买提,方精云.银杏雌配子体的发育和受精作用的研究现状[J].西北植物学报,2003,23(1):158-163.
[16]Singly H.Embryology of gymnosperms[J].Gebruder Borntraeger.Berlin.Stuttgart,1978.
[17]张雪芹.买麻藤的胚胎学研究[C].湖南农业大学硕士论文,2004.
[18]Goldberg R,Paiva G,Yadegari R.Plant embryogenesis:zygote to seed[J].Science,1994,266(5 185):605-614.
[19]苏国锋.拟南芥的种子及胚胎发育[J].科技视界,2014:59.
[20]李莉.油松雌配子体及其蛋白泡发育的细胞学和特异蛋白研究[C].北京林业大学硕士论文,2007.
[21]赵振洲.马尾松种子发育过程元素及蛋白质组学特征[C].南京林业大学硕士论文,2009.
[22]秦祎婷,李雪,翟志席.东北红豆杉种子发育过程生理特性研究[J].东北农业大学学报,2014,45(11):10-11.
[23]陈在新,潘娟,江道菊.不同成熟期板栗品种(系)种子发育期主要营养物质与内源激素含量的动态变化[J].林业科学,2011,47(1):73-78.
[24]Wang Z,Gerstein M,Snyder M.RNA-Seq:a revolutionary tool for transeriptomics[J].Nature Reviews Genetics,2009,10(1):57-63.
[25]Costa V,Angelini C,Feis I D,et al.Uncovering the complexity of transeriptomes with RNA-Seq[J].Journal of Biomedicine and Biotechnology,2010:853 916-853 932.
[26]张春兰,秦孜娟,王桂芝,等.转录组与 RNA-Seq技术[J].生物技术通报,2012(12):51-55.
[27]Gou J Y,Felippes F,Liu C J,et al.Negative regulation of anthocyanin biosynthesis in Arabidopsis by a miR 156-targeted SPL transcription factor[J].Plant Cell,2011,23:1 512-1 522.
[28]Nodine M D,Bartel D P.MicroRNAs prevent precocious gene expression and enable pattern formation during plant embryogenesis[J].Cold Spring Harbor Laboratory Press,2015.
[29]Colombo M,Masiero S,Vanzulli S,et al.AGL 23,a type I MADS-box gene that controls female gametophyte and embryo development in Arabidopsis[J].The plant journal,2008,6:1 037-1 048.
[30]Bemer M,Wolters-Arts M,Grossniklaus U,et al.The MADS Domain Protein DIANA acts together with AGAMOUS-LIKE 80to specify the central cell in Arabidopsis ovules[J].The Plant Cell,2008,20:2 088-2 101.
[31]To A,Valon C,Savino G,et al.A network of local and redundant gene regulation governs Arabidopsis seed maturation[J].Plant cell,2006,18:1 642-1 651.
[32]Santos-Mendoza M,Dubreucq B,Baud S,et al.Deciphering gene regulatory networks that control seed development and maturation in Arabidopsis[J].Plant journal,2008,54:608-620.
[33]Verdier J,Thompson R D.Transcriptional regulation of storage protein synthesis during dicotyledon seed filling[J].Plant cell physiol,2008,49(9):1 263-1 271.
[34]李杨.种子发育相关B 3基因的起源和进化[C].复旦大学硕士论文,2011.
[35]Bartel D P.MicroRNAs:Genomics,biogenesis,mechanism and function[J].Cell,2004,116(2):281-297.
[36]龚淑敏,丁艳菲,朱诚.miRNA在植物种子发育过程中的作用[J].遗传,2015,37(6):554-560.
[37]Zhao Y T,Wang M,Fu S X,et al.Small RNA profiling in two brassica napus cultivars identifies microRNAs with oil production-and development-correlated expression and new small RNA classes[J].Plant Physiology,2012,158(2):813-823.
[38]Xue L J,Zhang J J,Xue H W,et al.Characterization and expression profiles of miRNAs in rice seeds[J].Nucleic Acids Research,2009,37(3):916-930.
[39]Han R,Jian C,Lv J Y,et al.Identification and characterization of microRNAs in the flag leaf and developing seed of wheat[J].BMC Genomics,2014,15:289.
[40]Kang M,Zhao Q,Zhu D Y,et al.Characterization of microRNAs expression during maize seed development[J].BMC Genomics,2012,13:360.
[41]Reyes J L,Chua N H.ABA induction of miR 159controls transcript levels of two MYB factors during Arabidopsisseed germination[J].Plant journal,2007,49(4):592-606.
[42]Finkelstein R,Reeves W,Ariizumi T,et al.Molecular aspects of seed dormancy[J].Annu Rev Plant Biol,2008,59:387-415.
[43]Li D T,Wang L W,Liu X,et al.Deep sequencing of maize small RNAs reveals a diverse set of microRNA in dry and imbibed seeds[J].Plos One,2013,8(1):e 55 107.
[44]Schruff M C,Spielman M,Tiwari S,et al.The auxin response factor 2gene of Arabidopsis links auxin signalling,cell division,and the size of seeds and other organs[J].Development,2006,133(2):251-261.
[45]Yang J H,Han S J,Yoon E K,et al.Evidence of an auxin signal pathway,microRNA 167-ARF 8-GH 3,and its response to exogenous auxin in cultured rice cells[J].Nucleic Acids Research,2006,34(6):1 892-1 899.
[46]Jones-Rhoades M W,Bartel D P.Computational identification of plant microRNAs and their targets,including a stress induced miRNA[J].Molecular Cell,2004,14(6):787-799.
[47]Palatnik J F,Allen E,Wu X,et al.Control of leaf morphogenesis by microRNAs[J].Nature,2003,425(6 955):257-263.
[48]Wang S,Wu K,Yuan Q,et al.Control of grain size,shape and quality by osSPL 16in rice[J].Nat Genet,2012,44(8):950-954.
[49]马圣运.os-miR 408的表达模式及其在水稻种子发育中的功能[C].浙江大学,2012.
[50]Sun G L.MicroRNAs and their diverse functions in plants[J].Plant Molecular Biology,2012,80(1):17-36.
[51]刘亚静.植物 HAP 3转录因子研究进展[J].生物技术通报,2011.
[52]Zhang S,Wong L,Meng L,et al.Similarity of expression patterns of knotted1and ZmLEC 1during somatic and zygotic embryogenesis in maize[J].Planta,2002,215(2):191-194.
[53]Kumimoto R W,Adam L,Hymus G L,et al.The Nuclear Factor Y subunits NF-YB 2and NF-YB 3play additive roles in the promotion of flowering by inductive long-day photoperiods in Arabidopsis[J].Planta,2008,228(5):709-723.
[54]Stephenson T J,Mclntyre C L,Collet C,et al.TaNF-YB 3is involved in the regulation of photosynthesis genes in Triticum aestivum[J].Funct Integr Genomics,2011,11(20):327-40.
[55]Siefers N,Dang K K,Kumimoto R W,et al.Tissue-specific expression patterns of Arabidopsis NF-Y transcription factors suggest potential for extensive combinatorial complexity[J].Plant Physiology,2009,149(2):625-641.
[56]Mallory A C,Dugas D V,Bartel D P,et al.MicroRNA regulation of NAC-domain targets is required for proper formation and separation of adjacent embryonic,vegetative,and floral organs[J].Current Biology:CB,2004,14(12):1 035.
[57]Abdel-Ghany S E,Pilon M.MicroRNA-mediated systemic down-regulation of copper protein expression in response to low copper availability in Arabidopsis[J].The Journal of Biological Chemistry,2008,283(23):15 932-15 945.
[58]吴涛.日本落叶松实生苗small RNA测序、microRNA鉴定及其目标基因差异表达分析[C].中国林业科学研究院博士论文,2011.
[59]Chan S W L,Henderson I R,Jacobsen S E,et al.Gardening the genome:DNA methylation in Arabidopsis thaliana[J].Nature Reviews Genetics,2005,6(5):351-360.
[60]Xiao W,Custard K D,Brown R C,et al.DNA methylation is critical for Arabidopsis embryogenesis and seed viability[J].Plant Cell,2006,18(4):805-814.
[61]Boyko A,Kovalchuk I.Epigenetic control of plant stress response[J].Environmental and Molecular Mutagen,2008,49:61-72.
[62]Chen X S,Zhou D X.Rice epigenomics and epigenetics:challenges and opportunities[J].Current Opinion in Plant Biology,2013,16:164-169.
[63]Jullien P E,Susaki D,Yelagandula R,et al.DNA Methylation Dynamics during Sexual Reproduction in Arabidopsis thaliana[J].Current Biology,2012,22:1 825-1 830.
[64]Yamamoto N,Kobayashi H,Togashi T,et al.Formation of embryogenic cell clumps from carrot epidermal cells is suppressed by 5-azacytidine,a DNA methylation inhibitor[J].Journal of plant physiology,2004,162:47-54.
[65]Sangare A,Lonsdale D,Weil J H,et al.Sequence analysis of the tRNATyr and tRNALys genes and evidence for the transcription of a chloroplast-like tRNAMet in maize mitochondria[J].Current Genetics,1989,16:195-201.
[66]Zemach A,Kim Y,Silva P,et al.Local DNA hypomethylation activates genes in rice endosperm[J].PNAS,2010,107(43):18 729-18 734.
[67]Fraga M F,Uriol E,Diego B,et al.High-performance capillary electrophoretic method for the quantification of 5-methyl 2′-deoxycytidine in genomic DNA:Application to plant,animal and human cancer tissues[J].Electrophoresis,2002,23:1 677-1 681.
[68]Grebe M,Gadea J,Steinmann T,et al.A conserved domain of the Arabidopsis GNOM protein mediates subunit interaction and cyclophilin 5binding[J].Plant Cell,2000,12:343-356.
[69]Liu J,Zhang Y,Qin G,et al.Targeted degradation of the cyclin-dependent kinase inhibitor ICK 4/KRP 6by RINGType E 3ligases is essential for mitotic cell cycle progression during Arabidopsis gametogenesis[J].The Plant Cell.2008,20:1 538-1 554.
[70]Sabelli P A,Larkins B A.Grasses like mammals Redundancy and compensatory regulation within the retinoblastoma protein family[J].Cell Cycle,2006,5(4):352-355.
[71]Jaana V,Suvi S,Johanna K,et al.Expression of catalase and retinoblastoma-related protein genes associates with cell death processesin Scots pine zygotic embryogenesis[J].BMC Plant Biology,2015,15:88.
[72]Bonello J F,Sandrine S L,Berne A,et al.Esr proteins are secreted by the cells of the embryo surrounding region[J].Journal of Experimental Botany,2002,53(374):1 559-1 568.
[73]Tanaka H,Onouchi H,Kondo M,et al.A subtilisin-like serine protease is required for epidermal surface formation in Arabidopsis embryos and juvenile plants[J].Development,2001,128:4 681-4 689.
[74]刘缙.银杏种仁抗菌蛋白基因工程研究及小麦胚乳特异启动子的鉴定与评估[C].西北农林科技大学博士论文,2010.
