大豆品种科丰14及其突变系的鉴定
2016-01-17张凯淅
张凯淅, 韩 俊, 王 程, 郭 蓓, 谢 皓
(北京农学院植物科学技术学院, 北京102206)
北农106、北农107和北农108是北京农学院大豆研究室以大豆品种科丰14为辐照亲本,利用60Co-γ射线辐照其干种子,从1株持绿型突变体中经系谱法选育而成的姊妹系,均具有叶片、果荚失绿延迟,成熟后种子为绿种皮和绿子叶等特征[1]。其中,北农106、北农107和北农108于2012年申报了品种权保护,北农106于2014年通过北京市农作物品种审定委员会审定。由于北农106、北农107和北农108来自同一亲本科丰14,农艺性状十分相似,因此,在品种的鉴别上有一定难度。
分子标记技术的发展,为品种鉴定提供了新的途径。SSR标记是目前品种鉴定上常用的技术,已在很多农作 物 上 应 用,例 如,大 豆[2]、玉 米[3]、水 稻[4]、棉花[5]、小麦[6]、洋葱[7]等。本试验利用传统的植物形态性状鉴定方法与SSR标记技术相结合,对科丰14及其突变系北农106、北农107和北农108进行鉴定,旨在为北农106、北农107和北农108种子的鉴别与品种权保护供技术支撑。
1 材料与方法
1.1 试验材料
科丰14、北农106、北农107和北农108的种子由北京农学院大豆研究室提供。
8 30对大豆SSR引物由北京鼎国昌盛生物技术有限公司合成,试验药品购自北京鼎国昌盛生物技术有限公司。
1.2 试验方法
1.2.1 形态性状鉴定
科丰14、北农106、北农107和北农108的种子夏播,种植于北京农学院试验田。每品种1小区,每小区3行,行长5m,株距0.1m。生长期间记载生育期、花色、叶形、生长习性等性状,成熟后每品种随机收获20株,调查植株和籽粒性状。
1.2.2 SSR分子标记鉴定
大豆幼苗期,每品种随机取10株幼嫩叶片,分别提取基因组DNA,等量DNA混合为品种SSR标记的DNA模版。DNA的提取采用CTAB法,PCR扩增采用10μL反应体系,8%聚丙烯酰胺非变性胶电泳,1%硝酸银水溶液银染,制干胶保存,根据标记的多态性统计结果。
2 结果与分析
2.1 科丰14及其突变系主要生物学性状比较
北农106、北农107和北农108为姊妹系,来自于同一个辐照亲本科丰14,因此,大部分生物学性状与科丰14相同,但是,也有部分性状有别于科丰14(表1)。例如,科丰14成熟后叶片变黄,籽粒呈黄种皮、黄子叶特征,北农106、北农107和北农108在成熟期具有持绿特点,种皮和子叶均为绿色。由于持绿,北农106、北农107和北农108的生育期普遍延长,同样的栽培条件下,植株的高度也有差异,百粒重也不尽相同。
在北农106、北农107和北农108姊妹系之间,除生育期、百粒重有差异外,植株的花色和种脐颜色也有变化。北农106和北农107为紫花,而北农108为白花与科丰14相同;北农106为褐色种脐,而北农107和北农108为浅褐色种脐与科丰14相同。这些性状的差别,为北农106、北农107和北农108以及科丰14的鉴定与鉴别提供了依据。但是,在种子阶段,北农106、北农107和北农108之间因籽粒颜色、粒型相同,难以鉴别。此外,虽然科丰14为黄种皮、黄子叶,但在苗期阶段与其突变系之间也存在差别不明显、容易混淆的问题。因此,建立分子水平的鉴定方法十分必要。

表1 北农106、北农107、北农108和科丰14主要生物学性状的比较
2.2 科丰14及其突变系SSR标记的多态性分析
为在分子水平鉴定科丰14及其突变系,采用SSR分子标记技术进行了多态性分析,试图挖掘不同品种间特异的SSR标记,作为鉴定依据。经利用分布在大豆遗传图谱上的830对SSR引物,对科丰14和其突变系北农106、北农107、北农108的基因组DNA进行PCR反应和产生的标记位点分析。分别发现科丰14有7对SSR引物产生的标记位点与北农106、北农107和北农108表现多态性;北农106有3对引物产生的标记位点与北农107、北农108和科丰14表现多态性;北农107有2对引物产生的标记位点与北农106、北农108和科丰14表现多态性;北农108有2对引物产生的标记位点与北农106、北农107和科丰14表现多态性。

图1 科丰14与北农106、北农107和北农108DNA SSR扩增产物多态性图谱
2.2.1 科丰14与北农106、北农107和北农108之间的多态性分析
对在科丰14与北农106、北农107和北农108之间有多态性扩增的7对SSR引物多次检测,结果表明,Satt 228、Sat_160、Sat_227、Sat_362、Satt 514、Sat_381和Satt 213共7对引物对科丰14扩增的产物分子量大小有别于对北农106、北农107和北农108产生的分子量(图1),其分别产生的特异带型Satt228_170bp、Sat_160_90bp、Sat_227_150bp、Sat_362_120bp、Satt514_150bp、Sat_381_200bp和Satt213_80bp能够在分子水平上从科丰14、北农106、北农107和北农108这4个品种中鉴别出科丰14。因此,上述7个引物所产生的带型,可作为鉴定科丰14的分子标记。
2.2.2 北农106与北农107、科丰14和北农108之间的多态性分析
对在北农106与北农107、北农108和科丰14之间有多态性扩增的 Satt 204、Sat_380和Satt 706共3对SSR引物多次检测,结果表明,这3个引物能够分别扩增出不同于北农107、北农108和科丰14的特异带型(图2),其标记Satt204_105bp、Sat_380_150bp和 Satt706_160bp,可以作为鉴定北农106分子标记。
2.2.3 北农107与科丰14、北农106和北农108之间的多态性分析
利用BE 475343和Sat_211引物对北农107与北农106、北农108和科丰14的DNA多次扩增,结果表明,分别产
生的分子标记BE475343_100bp和Sat_211_110bp具有北农107的特异性(图3),可分别作为北农107的鉴定标记。
2.2.4 北农108与科丰14、北农106和北农107之间的多态性分析
同理,经多次重复检测,Satt 367和Satt 373引物在北农108的DNA中产生的Satt367_130bp和Satt373_160bp标记(图4),为北农108的特异标记,可作为鉴别北农108的SSR分子标记。
2.3 SSR标记在大豆连锁群位点的分析
通过对830对SSR引物的筛选,发现14对引物能够在科丰14、北农106、北农107和北农108的DNA中扩增出多态性。由于北农106、北农107和北农108为突变姊妹系,衍生于辐照亲本科丰14,因此,通过对连锁图谱上SSR位点的分析,能够进一步推断亲子间、姊妹间发生变异位点的多寡与染色体的位置。表2是利用 NCBI(http://www.ncbi.nlm.nih.gov/)检索,获得的上述14对引物在大豆连锁群上的位置。从表2可以看出,在大豆20个连锁群中,科丰14与突变系之间产生的7个位点的SSR标记,涉及5个连锁群,表明60Co-γ射线辐照科丰14后,至少在5条染色体的DNA序列发生了变异,导致北农106等突变系的产生;突变系北农106与北农107、北农108之间有3个位点特异标记,涉及1个连锁群,表明北农106至少有1条染色体DNA序列与北农107、北农108的序列有差异;同理,北农107与北农106、北农108之间至少有1条染色体DNA序列不同;北农108与北农106、北农107之间至少有2条染色体DNA序列有别。
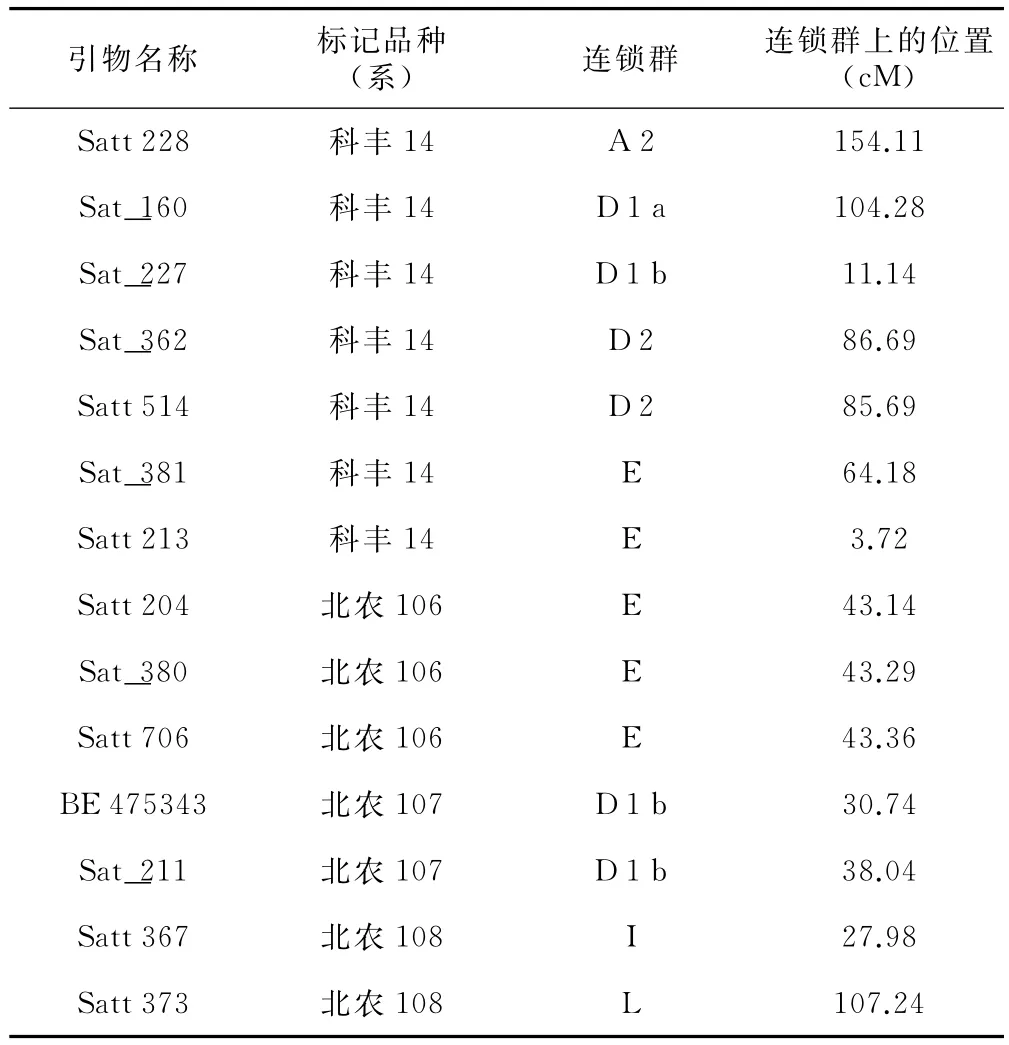
表2 SSR引物标记位点在大豆连锁群上的位置

图2 北农106与北农107、北农108和科丰14DNA SSR扩增产物多态性图谱

图3 北农107与、北农106北农108和科丰14DNA SSR扩增产物多态性图谱

注:A和B分别表示SSR引物Satt 367和Satt 373。
3 讨 论
辐照诱变是创制大豆新种质的重要手段之一,本试验供试材料中的北农106等突变系就是利用60Co-γ射线辐照诱变获得,与其辐照亲本科丰14相比,有部分生物学性状发生了变化,例如,种皮颜色、子叶颜色、成熟期持绿型及全生育期天数等,这些性状可以作为鉴别科丰14和北农106等突变系的形态标记。同时,由于科丰14辐照后变异幅度较大,导致形成北农106等突变系之间的部分性状也不相同,可以利用品系间的性状差异加以鉴别,例如,北农106生育期105d,株高60cm,紫花,种脐褐色;北农107生育期120d,株高75cm,紫花,种脐浅褐色;北农115生育期120d,株高80cm,白花,种脐褐色。
利用分子标记对品种进行真实性鉴定,具有较高的准确性和稳定性。因此,本试验尝试应用大豆SSR标记对科丰14及其突变系进行鉴定。结果发现,科丰14有7个SSR标记可用来区别突变系的种子;北农106有3个SSR标记可与北农107、北农108鉴别;北农107有2个SSR标记可以与北农106、北农108鉴别;北农108有2个SSR标记可与北农106、北农107鉴别。上述SSR标记能够用来鉴定科丰14及其突变系等品种。
据陈静等报道,60Co-γ射线辐照诱变可使得DNA分子多个区段内发生重复或缺失等结构性变异,呈现多个位点突变[8]。本试验发现的科丰14和突变系间的多个SSR标记位点,验证了上述结论,例如,科丰14有4个特异标记分别来自2条染色体,北农106的3个标记来自于1条染色体,北农107的2个标记也来自于1条染色体,特别是科丰14与其突变系特异的标记中,有2个标记来自同一染色体,但是位点相对距离较远(E-3.72,E-64.18),说明科丰14被辐射后,导致多条染色体DNA的多个区段发生了变异,进而产生了新的突变体。
[1]白红丹,薛树鹏,张娇,等.大豆科丰14持绿突变系的初步鉴定[J].植物遗传资源学报,2013,14(4):733-739.
[2]关荣霞,刘燕,刘章雄,等.利用SSR方法鉴定大豆品种纯度[J].分子植物育种,2003(3):357-360.
[3]王凤格,田红丽,赵久然,等.中国328个玉米品种(组合)SSR标记遗传多样性分析[J].中国农业科学,2014,47(5):856-864.
[4]陆徐忠,倪金龙,李莉,等.利用SSR分子指纹和商品信息构建水稻品种身份证[J].作物学报,2014,40(5):823-829.
[5]刘国栋,王芙蓉,宫永超,等.棉花品种遗传纯度的SSR分子标记鉴定技术研究[J].棉花学报,2013,25(5):382-387.
[6]YANG XinQuan,LIU Peng,HAN ZongFu,et al.Comparative Analysis of Genetic Diversity Revealed in Wheat(Triticum asetivum L.)by Genom ic-SSR,EST-SSR and Pedigree[J].Acta Genetica Sinica,2005,32(4):406-416.
[7]Anandhan,S.,Mote,S.R.and Gopal,J.Evaluation of onion varietal identity using SSR markers[J].Seed Sci.& Technol.,2014,42:279-285.
[8]陈静,胡晓辉,苗华荣,等.60Co-γ射线辐照花生种子后代的SSR分析[J].华北农学报,2010,25(3):68-72.
