卒中:回眸2015
2016-01-17王拥军
王拥军
岁末的北京,天空少有的放晴了几日。印象里冬日的京城,总是灰蒙蒙的,给人枯藤老树昏鸦般的落寞感。可是随着天空变得湛蓝,我的心情也有了几分不同往日的舒畅。细想起来,距我第一次到北京,已经有三十几年的光阴了。这三十年间,太多的物是人非,潮起潮落,让人来不及细细琢磨,就被快节奏的生活湮没了。有多少人,我们再也没有了联系,有多少事情,我们再也没有来得及经历。回首我自己的半辈子,也是五味杂陈,真是需要静静地坐下来回味个半天,才能体会到这人生的酸甜苦辣咸。
正如今日,我就真的坐在家中的书房里,打算细细回忆一下这不忍惜别的2015年。我刻意没有开灯,只是打开电脑,让荧幕的光亮带给我一丝心安。在这略显昏暗的环境里,我静下心来,不理窗外的车水马龙,让思绪的长河在我的头脑中再流淌一次。
2015,对于整个脑血管病的大世界,都是极其重要的一年。由于众多脑血管病研究成果的发表,我们的医疗实践正在被改变。在这辞旧迎新的时刻,我们一一回顾下这些研究成果。
1 急性缺血性卒中血管内治疗:一个新时代的到来
缺血性卒中作为最主要的卒中类型,其治疗的探索一直没有停止过。1995年美国国家神经疾病和卒中研究院(National Institute of Neurological Disorders and Stroke,NINDS)研究发表以来[1],缺血性卒中的治疗进入了标准静脉溶栓时期,以非强化CT为指导的静脉组织型纤溶酶原激活物(tissue plasminogen activator,tPA)治疗成为这个时期的金标准治疗。为了推进静脉溶栓的高效开展,国际上开展了一系列行动,包括卒中中心建立、远程卒中系统(telestroke)、移动卒中单元(stroke emergency mobile unit,STEMO)等。
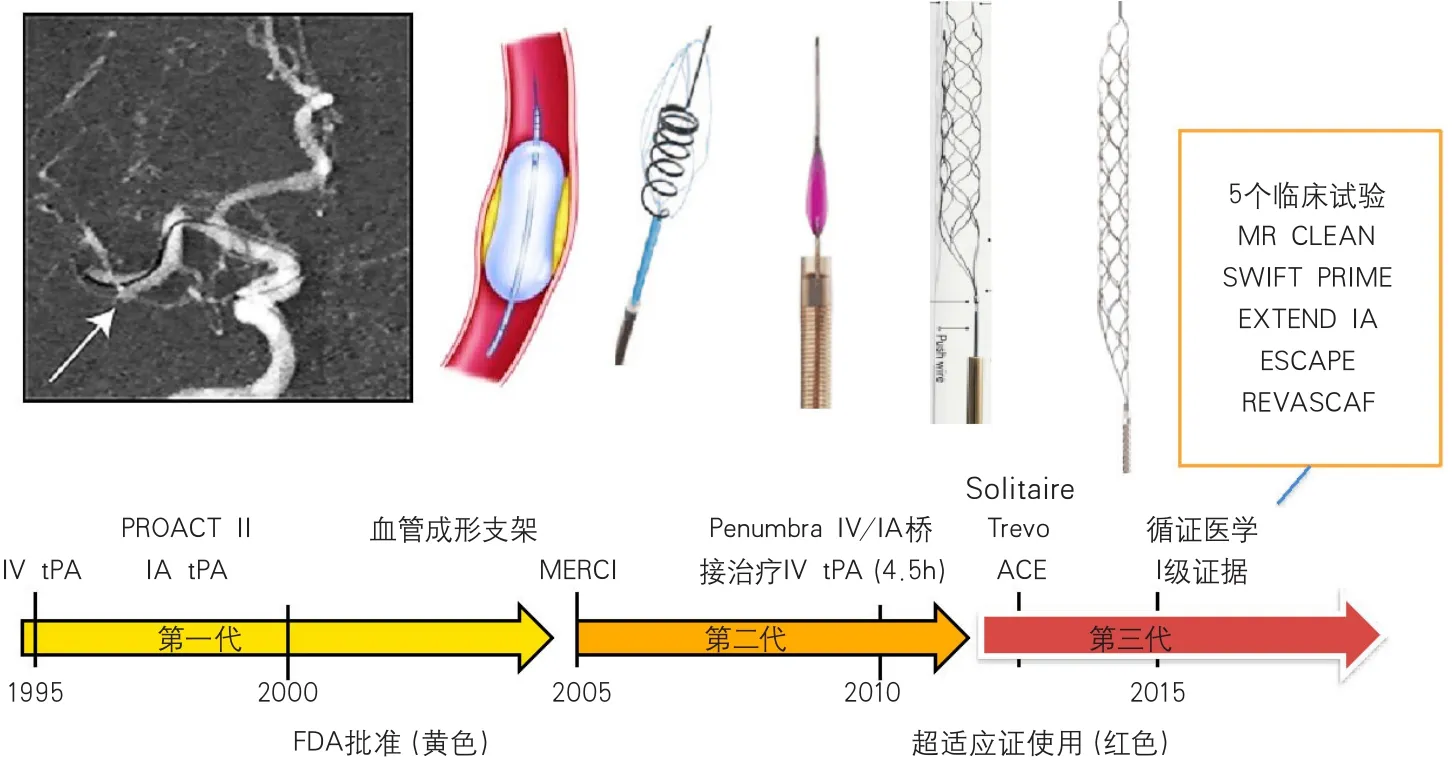
图1 急性缺血性卒中血管内治疗的历史演变

表1 2015年发表的5个血管内治疗临床试验
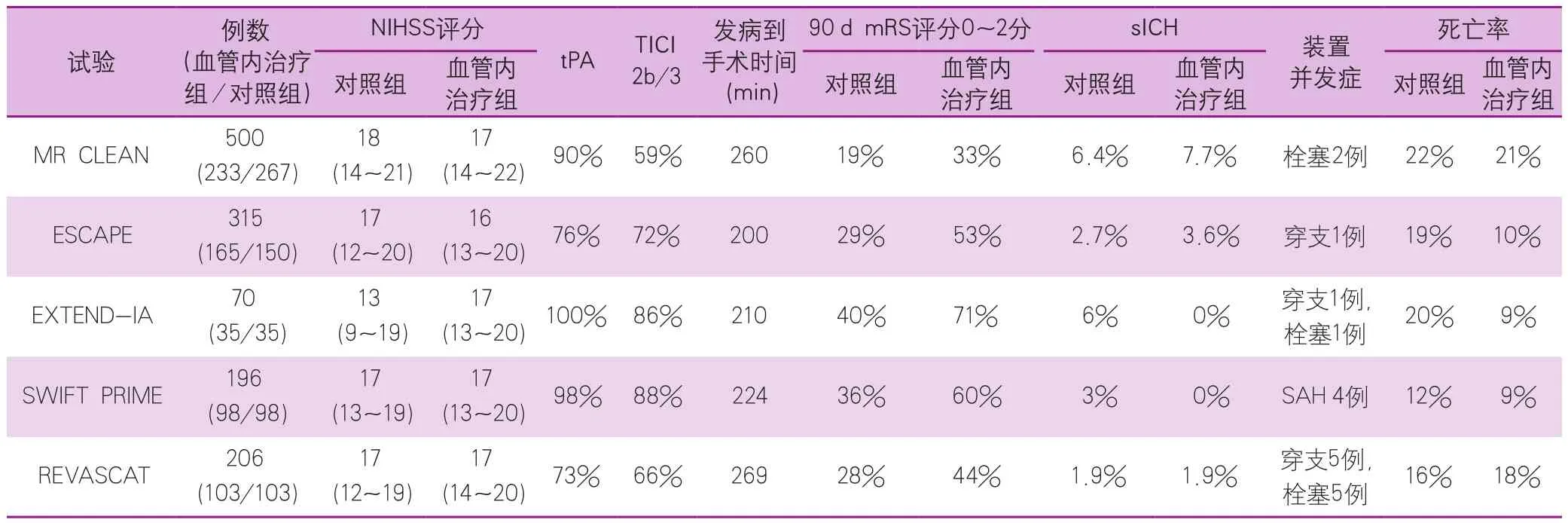
表2 5个血管内治疗临床试验的主要结果
从理论上讲,血管再通(尤其是大血管闭塞的再通)更为有效的手段是动脉内治疗,包括动脉溶栓、急诊支架和动脉取栓。但是动脉内治疗的循证医学研究的道路并不平坦。2013年,几项血管内治疗的研究表明,这类治疗对于缺血性卒中的治疗没有显示出应有的疗效,急性缺血性卒中血管内治疗进入黑暗时代。2015年,这项在黑暗中匍匐前进的治疗终于重见天日,5项大型临床试验几乎同时证实用可回收支架动脉内取栓对急性缺血性卒中治疗有效(图1,表1~2)。这5项试验包括急性缺血性卒中血管内治疗多中心随机对照临床试验(Multicenter Randomized CLinical trials of Endovascular treatment of Acute ischemic stroke in the Netherlands,MR CLEAN)[2]、tPA溶栓后支架取栓和单纯tPA溶栓治疗随机对照试验(SolitaireTMwith the Intention for Thrombectomy as Primary Endovascular Treatment for Acute Ischemic Stroke trial,SWIFT-PRIME)[3]、延长急性神经功能缺损至动脉内溶栓时间的临床研究(EXtending the time for Thrombolysis in Emergency Neurological Deficits with Intra-Arterial therapy,EXTEND-IA)[4]、前循环近端闭塞小病灶性卒中的血管内治疗并强调最短化CT至再通时间临床试验(Endovascular treatment for Small Core and Anterior circulation Proximal occlusion with Emphasis on minimizing CT to recanalization times trial,ESCAPE)[5]和8 h内支架取栓与最佳内科治疗随机对照研究(Revascularization with SOLITAIRE FR® DevicevsBest Medical Therapy in the Treatment of Acute Stroke due to Anterior Circulation Large Vessel Occlusion Presenting within Eight-hours of Symptom Onset,REVASCAT)[6]。对这5个临床试验的荟萃分析表明,早期血管内治疗可以大大改善急性缺血性卒中患者90 d功能预后[改良的Rankin量表(modified Rankin Scale,mRS)评分0~2分,OR2.43,95%CI1.91~3.09],同时不增加任何程度颅内出血和死亡的风险。
这些强有力的证据把急性缺血性卒中的治疗推向一个新的时代:从标准静脉溶栓治疗转变成静脉溶栓基础上的血管内治疗。各国指南迅速跟进,中国卒中学会、中国卒中学会神经介入分会、中华预防医学会卒中预防与控制专业委员会介入学组在当年7月出版了《急性缺血性卒中血管内治疗中国指南2015》[7]。之后美国缺血性卒中急性期治疗指南更新[8]。按照新的指南,急性缺血性卒中患者在静脉tPA治疗的基础上,满足下面条件,应该使用基于可回收支架的血管内取栓治疗:①卒中前mRS评分0~1分;②发病4.5 h的急性缺血性卒中按照指南接受静脉tPA治疗;③颈内动脉(internal carotid artery,ICA)或大脑中动脉(middle cerebral artery,MCA)近段(M1)病因性闭塞;④年龄≥18岁;⑤美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分≥6分;⑥Alberta卒中项目早期CT评分(Alberta Score Program Early CT Score,ASPECTS)≥6;⑦能在发病6 h内启动治疗。
2 急性缺血性卒中静脉溶栓治疗:新制剂、新人群、新证据
尽管动脉内取栓治疗开辟了缺血性卒中治疗的新时代,但是这个治疗仍然要以静脉溶栓为基础。目前获得循证医学证据的是静脉使用第一代tPA治疗。然而,溶栓剂已经改良过几次,新的溶栓药物不断涌现(表3),这些新型溶栓在缺血性卒中治疗中是否能显示优势,需要新的临床试验。

表3 tPA及其衍生物
2015年,英国格拉斯哥神经系统疾病研究院报道了使用第三代tPA——替奈普酶与阿替普酶治疗急性缺血性卒中的比较试验(Alteplase versus Tenecteplase for Thrombolysis after Ischaemic Stroke,ATTEST)结果[9]。这是一项采用随机、开放标签、盲法终点判定的临床Ⅱ期试验。选择发病4.5 h的缺血性卒中患者104例,随机给予替奈普酶(0.25 mg/kg,最大25 mg)和阿替普酶(0.9 mg/kg,最大90 mg)。两组入组患者都是52例。结果发现替奈普酶组和阿替普酶组神经功能(90 d mRS)和影像结局没有差异(图2),提示需要对替奈普酶在更大规模的急性缺血性卒中患者中进行效果评价。
对于轻型卒中需不需要溶栓治疗,目前仍没有定论,使用新一代溶栓制剂的研究更是缺乏证据。2015年,加拿大学者报道了使用替奈普酶治疗轻型卒中早期临床试验结果——替奈普酶对有明确血管闭塞的轻型卒中治疗试验(Tenecteplase Tissue-type Plasminogen Activator Evaluation for Minor Ischemic Stroke with Proven Occlusion,TEMPO-1)[10]。这项小规模临床试验共纳入50例轻型卒中患者,纳入标准主要包括:成人(年龄≥18岁)急性缺血性卒中,发病(最后正常时间)距离治疗时间<12 h,轻型卒中的诊断标准是基线NIHSS评分<6分,颅内动脉闭塞用无创血管检查[计算机断层扫描血管造影(computed tomography angiography,CTA)]发现MCA、大脑前动脉(anterior cerebral artery,ACA)、大脑后动脉(posterior cerebral artery,PCA)、椎动脉和基底动脉病变,并且与症状和体征相关,卒中前功能状态独立,改良Barthel指数(Barthel index,BI)≥90分,mRS评分0~1分,患者可以在完成CT或CTA后90 min内治疗。使用两个剂量的替奈普酶(0.1 mg/kg和0.25 mg/kg),发现大剂量有更好的效果,临床疗效和血管再通高度相关。TEMPO-1研究发现对于轻型卒中给予替奈普酶治疗是可行的、也是安全的。需要更大规模的临床试验,以证实这种治疗方法的效果。
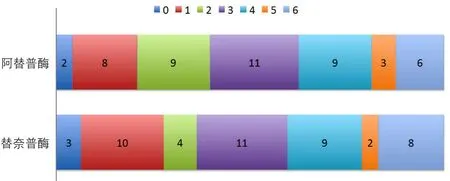
图2 ATTEST试验结果(90 d mRS评分)
除了tPA之外,其他溶栓药物也被陆续开发,其中用于缺血性卒中治疗研究较多的药物是去氨普酶(desmoteplase)。这个药物来自于吸血蝙蝠的唾液,具有极强的纤溶活性。2015年,由美国斯坦福大学牵头、联合全球17个国家或地区的77家中心完成评价去氨普酶的主要脑动脉闭塞或重度狭窄患者在缺血性卒中发作3~9 h给予去氨普酶的安全性和有效性试验(Safety and Efficacy of Desmoteplase Given 3~9 h after Ischaemic Stroke in Patients with Occlusion or High-grade Stenosis in Major Cerebral Arteries,DIAS-3)[11]。DIAS-3是前瞻性、双盲、多中心、平行组随机试验,旨在评价对发病3~9 h、伴有主要脑动脉闭塞或高度狭窄的急性缺血性卒中患者使用去氨普酶的效果。该研究共纳入患者492例,其中去氨普酶治疗组247例,安慰剂组245例。结果发现,对于有大动脉闭塞、发病时间超过3 h的缺血性卒中,使用去氨普酶没有安全问题,但是也不改善功能预后(图3)。
3 院前神经保护治疗:迷失在起跑线上
脑血管病的神经保护治疗一直是个理论上有效、但临床上难以证实的问题,在临床前研究向临床转化失败的众多原因中,用药过晚是一个重要理由。如何让患者尽早启用神经保护治疗,是很多中心不断探索的话题。其中,院前现场使用神经保护治疗,也就是在发现患者的现场使用神经保护剂是很好的出路。2015年,由美国加州大学洛杉矶分校牵头完成了院前使用硫酸镁对急性卒中患者的神经保护试验(Prehospital Use of Magnesium Sulfate as Neuroprotection in Acute Stroke,FASTMAG)[12]。
FAST-MAG是安慰剂对照、双盲、随机临床试验,在洛杉矶69家医院进行。共纳入急性卒中患者12 790例。该研究使用院前量表对患者进行诊断,诊断卒中之后立即静脉推注硫酸镁4 g,随后持续静脉滴注硫酸镁16 g维持24 h。所有患者在发病2 h内给药(一般患者在1 h内),主要终点是3个月的mRS。
FAST-MAG的研究发现,院前使用硫酸镁是安全的,可以在卒中发病2 h内使用,但是并不能改善患者的90 d预后(图4)。
4 临床前随机对照多中心试验:转化医学成功之桥
FAST-MAG是众多神经保护剂失败的范例之一,神经保护治疗的命运最终都是同样:动物实验有效,临床试验无效。临床前向临床转化出现了问题,这与其他药物研究的规律大相径庭。
临床试验一般采用多中心、随机、足够样本量(样本量计算)、第三方终点事件仲裁。而临床前的动物实验一般采用单中心、非随机、没有样本量计算、非独立终点实践判定。为了保证临床转化的顺畅性,很多专家呼吁应该基于随机对照临床试验,在临床前最后阶段实施随机对照临床前试验,也就是临床前试验(preclinical trial)。
按照这个新的理论框架,临床前研究也按临床一样进行分期,从机制研究、证实概念、单中心效果和毒性试验,到多中心、随机临床前试验(图5)。这个概念把临床前评价和临床评价逐渐趋同,开辟了神经保护治疗临床前研究的全新概念。
2015年,这种革命性的理念变成了现实,德国8个临床前评价中心合作,完成了抗CD49d特异性抗体治疗大鼠脑梗死的多中心、随机对照试验[13]。其中5个中心采用线栓模型,每个中心纳入45只缺血模型大鼠,共计225只大鼠。另外3个中心采用血栓栓塞模型,每个中心纳入30只缺血模型大鼠,共计90只大鼠。
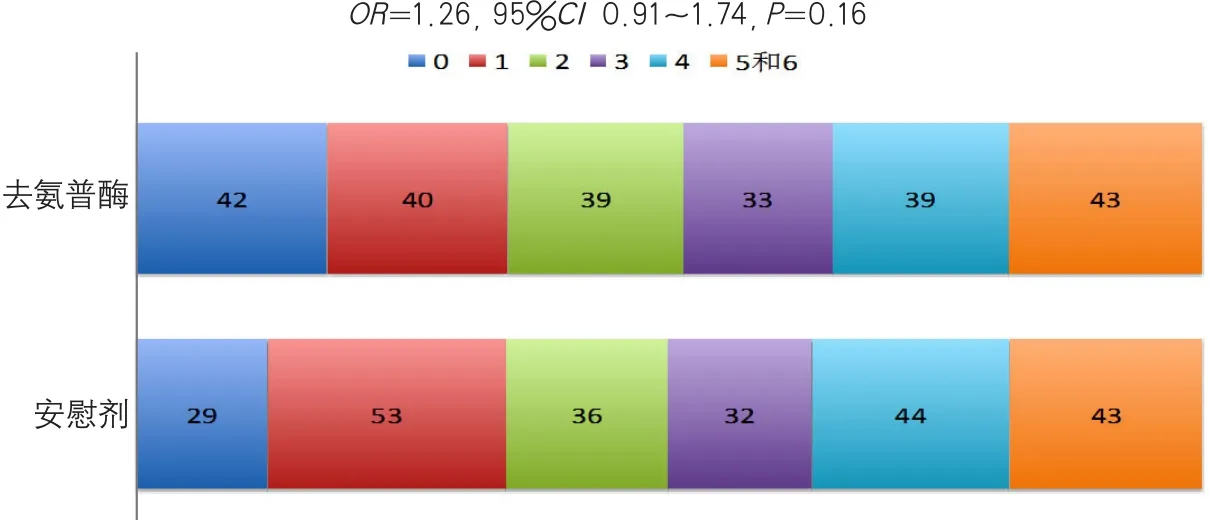
图3 DIAS-3的主要终点(mRS评分)
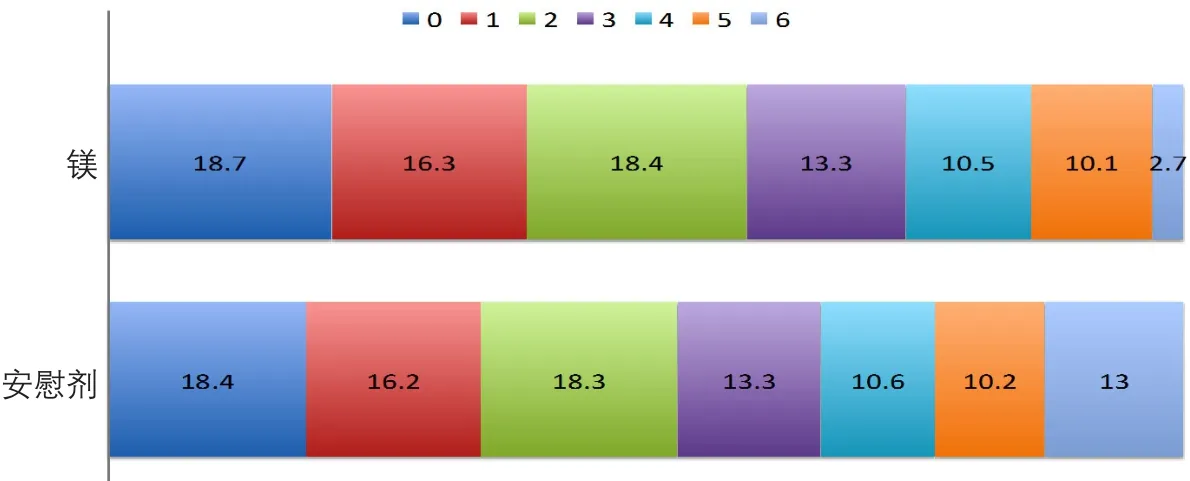
图4 FAST-MAG的主要终点(mRS评分)
多中心研究汇总表明,在引起小的皮质梗死的永久大脑中动脉远端闭塞的大鼠模型中,使用CD49d特异性抗体可以显著减少白细胞损害,缩小梗死面积。相比之下,使用引起大面积梗死的大脑中动脉近段闭塞的一过性闭塞模型中,抗CD49d治疗不减少梗死面积,也不影响白细胞浸润。这个研究结果证实免疫靶向治疗的获益依赖于梗死的严重性和部位。该研究同时支持实施临床前随机对照试验(preclinical randomized controlled trial,pRCT)的可行性。这项研究是临床前药物评价的里程碑,标志着临床前药效评价进入了一个全新的时代。
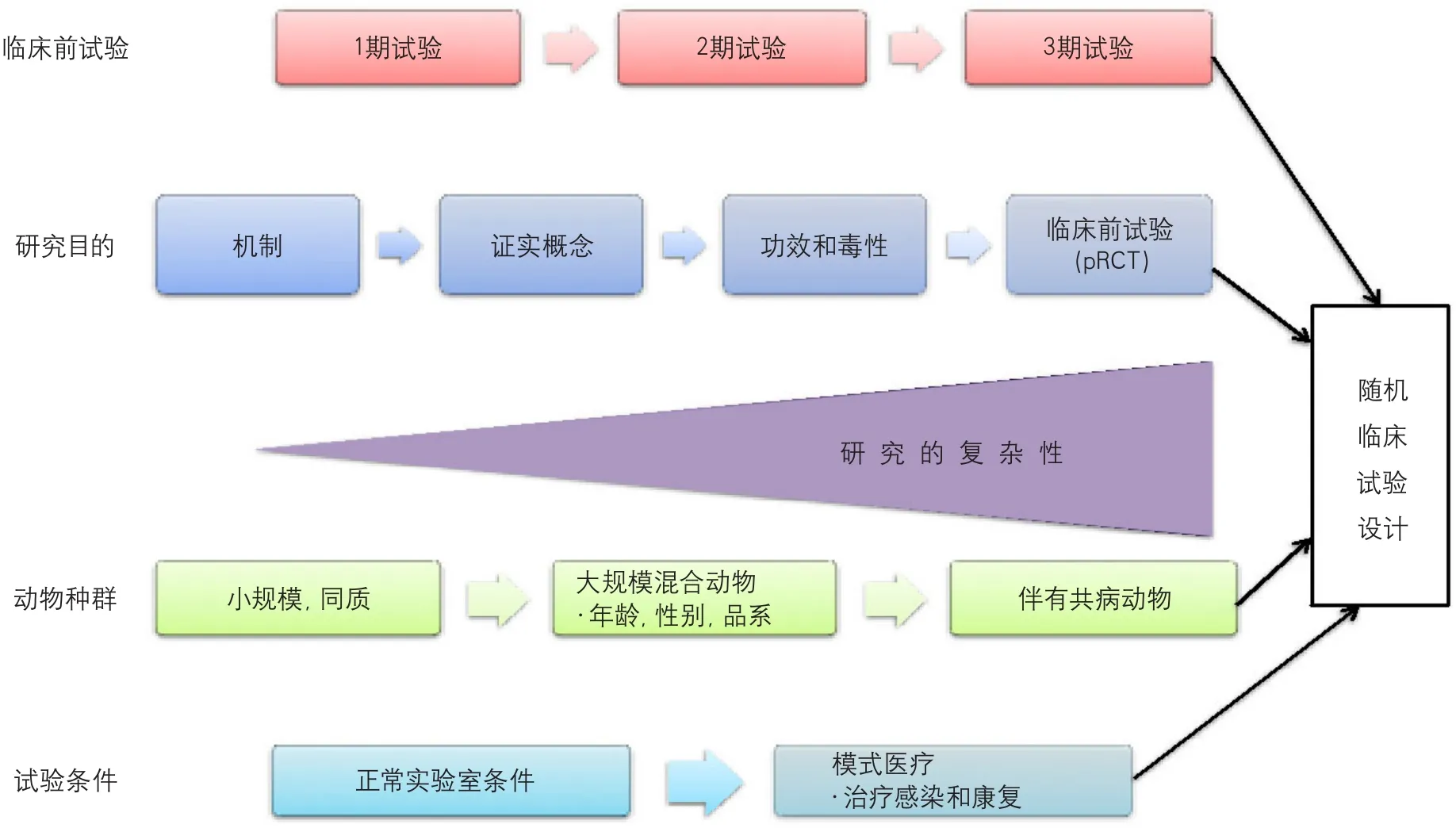
图5 神经保护治疗的临床前研究的分期
5 患者为中心的预后研究:迈向真实世界之路
循证医学时期最大遗产是随机对照试验(randomized controlled trial,RCT),它为临床指南的制订奠定了坚实的基础。但是,RCT给出的理想世界的场景让人质疑外推给真实世界的偏差。近年来,呼吁真实世界(real world)研究的呼声越来越高。人们试图从循证医学(evidence-based medicine,EBM)的思维模式转向基于医学实践的证据(medicine-based evidence,MBE)。已经开展了评价真实世界的比较效果研究(comparative effectiveness research,CER),为了规避评价费用的敏感性,人们开始探索新的真实世界评价方法。
2009年,经济刺激方案为CER提供了11亿美元的经费[大多数提供给美国医疗保健研究与质量局(Agency for Healthcare Research and Quality,AHRQ)和美国国立卫生研究院(National Institutes of Health,NIH)]。2010年,美国平价医疗法案(Affordable Care Act)创立了患者为中心的预后研究院(Patient-Centered Outcomes Research Institute,PCORI)(图6),开展患者为中心的预后研究(patient-centered outcomes research,PCOR),资金来自于政府税和覆盖年龄段的私人保险(每年5亿美元)。PCORI确定国家优先研究战略,制订基于优先战略的研究计划,开展与优先战略和计划一致的研究,目的是把有用的研究提供给患者和看护者。

图6 美国患者为中心的预后研究院
在PCORI的资助下,美国杜克大学临床研究院建立了脑血管病PCOR研究方法——脑血管病研究杜克(Patient-Centered Research into Outcomes Stroke Patients Prefer and Effectiveness Research,PROSPER),并于2015年报道了2项基于PROSPER的研究结果(图7)。
第一篇研究是真实世界中华法林使用对合并心房颤动的缺血性脑血管病预后的影响[14]。研究来自跟着指南走(Get With The Guideline,GWTG)数据库12 552例合并心房颤动患者,其中11 039例(88%)患者出院服用华法林,与出院2年医保数据库对接。发现服用法华林患者在家时间长于不用口服抗凝剂的患者(相差47.6 d,99%CI26.9~68.2 d),主要心血管事件降低(HR0.87,95%CI0.78~0.98)(图8),全因死亡降低(HR0.72,95%CI0.63~0.84),缺血性卒中复发降低(HR0.63,95%CI0.48~0.63)。真实世界的研究提示对于伴有心房颤动的卒中患者,使用华法林治疗能改善长期临床预后,并能增加在家时间。
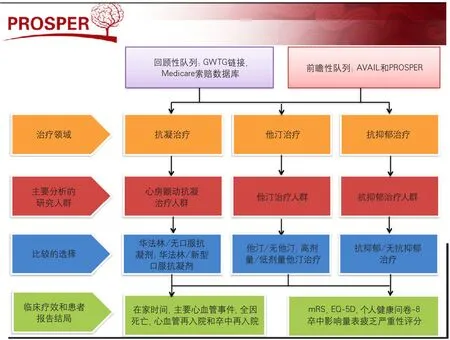
图7 PROSPER的人群和设计
另一篇基于PROSPER人群的PCOR研究是出院时服用他汀对2年结局的影响[15]。研究人群选用GWTG数据库中年龄≥65岁的患者,把这些人群与医疗保险赔付数据库关联。其中入院前没有服用他汀的患者77 468例,其中71%在出院时服用他汀。结果发现出院时服用他汀与主要不良心血管事件下降相关(HR0.91,95%CI0.87~0.94);服用他汀患者增加28 d在家生活的时间(P<0.001),降低全因死亡和再住院率。同时,他汀治疗不增加出血风险(HR0.94,95%CI0.72~1.23)。这些患者中,31%服用高强度他汀剂量,调整危险因素之后,其预后与中等强度他汀结局相似。结果提示,对于年长的入院时没有服用他汀的缺血性卒中患者,出院他汀治疗有更低的不良心血管事件,在出院2年期间延长几乎1个月的在家时间。
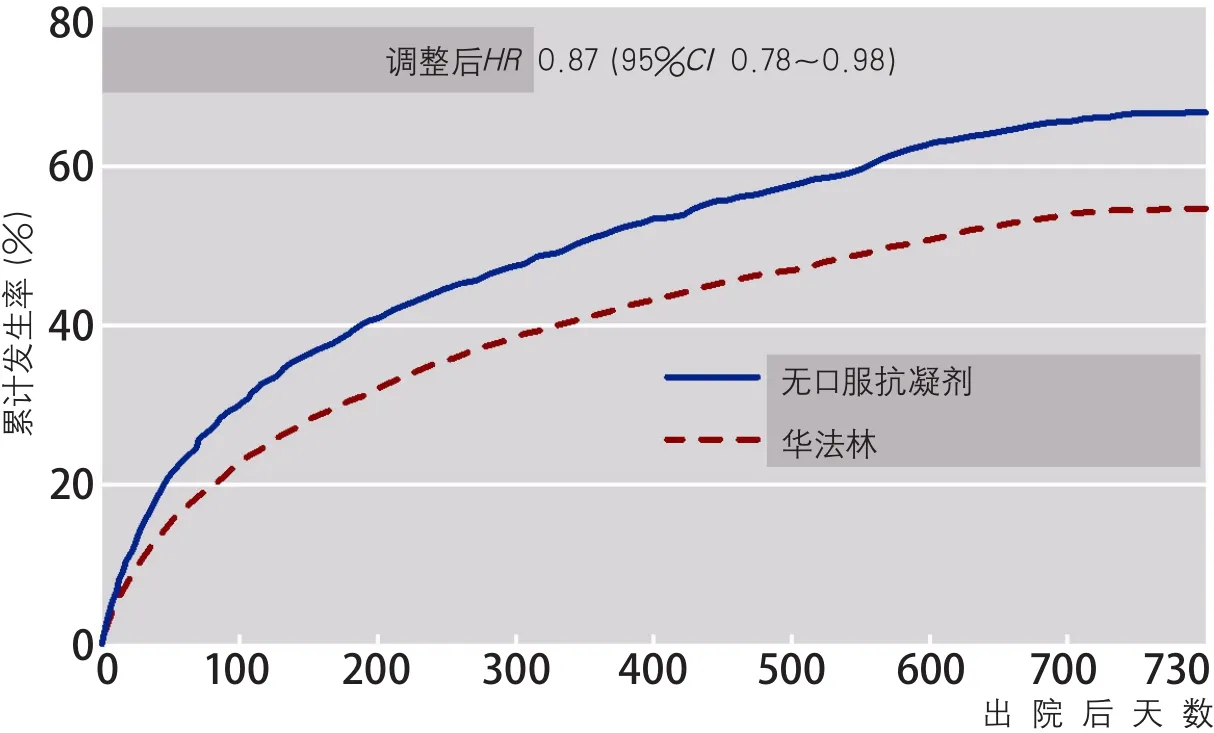
图8 华法林对心房颤动卒中患者心血管不良事件的影响
6 叶酸用于卒中一级预防:中国处方
卒中一级预防的策略是寻找和去除危险因素,其中最为重要的危险因素是高血压。对于没有心脑血管病病史的高血压患者,在降压治疗的同时,要不要追加叶酸治疗,尤其是在中国这样的低叶酸地区的人群中?这个问题一直没有得到解答。
2015年,在北京大学霍勇教授领导下,中国完成了降压叠加叶酸的中国卒中一级预防试验(China Stroke Primary Prevention Trial,CSPPT)[16]。这项研究共纳入20 702例成人高血压患者,对照组每天使用依那普利10 mg(n=10 354),治疗组在依那普利治疗的基础上,每天叠加0.8 mg叶酸。研究结果发现,叠加叶酸组比单纯降压治疗组首次卒中风险降低(HR0.79,95%CI0.68~0.93),缺血性卒中也显著降低(HR0.76,95%CI0.64~0.91),联合血管事件(包括心血管死亡、卒中和心肌梗死)在叠加叶酸治疗组也明显下降(HR0.80,95%CI0.69~0.92),而出血性卒中(HR0.93,95%CI0.65~1.34)、心肌梗死(HR1.04,95%CI0.60~1.82)和全因死亡(HR0.94,95%CI0.81~1.10)两组无显著性差异。两组的不良反应也没有显著差别。
该研究结果表明,对于没有卒中和心肌梗死病史的中国成人高血压患者,与单用依诺普利相比,联合依诺普利和叶酸可以显著降低首发卒中事件。这个发现与低叶酸地区的成人高血压使用叶酸的结论一致。这项基于中国研究开出的卒中一级预防处方对于我国高血压人群的管理至关重要,对于其他低叶酸国家的卒中防治也具有极为重要的借鉴价值。
7 颅内动脉狭窄的支架治疗:失望和希望并存
对于症状性颅内动脉狭窄患者是否需要基于支架的血管成形治疗,近几年一致争议不断。2011年完成的支架和强化内科治疗预防颅内动脉狭窄患者卒中复发的效果研究(Stenting and Aggressive Medical Management for Preventing Recurrent Stroke in Intracranial Stenosis,SUMMPRIS)给这一刚刚风靡世界的治疗方法当头一棒。该研究发现在积极内科治疗基础之上,加用血管内支架不但不增加疗效,相反会增加主要终点事件(卒中复发)的机会,支架治疗被打入冷宫。然而,介入医生一直没有放弃对这一治疗手段的探索。
2015年,27个中心完成了一项球囊扩张支架治疗症状性颅内动脉狭窄的临床试验——VISSIT支架治疗缺血性卒中研究(VISSIT Intracranial Stent Study for Ischemic Therapy,VISSIT)[17],这个原本设计纳入250例受试者的临床试验,由于SAMMPRIS的阴性结果,提前进行了数据分析,最终完成研究的患者有112例,其中使用球囊扩张支架59例,单独药物治疗53例。结果发现,支架组结果为阴性。主要安全性终点即30 d内卒中、死亡或脑出血,支架组为24%,药物治疗组为9%。支架组1年期间卒中及一过性脑缺血的比例为36%,最佳药物治疗组为15%。与药物治疗相比,症状性颅内动脉狭窄使用球囊扩张支架治疗使得12个月同一血管流域卒中和短暂性脑缺血发作(transient ischemic attack,TIA)事件增加,30 d卒中和TIA事件增加。这个发现不支持对于症状性颅内动脉狭窄患者使用球囊扩张式支架。
另一项来自荷兰的椎动脉支架研究(Vertebral Artery Stenting Trial,VAST)评价了来自颅内外椎动脉狭窄患者的支架治疗效果[18],本研究是Ⅱ期临床试验,为多中心、开放标签/盲法判定的随机对照研究。原计划纳入180例患者,由于无法满足监管机构的进一步要求,入组患者到115例后提前终止,最后支架组57例,药物组58例。VAST是目前唯一评估支架置入治疗症状性颅内外椎动脉狭窄≥50%患者的安全性和可行性的RCT研究。接受支架治疗的患者30 d围术期与血管相关的并发症率为5%,而单纯药物治疗者3年累积复发责任血管卒中率为7%。由于复发卒中率较低,因此,认为没有必要进一步开展评估支架治疗的Ⅲ期临床试验。
尽管所有的颅内动脉支架试验均以失败告终,但对希望的追求仍然没有完全放弃。过去失败的研究的入组标准全部是基于狭窄率的解剖学标准。质疑者指出,支架是解除血流的减少,尽管大多数患者血管狭窄的程度和血流下降幅度相关,但是由于不同人血流储备能力不同,有时血管狭窄并不一定引起血流下降。支架治疗应该依赖于血流量的下降,而不是狭窄的程度。2015年,美国芝加哥大学报告的TIA和卒中患者椎基底动脉血流动力学评估研究(Vertebrobasilar Flow Evaluation and Risk of Transient Ischemic Attack and Stroke,VIRiTAS)[19],用定量磁共振血管成像(magnetic resonance angiography,MRA)测定后循环血管狭窄患者血流量、狭窄率和结局(卒中复发)的关系。研究发现,狭窄性后循环血管的血流与残留管腔相关,在串联病变时血流量会戏剧性下降。但是病变的严重程度和部位不能很好预测远端血流状态,考虑有侧支循环能力的影响。这个研究再次阐明了血流和血管狭窄的理论关系(图9),同时为基于脑血流量的支架技术奠定了坚实的理论基础。
8 脑动脉夹层的药物治疗:抗凝还是抗血小板?
在缺血性脑血管病人群的二级预防中,脑动脉夹层是非常特殊的情况。一般临床医生认为动脉夹层最好的治疗药物是抗凝剂。但是对于动脉夹层药物治疗的比较缺乏随机对照研究。2015年,英国剑桥大学牵头完成了一项脑动脉夹层抗凝与抗血小板比较的随机对照试验(Antiplatelet treatment compared with anticoagulation treatment for cervical artery dissection,CADISS)[20]。
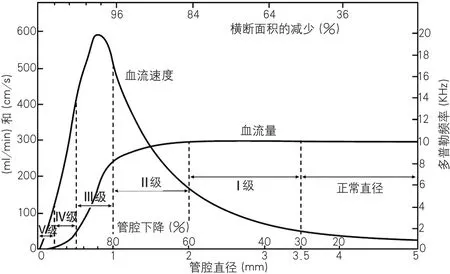
图9 血流和血管狭窄的理论关系
CADISS研究是一项多中心、随机、开放标签平行试验。纳入的患者为发病7 d以内的颅内颈动脉或椎动脉夹层的患者,随机分为抗血小板治疗组和抗凝治疗组。抗血小板治疗组根据当地医生的习惯选择抗血小板药物,比如阿司匹林、双嘧达莫、氯吡格雷或联合治疗。抗凝治疗组可以选择肝素(普通或低分子肝素),华法林[国际标准化比值(international normalized ratio,INR)2~3],不使用新型抗凝药物。
该研究共纳入了250例患者,其中颈动脉夹层118例,椎动脉夹层132例。发病到随机的平均时间为3.65 d。126例患者采取抗血小板治疗策略(22%阿司匹林,33%氯吡格雷,1%双嘧达莫,28%阿司匹林+氯吡格雷,16%阿司匹林+双嘧达莫),124例抗凝治疗。结果发现,250例患者中仅4例(2%)观察到卒中复发(全部为同侧)。两组间卒中或死亡发生率分别为2%和1%(OR0.335,95%CI0.006~4.233,P=0.63)。抗凝治疗组无死亡病例,发生1例严重出血。中心判读影像时发现52例患者不能确诊夹层。
CADISS研究提示,对于症状性颈动脉和椎动脉夹层,为了预防卒中和死亡,抗血小板治疗和抗凝治疗没有差别。但是两组卒中发生率很低,远低于已经报道的观察性研究,夹层的诊断在很多病例不能确诊,提示放射标准在日常实践中有问题。
9 缺血性脑血管病的心脏原因:越来越多的证据
由于新型口服抗凝剂的问世,对于心源性卒中的研究日益增多。其中阵发性心房颤动的识别是近年来研究的热点。目前已经报道过的心房颤动识别方法有很多,从随机心电图到长达数年记录的置入式心电记录,何种方式最符合卫生经济效果,目前仍不能确定。
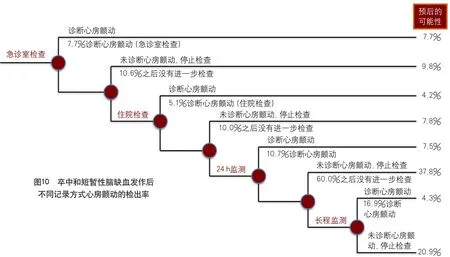
2015年,加拿大学者对既往报道的所有卒中和TIA后心房颤动识别的文献做了系统分析,找到了一些规律[21]。文献共复习了从1980年到2014年的全部研究,符合标准的研究50项,共包括28 290例患者。发现在急诊室首次心电记录发现心房颤动7.7%(95%CI5.0~10.8);之后住院期间心电记录发现心房颤动5.1%(95%CI3.8~6.5);如果采用20 h心电监测等心电记录发现心房颤动10.7%(95%CI5.6~17.2);如果再次动态心电,尤其是使用更长程的记录方式发现心房颤动16.9%(95%CI13.0~21.2)。卒中和TIA后总体心房颤动发生率为23.7%(95%CI17.2~31.0)(图10)。研究提示,用连续心脏监测方法,几乎1/4的卒中和TIA患者可发现新诊断心房颤动。卒中伴有心房颤动比例似乎比以前估计的高,相应的,更多的抗凝剂使用,可能更多的预防卒中复发。
除了心房颤动,其他心脏病变引起卒中的研究也日益增多。2015年,英国格拉斯哥大学利用两个慢性心功能衰竭队列研究了不伴有心房颤动的心功能衰竭患者发生卒中的相关因素[22]。这两个队列人群分别是心脏功能衰竭瑞舒伐他汀多国对照研究(Controlled Rosuvastatin in Multinational Trial Heart Failure,CORONA)和瑞舒伐他汀治疗慢性心力衰竭研究(Gruppo Italiano per lo Studio della Sopravvivenza nell’Insufficienza cardiaca-Heart Failure trial,GISSI-HF)。共包括心力衰竭患者9585例,其中不伴有心房颤动的患者6054例。研究结果显示,伴有心房颤动的患者卒中风险是4.7%,不伴心房颤动的患者卒中风险是3.4%,使用多因素分析,发现不伴有心房颤动心功能衰竭患者卒中风险预测因素包括年龄(每10岁)(HR1.34,95%CI1.18~1.63)、纽约心血管学会分级(HR1.60,95%CI1.21~2.12)、需胰岛素治疗的糖尿病(HR1.87,95%CI1.22~2.88)、体质指数(HR0.74,95%CI0.60~0.91)、既往卒中史(HR1.81,95%CI1.19~2.74)。研究提示,在没有心房颤动的心功能衰竭患者中,卒中高风险与人口特征和临床变量相关。
10 卒中的康复治疗:需要数据支撑力
康复是卒中治疗的有机组成部分,对于神经功能的恢复,康复比药物治疗更为重要。但是,相比起来,康复治疗的循证医学证据并不充分。
2015年,澳大利亚学者报道了卒中患者早期康复的临床试验——卒中发病24 h内超早期康复治疗的有效性和安全性试验(Efficacy and safety of very early mobilisation within 24 h of stroke onset,AVERT)[23]。该研究比较发病24 h早期强化康复和常规康复的效果,早期强化康复的措施包括3个关键要素:①在发病后24 h内开始;②注重坐姿、站立、步行活动(即起床);③较常规护理至少多3次起床活动。早期强化组患者开始活动的中位时间为卒中后18.5 h,常规治疗组为卒中后22.4 h,与常规治疗组的3次活动相比,早期强化组平均进行6.5次活动。早期强化组每天平均接受31 min的治疗,常规治疗组为10 min。早期康复活动组与常规护理组间在行走恢复方面未见差异,并且3个月总体功能结局良好(主要结局)的患者在干预组比例较低(校正OR0.73,95%CI0.59~0.90)(图11)。本研究是大多患者在24 h内活动的首个试验,本研究发现大强度的超早期活动减少3个月良好预后的机会,在大多数临床指南中,推荐早期运动,这一发现提示需要重新审视目前的指南。
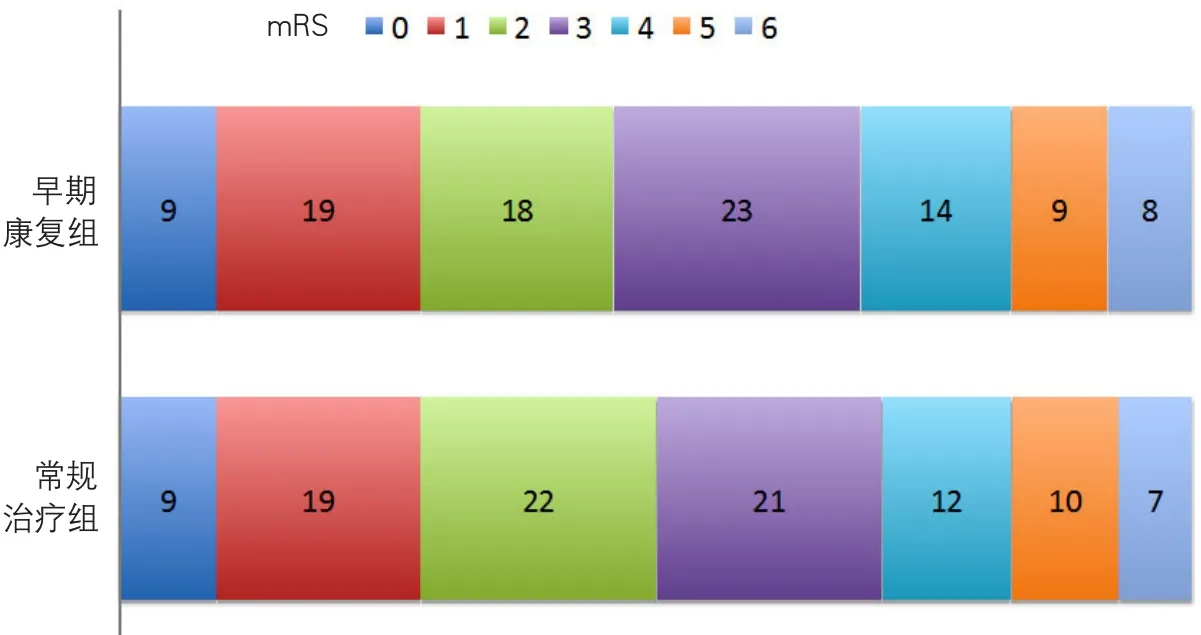
图11 AVERT试验3个月mRS评分
强迫限制运动被认为是康复简易、有效的措施,在任何环境都可以进行,尤其是居家生活。强迫限制运动是指限制健侧肢体运动,鼓励患侧肢体运动(图12)。2015年,德国完成了基于家庭生活的强迫限制运动试验(Homebased Constraint-induced Movement Therapy for Patients with Upper Limb Dysfunction after Stroke,HOMECIMT)[24]。共纳入卒中患者156例,其中85例采用强迫限制运动,71例为标准治疗。两组患者运动质量都有改善(动作活动日志-患手的动作品质评分),其中强迫限制运动组改善0.56(95%CI0.41~0.71,P<0.0001),标准治疗组改善0.31(95%CI0.15~0.46,P=0.0003)。强迫限制运动组改善程度优于标准治疗组,两组相差0.26(95%CI0.05~0.46,P=0.0156)。两组运动功能执行时间均有改善,其中强迫限制运动组缩短25.60%(95%CI-36.75~-12.49,P=0.0006),标准治疗组缩短27.52%(95%CI-38.94~-13.94,P=0.0004),两组改善程度无显著差别。该研究提示,基于家庭的强迫限制运动治疗比传统治疗增加受累上肢的运动质量,但是运动执行时间并无差别,需要进一步研究家庭强迫限制运动是否能获得临床改善,以及哪些患者最易获益。
回望2015,我们看到脑血管病治疗的巨大进步,急性缺血性卒中的治疗迈向一个新的时代。这是过去20年这个领域进步最快的一年,也是临床实践方式改变最大的一年。展望未来,脑血管病研究领域还会有更多的问题等待我们去回答。带着问题,带着责任,带着希望,我们迎接明天。
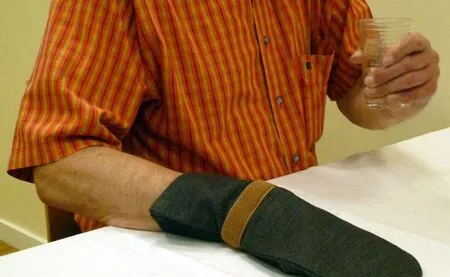
图12 强迫限制运动
1 The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke[J]. N Engl J Med,1995, 333:1581-1588.
2 Berkhemer OA, Fransen PS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke[J]. N Engl J Med, 2015, 372:11-20.
3 Saver JL, Goyal M, Bonafe A, et al. SWIFT PRIME Investigators. Stent-retriever thrombectomy after intravenous t-PAvst-PA alone in stroke[J]. N Engl J Med, 2015, 372:2285-2295.
4 Campbell BC, Mitchell PJ, Kleinig TJ, et al.Endovascular therapy for ischemic stroke with perfusion-imaging selection[J]. N Engl J Med, 2015,372:1009-1018.
5 Goyal M, Demchuk AM, Menon BK, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke[J]. N Engl J Med, 2015, 372:1019-1030.
6 Jovin TG, Chamorro A, Cobo E, et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke[J]. N Engl J Med, 2015, 372:2296-2306.
7 中国卒中学会, 中国卒中学会神经介入分会, 中华预防医学会卒中预防与控制专业委员会介入学组. 急性缺血性卒中血管内治疗中国指南2015[J]. 中国卒中杂志,2015, 10:590-606.
8 Powers WJ, Derdeyn CP, Biller J, et al. 2015 American Heart Association/American Stroke Association focused update of the 2013 guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke,2015, 46:3020-3035.
9 Huang X, Cheripelli BK, Lloyd SM, et al. Alteplase versus tenecteplase for thrombolysis after ischaemic stroke (ATTEST):a phase 2, randomised, openlabel, blinded endpoint study[J]. Lancet Neurol, 2015,14:368-376.
10 Coutts SB, Dubuc V, Mandzia J, et al. Tenecteplasetissue-type plasminogen activator evaluation for minor ischemic stroke with proven occlusion[J].Stroke, 2015, 46:769-774.
11 Albers GA, von Kummer R, Truelsen T, et al. Safety and efficacy of desmoteplase given 3-9h after ischaemic stroke in patients with occlusion or highgrade stenosis in major cerebral arteries (DIAS-3):a double-blind, randomised, placebo-controlled phase 3 trial[J]. Lancet Neurol, 2015, 14:575-584.
12 Saver JL, Starkman S, Eckstein M, et al. Prehospital use of magnesium sulfate as neuroprotection in acute stroke[J]. N Engl J Med, 2015, 372:528-536.
13 Llovera G, Hofmann K, Roth S, et al. Results of a preclinical randomized controlled multicenter trial (pRCT):Anti-CD49d treatment for acute brain ischemia[J]. Sci Transl Med, 2015, 7:1-10.
14 Ying Xian Y, Wu J, O’Brien EC, et al. Real world effectiveness of warfarin among ischemic stroke patients with atrial fibrillation:observational analysis from Patient-Centered Research into Outcomes Stroke Patients Prefer and Effectiveness Research(PROSPER) study[J]. BMJ, 2015, 351:h3786.
15 O’Brien EC, Greiner MA, Xian Y, et al. Clinical effectiveness of statin therapy after ischemic stroke:primary results from the statin therapeutic area of the Patient-Centered Research Into Outcomes Stroke Patients Prefer and Effectiveness Research(PROSPER) Study[J]. Circulation, 2015, 132:1404-1413.
16 Huo Y, Li J, Qin X, et al. Efficacy of folic acid therapy in primary prevention of stroke among adults with hypertension in China:the CSPPT randomized clinical trial[J]. JAMA, 2015, 313:1325-1335.
17 Zaidat OO, Fitzsimmons BF, Woodward BK, et al.Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis:the VISSIT randomized clinical trial[J]. JAMA, 2015, 313:1240-1248.
18 Compter A, van der Worp HB, Schonewille WJ, et al.for the VAST investigators. Stenting versus medical treatment in patients with symptomatic vertebral artery stenosis:a randomised open-label phase 2 trial[J]. Lancet Neurol, 2015, 14:606-614.
19 Amin-Hanjani S, Du X, Rose-Finnell L, et al. Hemodynamic features of symptomatic vertebrobasilar disease[J]. Stroke, 2015, 46:1850-1856.
20 CADISS trial investigators. Antiplatelet treatment compared with anticoagulation treatment for cervical artery dissection (CADISS): a randomised trial[J].Lancet Neurol, 2015, 14:361-367.
21 Sposato LA, Cipriano LE, Saposnik G, et al.Diagnosis of atrial fibrillation after stroke and transient ischaemic attack:a systematic review and meta-analysis[J]. Lancet Neurol, 2015, 14:377-387.
22 Abdul-Rahim AH, Perez AC, Fulton RL, et al. Risk of stroke in chronic heart failure patients without atrial fibrillation:Analysis of the Controlled Rosuvastatin in Multinational Trial Heart Failure (CORONA) and the Gruppo Italiano per lo Studio della Sopravvivenza nell'Insufficienza Cardiaca-Heart Failure (GISSI-HF)Trials[J]. Circulation, 2015, 131:1486-1494.
23 AVERT Trial Collaboration group. Efficacy and safety of very early mobilisation within 24h of stroke onset(AVERT):a randomised controlled trial[J]. Lancet,2015, 386:46-55.
24 Barzel A, Ketels G, Stark A, et al. Home-based constraint-induced movement therapy for patients with upper limb dysfunction after stroke (HOMECIMT):a cluster-randomised, controlled trial[J]. Lancet Neurol,2015, 14:893-902.
