莲蓬壳提取物不同极性部位的生物活性
2016-01-15何静,吴磊,李鹏霞等
莲蓬壳提取物不同极性部位的生物活性
何静1,2,吴磊2,李鹏霞3,胡卫成2,张闫闫2,刘帅2,刘恩雪2,尤龙2,王新风2,白羽嘉1,冯作山1
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052;2.淮阴师范学院/江苏省环洪泽湖生态农业生物技术重点实验室,江苏淮安223300;3.江苏省农业科学院农产品加工研究所,江苏南京210014)

摘要:为了确定莲蓬壳的生物活性物质,采用有机溶剂萃取法将莲蓬壳提取物分为正己烷相、二氯甲烷相、乙酸乙酯相、正丁醇相和水相5个不同极性部位,测定不同极性部位提取物中总黄酮及多酚含量,分析其还原能力及对过氧化氢、超氧阴离子自由基和DPPH自由基的清除能力,比较莲蓬壳提取物不同极性部位提取物的抗氧化作用。同时还考察了莲蓬壳不同极性部位提取物对乳腺癌细胞(MCF-7)的抑制作用。结果显示:莲蓬壳提取物的不同极性部位提取物均有抗氧化活性作用,其中乙酸乙酯部位提取物和正丁醇部位提取物抗氧化能力较强于其他萃取相部位提取物;正己烷相提取物和二氯甲烷相提取物可显著抑制MCF-7细胞的增殖。
关键词:莲蓬壳;极性部位;自由基;细胞增殖
doi:10.3969/j.issn.1000-4440.2015.03.034
收稿日期:2014-11-26
基金项目:江苏省农业科技自主创新基金项目
作者简介:何静(1989-),女,新疆轮台人,硕士研究生,主要从事食品生物化学的研究。(E-mail)hejing2012279@163.com
通讯作者:李鹏霞,(E-mail)jsnky203@163.com;冯作山,(E-mail)fengzuoshan@126.com
中图分类号:S645.9
文献标识码:A
文章编号:1000-4440(2015)03-0679-06
Abstract:Five fractions of lotus receptacle, hexane, dichloromethane(CH2Cl2), ethyl acetate(EtOAc), n-butanol (N-BuOH) and water (H2O), extracted with ethanolic were determined for their total phenolic and flavonoid contents and antioxidative activities. Total phenolic and flavonoid contents exhibited the highest contents in EtOAC fraction, followed by N-BuOH fraction and water fraction in order. Antioxidations of all five fractions were shown by the strong scavenging abilities to hydrogen peroxide, superoxide anion and 1-dipheny1-2-picrylhydrazy1. The two fractions, EtOAC and N-BuOH, outperformed other three in antioxidation, while other two fractions, CH2Cl2 and hexane, were superior in inhibiting the proliferation of human breast cancer cell(MCF-7).
Bioactivities of different fractions of lotus receptacle
HE Jing1,2,WU Lei2,LI Peng-xia3,HU Wei-cheng2,ZHANG Yan-yan2,LIU Shuai2,LIU En-xue2,YOU Long2,WANG Xin-feng2,BAI Yu-jia1,FENG Zuo-shan1
(1.CollegeofFoodScienceandPharmacology,XinjiangAgriculturalUniversity,Urumqi830052,China;2.HuaiyinNormalUniversity/JiangsuKeyLaboratoryforEco-AgriculturalBiotechnologyaroundHongzeLake,Huai’an223300,China;3.InstituteofAgriculturalProductsProcessing,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
Key words:lotus receptacle;fraction;free radical;cell proliferation
自由基是一类具有高度活性的物质,在人体新陈代谢中起着重要的作用。正常情况下,人体内的自由基处于稳定的动态平衡中,当这一平衡被打破时,机体内的器官将会发生病变,引发疾病和衰老。近年来,寻找和制备特效自由基清除剂和抗氧化剂愈发受到人们的重视,其中从中药植物中提取天然抗氧化剂已成为热点话题[2-3]。
莲蓬壳为莲科植物莲(NelumbonuciferaGaertn.)的成熟花托,又名莲房。据《本草纲目》记载,“莲房,消淤散血。酒煮服之,治血涨腹痛及产后胎衣不下。” ,民间常用炭制莲房作为一种止血药使用。莲主要分布于中国长江、黄河、珠江以及洪湖等湖的浅水区。现代药理试验结果表明,莲蓬壳能有效地清除自由基的生成,且对二苯基苦味酰基苯肼(DPPH)自由基和·OH自由基的清除能力均高于维生素C,其对Fe3+的还原能力与维生素C基本一致[5-6]。除此之外,大量文献报道莲蓬壳具有改善小鼠记忆性障碍[7-8],抑制黑色素瘤细胞[9-10],延缓衰老[11],调解血脂和保护心血管系统等生物活性[12-14]。国内外学者研究发现莲蓬壳含有丰富的莲房原花青素和以金丝桃苷、槲皮素为主的黄酮类化合物以及少量的生物碱等活性成分[15]。莲蓬壳作为莲的非可食用部分,通常作为废弃物直接丢弃,造成生物资源的极大浪费和环境的严重污染。本试验采用萃取分离方法获得莲蓬壳萃取物,通过采用化学发光法、还原能力测定法及DPPH自由基清除等方法,对莲蓬壳萃取物抗氧化活性进行研究,旨在揭示莲蓬壳的抗氧化能力及其活性部位,为莲蓬壳的合理开发利用提供理论依据,也为天然抗氧化剂和功能性食品开发提供新的资源。
1材料与方法
1.1 材料与试剂
莲蓬壳(采自江苏省金湖县,2013年9月),经干燥脱水后,粉碎过80目筛,得莲蓬壳粉末,置常温干燥处备用。
芦丁标准品、没食子酸标准品、DPPH、鲁米诺(luminol)、5-氟尿嘧啶、甲氮甲唑蓝(MTT)及台盼蓝均购于Sigma公司。DMEM培养基、胎牛血清购于Gibco公司。抗坏血酸、邻苯三酚、过氧化氢、硝酸铝、氢氧化钠、亚硝酸钠、氯化铁、铁氰化钾、三氯乙酸、无水乙醇、正己烷、乙酸乙酯、二氯甲烷、正丁醇、十二烷基硫酸钠(SDS)均为分析纯试剂。
MTT工作液配制:精密称取0.10 g甲氮甲唑蓝试剂后,加入到20 ml水中,混匀避光过滤,配制成5 mg/ml MTT溶液。
MTT终止液配制:精密称取20.00 g SDS试剂,加入0.176 ml的盐酸溶液后,用水定容至20 ml即可。
1.2 仪器与设备
分析天平,购自北京赛多利斯仪器系统有限公司;Tecan infinite M200PRO酶标仪,购自瑞士Tecan公司;KQ-500B超声波清洗器,购自昆山市超声仪器有限公司;二氧化碳培养箱,购自日本SANYO公司;倒置显微镜,购自日本Olympus公司。
1.3 试验方法
1.3.1莲蓬壳不同极性溶剂提取物制备在乙醇体积分数80%、料液比1∶20、温度50 ℃条件超声提取1 h,提取2次,过滤;将滤液低压浓缩至膏状物质,取部分冷冻干燥,得到醇提物干样;加入定量的水将上述剩余的膏状物质溶解后,充分摇匀,转入分液漏斗中。以1∶1的配比依次用正己烷、二氯甲烷、乙酸乙酯、正丁醇溶剂各萃取3次,得到正己烷部位、二氯甲烷部位、乙酸乙酯部位、正丁醇部位和水提部位的萃取物。将各组萃取物减压浓缩后,真空冷冻干燥至恒质量,密封置于冰箱冷藏备用。
1.3.2芦丁标准溶液制备准确称取经120 ℃烘干至恒质量的芦丁标准品0.05 g,80%乙醇溶解后定容至50 ml,摇匀,得1 mg/ml芦丁标准溶液。
1.3.3芦丁标准曲线制作参照Hossain等[16]的方法加以改进。分别精密量取1 mg/ml芦丁标准溶液0.1 ml、0.2 ml、0.3 ml、0.4 ml、0.5 ml置于10.0 ml试管中,各加80%乙醇溶液至1.0 ml,再加入0.3 ml 5%亚硝酸钠溶液,摇匀,避光静置反应5 min后,加入0.3 ml的10%硝酸铝,摇匀,静置6 min,加入2.0 ml的4%氢氧化钠,摇匀放置15 min后,于波长510 nm处测定其吸光值。以芦丁浓度为横坐标,吸光值为纵坐标,绘制芦丁标准曲线,标准方程Y=0.003x+0.017,R2=0.995。式中Y为吸光度;x为黄酮质量浓度。
1.3.4没食子酸溶液制备准确称取经120 ℃烘干至恒质量的没食子酸标准品0.05 g,80%乙醇溶解定容至50 ml,得到1 mg/ml没食子酸标准溶液。
1.3.5没食子酸标准曲线制作采用Ghimeray等[17]方法加以改进。用80%乙醇配制不同浓度的没食子酸标准溶液(0.1 mg/ml、0.2 mg/ml、0.3 mg/ml、0.4 mg/ml、0.5 mg/ml),各吸取200 μl后加入1.0 ml蒸馏水、福林酚试剂0.2 ml混匀,静置3 min后,加入7.5%碳酸钠溶液0.6 ml后混匀,室温静置40 min后,于波长765 nm下测定器吸光值。以没食子酸浓度为横坐标,吸光值为纵坐标,绘制没食子酸标准曲线,标准方程Y=0.004x+0.101,R2=0.998。式中Y为吸光度;x为多酚质量浓度(mg/ml)。
1.3.6莲蓬壳不同极性部位中总黄酮、多酚含量测定准确称取莲蓬壳萃取物0.01 g,溶于10 ml 80%乙醇中,配制成1 mg/ml溶液,代入到各标准曲线中,测定萃取物中总黄酮、多酚含量。
1.3.7抗氧化能力测定
1.3.7.1莲蓬壳不同极性部位清除DPPH自由基的测定[18]分别向板孔内加入100 μl不同质量浓度莲蓬壳萃取段溶液和100 μl 0.2 mmol/L DPPH溶液,混匀后避光反应30 min,在波长517 nm处测定吸光度,重复3次,取平均值。
DPPH清除率=[1-(A1-A2)/A3]×100%
式中,A1:DPPH溶液与待测液的吸光度之和;A2:待测液与溶剂的吸光度之和;A3:DPPH溶液与溶剂的吸光度之和。
1.3.7.2还原能力测定[18]量取0.2 ml不同质量浓度莲蓬壳萃取段溶液(0.05 mg/ml、0.10 mg/ml、0.20 mg/ml、0.40 mg/ml),依次加入0.5 ml 0.2 mol/L pH 6.6磷酸缓冲溶液、1%铁氰化钾溶液0.5 ml,于50 ℃下水浴30 min后,加入10%三氯乙酸溶液(TCA)0.5 ml摇匀,10 000r/min 5 min离心,吸取上清溶液0.5 ml,加入0.5 ml蒸馏水和0.1 ml 0.1%氯化铁溶液,混合均匀,静置10 min。于波长700 nm处测定吸光度,重复3次,取平均值。
1.3.7.3清除H2O2能力测定[19]配制不同浓度(0.1 μg/ml、0.5 μg/ml、1.0 μg/ml、10.0 μg/ml、100.0 μg/ml)莲蓬壳萃取物溶液100 μl,加入0.03 mol/L H2O250 μl和0.04 mmol/L鲁米诺碳酸盐缓冲液(0.05 mol/L Na2CO3-NaHCO3pH 9.4)50 μl后,立即启动反应。每间隔2 s计数1次,记录180 s内的发光强度。重复3次,取平均值。发光抑制率按下式计算:
发光抑制率=[(对照发光强度-样品发光强度)/对照发光强度]×100%。
1.3.7.4清除O2·-能力[19]配制不同浓度(10 μg/ml、50 μg/ml、100 μg/ml、200 μg/ml、400 μg/ml)莲蓬壳萃取物溶液100 μl,加入50 μl 1 mmol/L邻苯三酚,以及50 μl 1 mmol/L鲁米诺碳酸钠缓冲液(0.05 mol/L Na2CO3-NaHCO3pH 10.16)后,立即启动反应。每间隔2 s计数1次,测定180 s内的发光强度。重复3次,取平均值。
1.3.8莲蓬壳不同极性部位对乳腺癌细胞细胞增殖的影响[20]
1.3.8.1MCF-7细胞培养MCF-7细胞培养于含有10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM培养液(4.5 g/L葡萄糖、4.5 g/LL-谷氨酸胺、110 mg/L 丙酮酸钠)中,置于37 ℃、5% CO2细胞培养箱中培养。待细胞生长至融合率达80%时,用1 ml 0.25%胰酶+0.02%EDTA消化2 min,按1∶7进行传代培养。
1.3.8.2莲蓬壳萃取部分对MCF-7细胞存活率的影响取对数生长期细胞MCF-7,调整细胞数至1 ml 4×105个,接种于96孔培养板内,每孔100 μl,置37 ℃、5% CO2细胞培养箱中培养16 h后,加入浓度为100 μg/ml莲蓬壳萃取物共培养,每孔均设3复孔。处理24 h、48 h后,吸取上清液,每孔加入100 μl MTT工作液,于二氧化碳培养箱内培养4 h后,加入100 μl MTT终止液,待完全溶解后,在酶联免疫检测仪上于550 nm处测量各孔的吸光值,计算细胞生长率。
2结果与分析
2.1 莲蓬壳提取物不同极性部位总黄酮和多酚含量
莲蓬壳不同极性部位多酚和总黄酮结果(表1)显示,不同极性部位中总黄酮含量为 54.03~351.58 mg/g,含量差异较大。其含量从高到低依次为乙酸乙酯部位>正丁醇部位>水提部位,而正己烷部位和二氯甲烷部位则未检测到含有黄酮物质。多酚含量为 13.69~564.21 mg/g,按照含量从高到低依次为乙酸乙酯部位>正丁醇部位>水提部位>二氯甲烷部位>正己烷部位。值得注意的是二氯甲烷部分和正己烷部分可检测出含有少量活性物质多酚,可能是少量的多酚物质溶于弱极性溶剂中。
表1莲蓬壳提取物不同极性部位总黄酮和多酚含量
Table 1Total flavonoids and phenolics contents of different fractions extracted from lotus receptacle
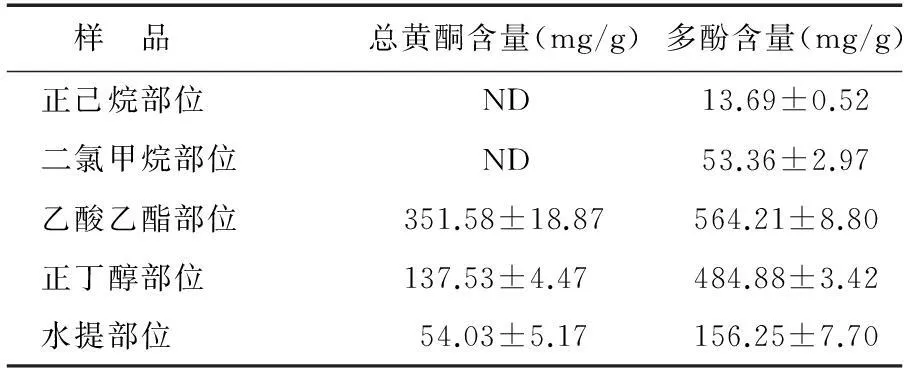
样 品总黄酮含量(mg/g)多酚含量(mg/g)正己烷部位ND13.69±0.52二氯甲烷部位ND53.36±2.97乙酸乙酯部位351.58±18.87564.21±8.80正丁醇部位137.53±4.47484.88±3.42水提部位54.03±5.17156.25±7.70
ND:未检测到。
2.2 莲蓬壳不同极性部位提取物抗氧化作用
2.2.1对DPPH自由基清除能力DPPH是一种稳定的以氮为中心的自由基,当体系中存在抗氧化剂时,DPPH自由基由紫色还原为黄色的非自由基DPPH-H形式,在517 nm处的吸光度发生变化,一定范围内,其变化程度与自由基清除程度呈线性关系。为了便于比较不同抗氧化剂能力的强弱,常用IC50值表示,即对自由基清除率为50%时所对应抗氧化剂的质量浓度。IC50值越小,表明该物质清除自由基的能力越强。此方法已普遍被运用于中药材抗氧化能力的测定中[21]。由表2可知,莲蓬壳不同极性部位提取物对DPPH均具有较强的清除能力,且清除DPPH能力大小依次为乙酸乙酯部位提取物>正丁醇部位提取物>水提部位提取物>正己烷部位提取物>二氯甲烷部位提取物。其中乙酸乙酯部位提取物和正丁醇部位提取物对DPPH清除的能力均高于叔丁基对苯二酚和维生素C,具有很强清除DPPH自由基的能力,IC50分别为 (3.79±0.40) μg/ml和 (4.22±1.50)μg/ml。可能的原因是清除DPPH自由基活性成分主要富集在乙酸乙酯部位和正丁醇部位。
表2莲蓬壳不同极性部位提取物对DPPH自由基清除能力
Table 2DPPH free radical scavenging activities of different fractions extracted from lotus receptacle
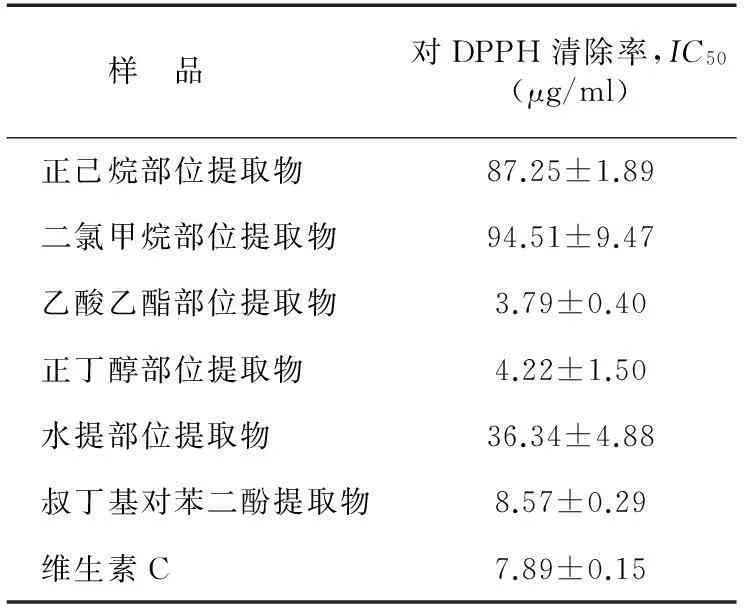
样 品对DPPH清除率,IC50(μg/ml)正己烷部位提取物87.25±1.89二氯甲烷部位提取物94.51±9.47乙酸乙酯部位提取物3.79±0.40正丁醇部位提取物4.22±1.50水提部位提取物36.34±4.88叔丁基对苯二酚提取物8.57±0.29维生素C7.89±0.15
2.2.2还原能力采用铁离子还原能力(FRAP)法测定抗氧化物质氧化还原的潜力,其作用机理是在较低pH值环境下,抗氧化物质能将三吡啶三嗪三价铁的物质还原为蓝色的三吡啶三嗪二价铁。还原能力大小通过在700 nm处的吸光值来检测,吸光度越大还原能力越强即抗氧化能力越强[22]。如图1所示,莲蓬壳不同极性部位提取物均表现出不同程度的还原能力,且具有明显的量效关系。可以看出莲蓬壳不同极性部位提取物的还原能力最强的是乙酸乙酯部位提取物,正丁醇部位提取物和水提部位提取物次之,二氯甲烷部位和正己烷部位还原能力最弱,均弱于阳性对照。
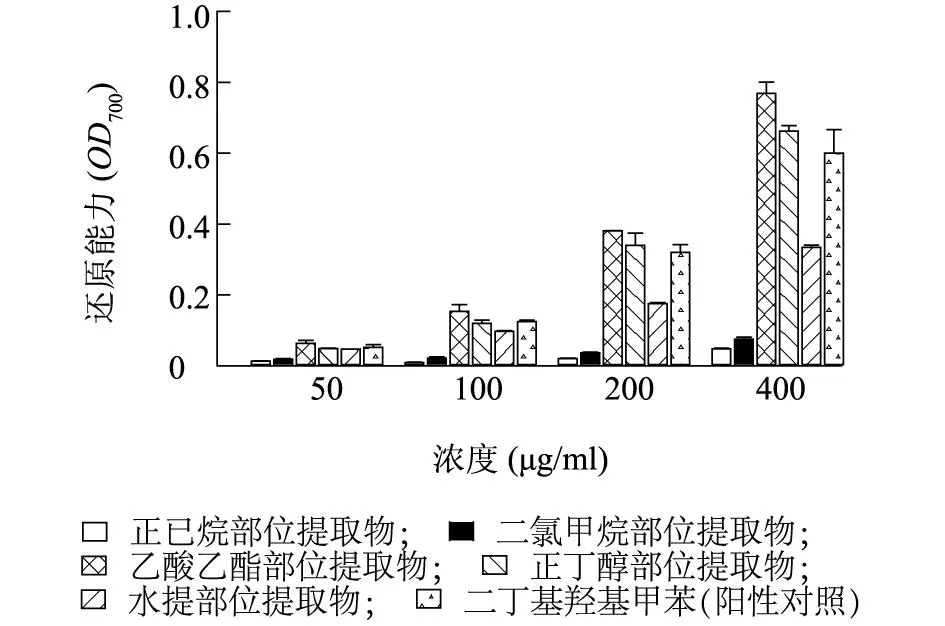
图1 莲蓬壳不同极性部位提取物Fe 3+还原能力 Fig.1 Reducing power abilities of different fractions extracted from lotus receptacle
2.2.3对过氧化氢清除能力过氧化氢(H2O2)在有氧和碱性的条件下,能够氧化体系中的鲁米诺,产生化学发光。由表3可知,在测定浓度范围内,莲蓬壳不同极性部位提取物对H2O2均有一定的清除能力,且对H2O2的清除率随着莲蓬壳不同极性部位提取物浓度的增加而提高,具有一定剂量依赖关系。其中以乙酸乙酯部分提取物、正丁醇部分提取物对H2O2清除能力最强,100 μg/ml乙酸乙酯部分提取物和正丁醇部分提取物对过氧化氢清除率分别为99.88%和99.25%,接近于维生素C(阳性对照,99.58%)。说明在乙酸乙酯部位提取物和正丁醇部位提取物清除H2O2的活性可能较高。
2.2.4对超氧阴离子自由基清除能力采用邻苯三酚-鲁米诺化学发光体系检测样品对超氧阴离子的清除作用。邻苯三酚在碱性条件自动氧化生成超氧阴离子(O2·-),O2·-向化学发光剂鲁米诺发起进攻,鲁米诺受到激发后处于激发态,继而会从激发态返回到基态,同时伴随着能量的释放,产生化学反应[23]。由表4可以看出,在测定范围内,莲蓬壳不同极性部位提取物对O2·-均具有一定的清除作用,且随着莲蓬壳不同极性部位提取物浓度的升高,清除率也逐渐增强,呈一定的剂效关系。清除O2·-能力依次为乙酸乙酯部位提取物>水提部位提取物>正丁醇部位提取物>正己烷部位提取物>二氯甲烷部位提取物。其中400 μg/ml维生素C具有很强清除O2·-的能力,清除率达到96.78%,而乙酸乙酯部位提取物略低于维生素C,清除率为85.39%。
表3莲蓬壳不同极性部位提取物对过氧化氢的清除作用
Table 3The scavenging abilities of different fractions from lotus receptacle on H2O2
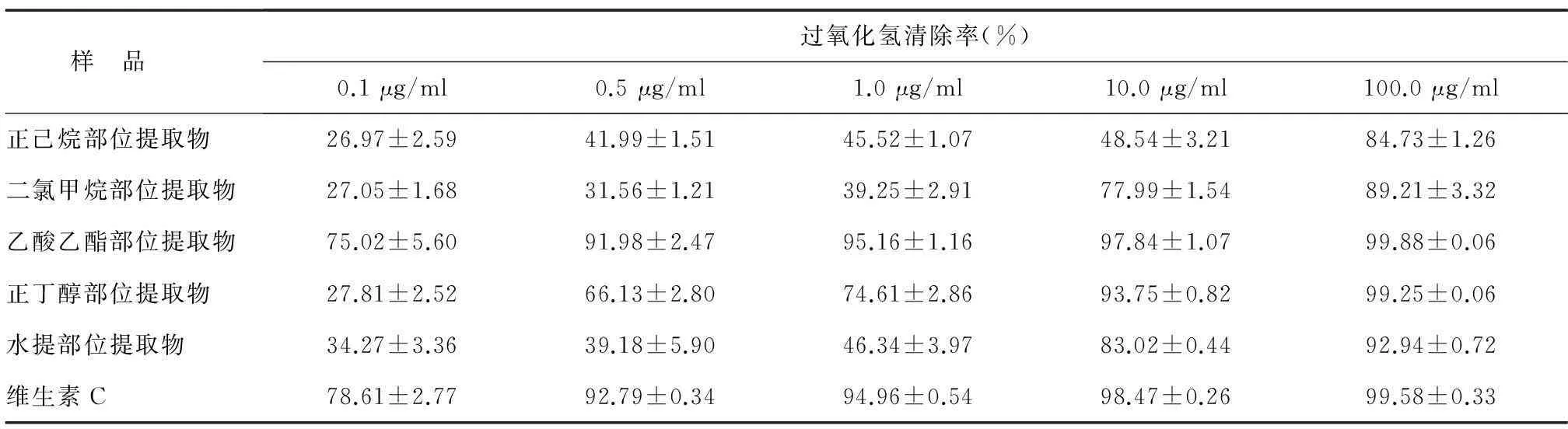
样 品 过氧化氢清除率(%)0.1μg/ml0.5μg/ml1.0μg/ml10.0μg/ml100.0μg/ml正己烷部位提取物26.97±2.5941.99±1.5145.52±1.0748.54±3.2184.73±1.26二氯甲烷部位提取物27.05±1.6831.56±1.2139.25±2.9177.99±1.5489.21±3.32乙酸乙酯部位提取物75.02±5.6091.98±2.4795.16±1.1697.84±1.0799.88±0.06正丁醇部位提取物27.81±2.5266.13±2.8074.61±2.8693.75±0.8299.25±0.06水提部位提取物34.27±3.3639.18±5.9046.34±3.9783.02±0.4492.94±0.72维生素C78.61±2.7792.79±0.3494.96±0.5498.47±0.2699.58±0.33
表4莲蓬壳不同极性部位提取物对超氧阴离子自由基的清除作用
Table 4The scavenging abilities of different fractions from lotus receptacle on O2·-
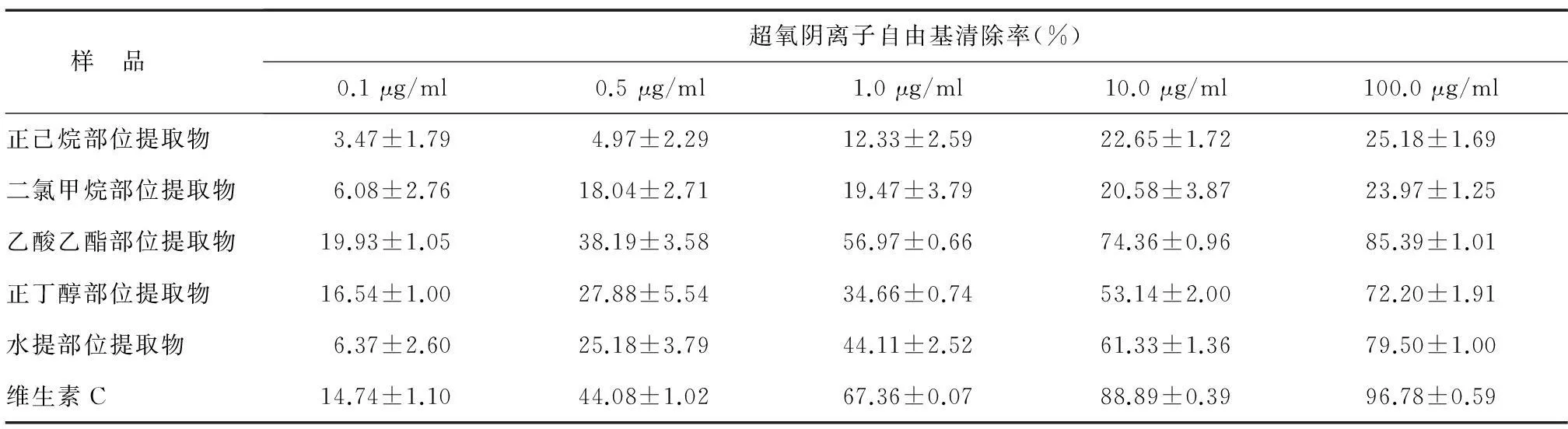
样 品 超氧阴离子自由基清除率(%)0.1μg/ml0.5μg/ml1.0μg/ml10.0μg/ml100.0μg/ml正己烷部位提取物3.47±1.794.97±2.2912.33±2.5922.65±1.7225.18±1.69二氯甲烷部位提取物6.08±2.7618.04±2.7119.47±3.7920.58±3.8723.97±1.25乙酸乙酯部位提取物19.93±1.0538.19±3.5856.97±0.6674.36±0.9685.39±1.01正丁醇部位提取物16.54±1.0027.88±5.5434.66±0.7453.14±2.0072.20±1.91水提部位提取物6.37±2.6025.18±3.7944.11±2.5261.33±1.3679.50±1.00维生素C14.74±1.1044.08±1.0267.36±0.0788.89±0.3996.78±0.59
2.3 MTT法检测细胞增殖率
以未加药物的细胞为对照,加入抗癌药物5-氟尿嘧啶作为阳性对照。由图2所示,当细胞与药物共同孵育24 h时,莲蓬壳不同极性部位提取物与对照相比,乙酸乙酯部位提取物、正丁醇部位提取物和水提部位提取物均有促进细胞生长的趋势,而正己烷部位提取物和二氯甲烷部位提取物对MCF-7细胞增殖有一定的抑制作用,且正己烷部位提取物抑制作用高于二氯甲烷部位提取物,两者细胞存活率分别为34.00%和73.00%。当细胞与药物共同孵育48 h时,与对照相比,莲蓬壳不同极性部位提取物均对MCF-7细胞生长有不同程度的抑制作用,且正己烷部位提取物和二氯甲烷部位提取物抑制作用最强,其细胞存活率分别为3.57%和7.80%。
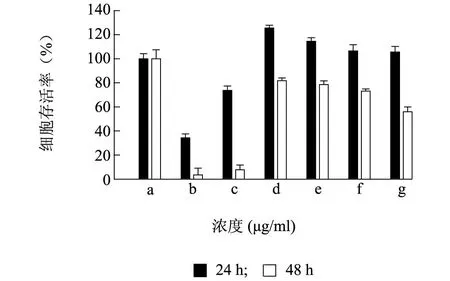
a:对照;b:正己烷部位提取物;c:二氯甲烷部位提取物;d:乙酸乙酯部位提取物;e:正丁醇部位提取物;f:水提部位提取物;g:5-氟尿嘧啶。 图2 莲蓬壳不同极性部位提取物处理下MCF-7细胞存活率 Fig.2 Cell survival rate of MCF-7 treated by different fractions extracted from lotus receptacle
3讨论
由于不同抗氧化检测方法的反应机理不同,为获得可靠的试验结果,本试验采用DPPH自由基清除法、还原能力测定法、清除H2O2和O2·-的方法对莲蓬壳不同极性溶剂提取物的抗氧化能力进行评价。研究发现莲蓬壳不同极性部位提取物对DPPH、Fe3+、H2O2和O2·-均具有良好的抗氧化活性。在对DPPH自由基、H2O2清除和还原Fe3+试验中,以中等极性乙酸乙酯部位提取物和正丁醇部位提取物的活性最强,强极性水提物的抗氧化活性中等,而弱极性二氯甲烷部位提取物和正己烷部位提取物抗氧化作用最弱。试验发现莲蓬壳不同极性部位提取物中的总黄酮和多酚含量与抗氧化活性间呈正相关性,即总黄酮、多酚含量越高,提取物的抗氧化活性越强。细胞试验发现正己烷部位提取物和二氯甲烷部位提取物对MCF-7细胞具有很强的抑制作用。研究结果表明乙酸乙酯部位提取物和正丁醇部位提取物为莲蓬壳提取物中主要抗氧化活性物质,可通过进一步分离提取其有效活性成分,确定莲蓬壳抗氧化作用的物质基础,为莲蓬壳的开发利用提供依据。
参考文献:
[1]李勇,孔令青,高洪,等. 自由基与疾病研究进展 . 动物医学进展, 2008, 29(4): 85-88.
[2]焦岩,常影,余世锋,等. 大果沙棘渣黄酮体外抗氧化活性 . 江苏农业科学, 2014, 42(9): 285-287.
[3]张伟,张焕新,施洋,等. 银杏叶中黄酮类物质提取及其抗氧化活性 . 江苏农业科学, 2013, 41(3): 230-234.
[4]陈超群. 莲房的化学成分 .昆明:云南中医学院,2013.
[5]凌智群,谢笔钧.莲房原花青素对氧自由基和脂质过氧化的作用.营养学报,2002, 24(2): 121-125.
[6]郑丽鋆,吴研斌,吴建国,等. 莲房不同溶剂提取物对DPPH自由基的清除作用 . 福建中医药, 2012, 43(1): 54-56.
[7]张丽,许继取,荣爽,等. 莲房原花青素对东莨菪碱所致小鼠记忆获得性障碍的改善作用 . 华中科技大学学报:医学版,2009, 38(3): 335-358.
[8]龚玉石,唐瑛,肖俊松,等. 莲房原花青素改善小鼠学习记忆障碍的研究 . 营养学报, 2006, 28(4): 318-321.
[9]段玉清,张海晖,吴佳,等. 莲房原花青素对黑色素瘤B16细胞的诱导分化作用 . 癌变·畸变·突变, 2007, 19(5): 377-380.
[10]段玉清,周密,张海晖,等. 莲房原花青素对黑色素瘤B16细胞的抑制作用 . 中国药学杂志, 2009, 44(2): 103-106.
[11]陈戈,唐瑛,杨李,等. 莲房原花青素对D-半乳糖衰老小鼠脑组织抗氧化的作用 . 中国药师, 2009, 12(8): 1023-1025.
[12]凌智群,谢笔均,周顺长,等. 莲房原花青素对家兔血脂及肝组织形态的影响 . 天然产物研究与开发, 2001, 13(4): 62-64.
[13]张晓晖,张斌,龚培力,等. 莲房原花青素对大鼠心肌缺血再灌注损伤的保护作用 . 药学学报, 2004, 39(6): 401-405.
[14]凌智群,谢笔均,江涛,等. 莲房原花青素对大鼠实验性心肌缺血的保护作用 . 中国药理学通报, 2001, 17(6): 687-690.
[15]陈红梅,谢翎. 莲房黄酮微波辅助提取工艺优化及其抗氧化性能 . 食品工业科技, 2013, 34(4): 224-231.
[16]HOSSAIN M A, KALBANI M S, FARSI S A, et al. Comparative study of total phenolics, flavonoids contents and evaluation of antioxidant and antimicrobial activities of different polarities fruits crude extracts ofDaturametelL.. Asian Pacific Journal of Tropical Disease, 2014, 4(5): 378-383.
[17]GHIMERAY A K, SHARMA P, HU W C, et al. Far infrared assisted conversion of isoflavones and its effect on total phenolics and antioxidant activity in black soybean seed . Journal of Medicinal Plants Research, 2013, 7(17): 1129-1137.
[18]SI C L, SHEN T, JIANG Y Y, et al. Antioxidant properties and neuroprotective effects of isocampneoside Ⅱon hydrogen peroxide-induced oxidative injury in PC12 cells. Food and chemical toxicology, 2013, 59: 145-152.
[19]邓乾春,陈春艳,田斌强,等. 化学发光法测定白果白蛋白的体外抗氧化活性 . 中草药, 2007, 38(5): 685-690.
[20]HU W C, HAN W, HUANG C Q, et al. Protective effect of the methanolic extract fromDuchesneaindicaagainst oxidative stressinvitroandvivo. Environmental Toxicology and Pharmacology, 2011, 31: 42-50.
[21]郭雪峰,岳永德,汤锋,等. 用清除有机自由基DPPH法评价竹叶提取物抗氧化能力 . 光谱学与光谱分析, 2008, 28(7): 1578-1582.
[22]刘小兵. 生物活性物质的抗氧化能力评价方法及其研究进展 . 中国食品卫生杂志, 2008, 20(5): 440-444.
[23]李培培,戚向阳,罗彤,等. 化学发光法研究杨梅黄酮提取物的抗氧化活性 . 中国食品学报, 2011, 11(7): 190-194.
(责任编辑:袁伟)
陆昌华,胡肄农,甘泉,等. 动物食品质量安全风险因素分析及其防控对策[J].江苏农业学报,2015,31(3):685-690.
