赤潮水体红光波段反射光谱的模拟及形成机理*
2016-01-15丘仲锋陈艳拢孟庆辉
王 林 丘仲锋 陈艳拢 孟庆辉
(1. 国家海洋环境监测中心海域监管中心 大连 116023; 2. 南京信息工程大学海洋科学学院 南京 210044)
反射光谱属水体表观光学量, 随周围环境光场以及水体介质而变化。Gordon等(1975)利用蒙特卡罗数值模拟, 建立了刚好处于水面以下的辐照度比与吸收系数和后向散射系数之间的多项式模型, 之后,研究者(Morel et al, 1977; Kirk, 1983; Gordon et al,1983, 1988)主要基于此模型模拟水体的反射光谱。然而, 该模型仅考虑了水体的弹性散射过程, 未考虑水分子的拉曼散射和叶绿素荧光。与吸收引起的入射光能量损失相比, 近岸水体中水分子拉曼散射引起的能量损失几乎可以忽略(Marshall et al, 1990), 而叶绿素荧光对反射光谱的影响较大, 尤其是对赤潮水体而言, 通常将红光波段的叶绿素荧光峰作为区别其它水体的主要特征。国内外学者围绕荧光峰高度、位置与叶绿素浓度的关系开展了大量研究, 发现随着叶绿素浓度的增加, 荧光峰的高度不断变大, 并且荧光峰的位置出现红移(Gower, 1980; Gower et al, 1990;Gitelson, 1992, 1993; Gower et al, 1999; 赵冬至等,2000, 2004ab, 2005ab), 赤潮水体尤为明显, 这与叶绿素荧光发射峰的波长位于 683nm 相矛盾(Morel et al, 1977; Neville et al, 1977), “荧光峰”的红移问题引起研究者的广泛关注。Ahmed等(2004), Gilerson等(2005, 2006, 2007)利用偏振识别技术将水体的离水辐亮度分解成弹性散射光和叶绿素荧光两部分, 并证实红光波段反射峰的构成依赖于水体的成分, 弹性反射、吸收对峰值的大小、位置均有影响。马万栋等(2010)采用前向辐射传输模型模拟了弹性散射作用下藻类水体的反射光谱, 发现红光波段存在明显的反射峰, 且随叶绿素浓度的增加, 向长波方向移动。Tao等(2013)利用 Hydrolight软件模拟了弹性散射光和叶绿素荧光共同作用下的反射光谱, 发现叶绿素荧光量子产量Ф和浮游植物比吸收系数aph*对红光波段反射峰的形成有重要作用, 并指出叶绿素荧光抑制反射峰的红移, Ф增大可加剧这种作用; 并且 aph*增大, 荧光作用减小, 可加剧反射峰红移。
本研究根据2011年7月9日大连湾海域赤潮暴发时的现场实测数据, 开展了赤潮水体红光波段反射光谱的模拟及形成机理研究, 以期为赤潮水体卫星遥感探测提供理论依据。
1 材料与方法
1.1 数据来源
本研究所用数据均来自2011年7月9日大连湾海域中肋骨条藻赤潮时的外业调查实验, 共6个站位(S1、S2、S3、S4、S5、S6), 如图1所示。现场测量数据主要包括: 反射光谱、总吸收系数、总衰减系数以及后向散射系数等, 并同步采集水样带回实验室进行叶绿素浓度分析。
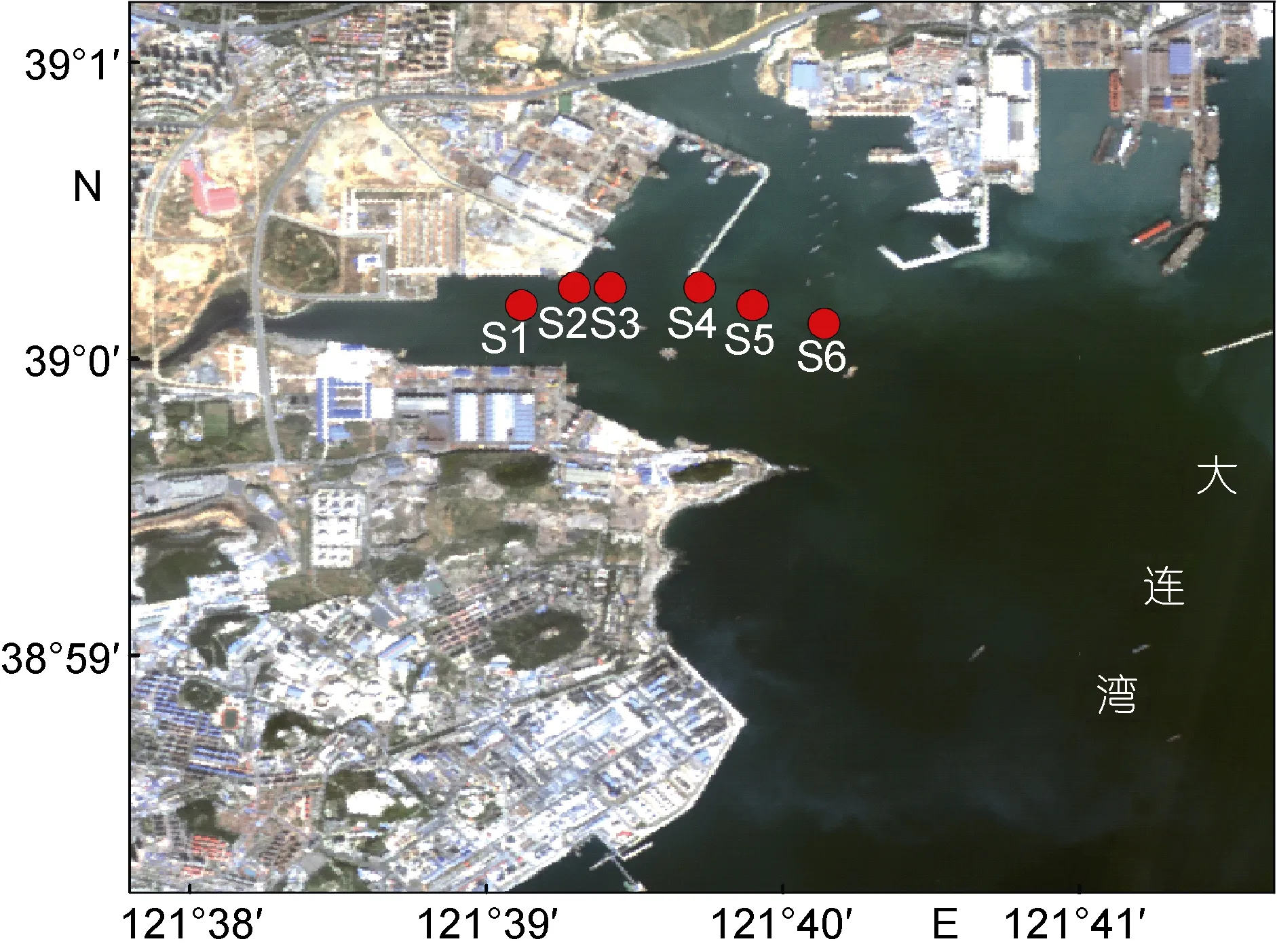
图1 大连湾海域现场调查站位Fig. 1 Deployment of stations in the Dalian Bay
1.2 数据测量方法
反射光谱测量采用水面之上法, 按照《海洋调查规范》GB/T 12763.5-2007的规定进行, 测量仪器为ASD公司的双通道便携式地物光谱仪; 总吸收系数测量按照《海洋调查规范》GB/T 12763.5-2007的规定进行, 测量仪器为Wet lab 公司的AC-S吸收衰减系数测量仪; 后向散射系数测量按照《海洋监测技术规范》HY/T 147.7-2013的规定进行, 测量仪器为HOBI Labs公司的HS-6后向散射系数测量仪; 叶绿素浓度测量采用荧光法, 按照《海洋调查规范》GB/T 12763.6-2007的规定进行, 测量仪器为Turner公司的TD-700实验室荧光仪。
1.3 数据应用与分析
本次赤潮暴发区范围较小, 调查断面全长约2km,但叶绿素浓度的梯度变化非常大, 变化范围为23.13—318.47mg/m3。因此, 现场测量时水体的变化较快, 对各仪器测量的同步性要求非常高。其中,AC-S吸收衰减系数测量仪与 HS-6后向散射系数测量仪安装于同一固定架上, 在调查船的前甲板同时布放, 其结果可作为同步数据使用; ASD地物光谱仪测量反射光谱与水样采集同时在船头进行, 其结果可作为同步数据使用, 但与AC-S、HS-6现场测量数据并不同步; 考虑到该问题, 将带回实验室的水样重新进行了AC-S实验室测量, 但因采集水样的体积有限, 未能进行HS-6实验室测量。
因此, 现场反射光谱数据与实验室水样分析数据(叶绿素浓度、CDOM、AC-S吸收系数及衰减系数等)可作为同步数据使用; 现场AC-S吸收系数、衰减系数与HS-6后向散射系数可作为同步数据使用。
2 反射光谱计算模型
反射光谱即遥感反射率 Rrs(λ), 定义为刚好处于水面以上的向上辐亮度与向下辐照度的比值:

Gordon等(1988)对 Rrs(λ)与水体的总吸收系数 a(λ)和总后向散射系数bb(λ)建立了如下关系式:

式中, f为经验常数, 变化范围为0.32-0.33; Q为光场分布函数, 约等于5, Q和f都是太阳天顶角的函数,但f/Q是太阳天顶角的弱函数; t为水气界面的透过率;n为水体折射率。Gordon等(1988)采用 f/Q=0.0945和t/n2=0.54, 即ft/Qn2=0.051。然而, 方程(2)中忽略了荧光和拉曼散射的影响, 本研究将浮游藻类叶绿素荧光 Rrs,f(λ)加入方程(2)中:

因此, 反射光谱计算方程(3)中包括 a(λ)、bb(λ)以及Rrs,f(λ)三个需输入的未知量。
这里, 将方程(3)的计算结果定义为模拟光谱,而把方程(2)的计算结果称为弹性散射作用下的模拟光谱。
3 模型未知量的确定
3.1 总吸收系数
水体总吸收系数为水体各成分的线性加和:
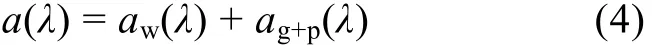
式中, aw(λ)为纯海水的吸收系数, 采用 Pope等(1997)(400—700nm)和 Kou 等(1993)(700—750nm)的研究结果; ag+p(λ)表示溶解物与颗粒物的吸收系数之和, 由AC-S实验室测量得到。
3.2 总后向散射系数
水体总后向散射系数为纯海水后向散射系数bbw(λ)与颗粒物后向散射系数 bbp(λ)之和:
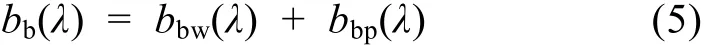
其中 bbw(λ)采用 Smith等(1981)的研究结果; 由于HS-6现场测量的后向散射系数与反射光谱同步性较差, 且其仅有 6个波段, 不能直接采用, 故必须经转化计算得到与反射光谱同步可比的bbp(λ)。
AC-S实验室测量采集水样可分别得到溶解物与颗粒物的衰减系数和吸收系数, 两者之差为颗粒物的散射系数bp(λ)(溶解物的散射系数可忽略), 其与颗粒物的后向散射概率()λ相乘即得到颗粒物的后向散射系数:

因此, 若得到bp()~bλ, 即可计算出与反射光谱同步可比的bbp(λ)。
AC-S实验室测量水样时, 没有同步的HS-6后向散射数据。这里先采用现场同步获取的AC-S散射系数与 HS-6后向散射系数计算水体的后向散射概率,并建立后向散射概率与同步吸收或散射系数的关系模型, 由于后向散射概率主要与颗粒物的粒径分布、构成等有关, 该模型可应用于 AC-S实验室测量数据,从而得到与吸收系数、反射光谱同步的后向散射概率。
数据分析发现, 后向散射概率与AC-S测量得到ag+p(λ)存在乘幂函数关系, 形式如下:

式中, A、B为模型回归系数。
回归结果如表1所示, 拟合曲线参见图2。可发现, 不同波段处, 后向散射概率与除纯水之外的吸收系数相关性较好,R2均在0.6以上。两者存在相关性的原因主要在于细胞浓度的变化可能伴随颗粒物粒径分布与构成的相应改变, 细胞浓度与吸收系数相关, 从而使得后向散射概率与吸收系数相关。
基于后向散射概率与吸收系数的关系模型, 可计算得到AC-S实验室测量水样对应的不同波段处的后向散射概率。但仅有6个波段的后向散射概率, 无法直接用于计算后向散射系数。本研究采用乘幂函数模拟后向散射概率与波长的关系, 形式如下:
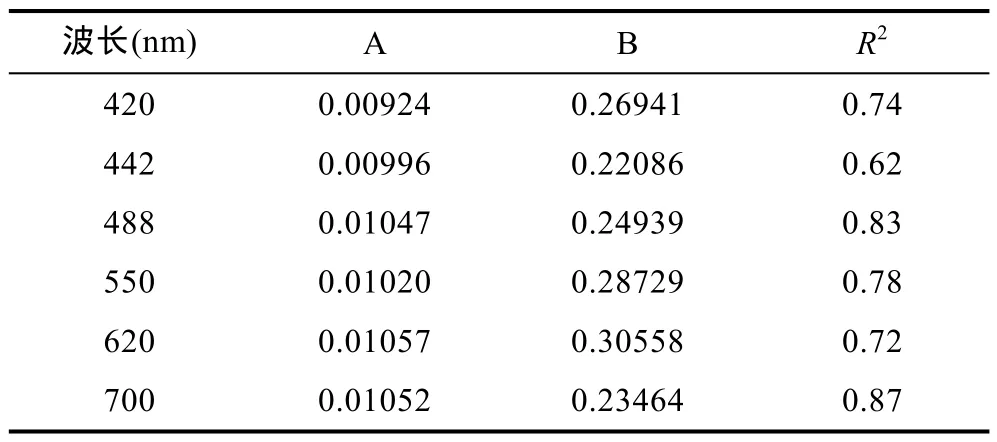
表1 后向散射概率与吸收系数的回归结果Tab.1 Regressed results of backscattering probability as afunction of absorption coefficient
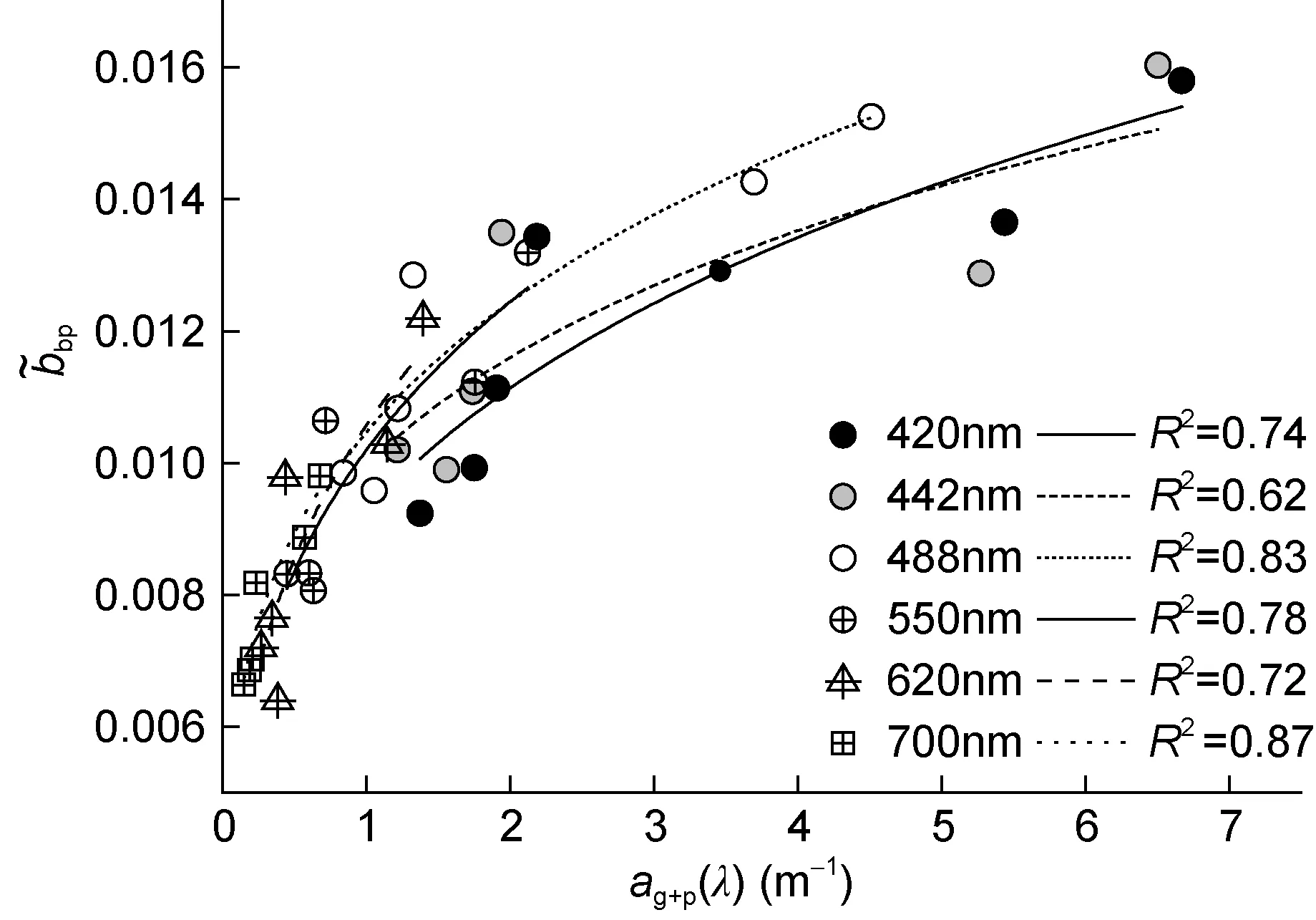
图2 后向散射概率与吸收系数的关系Fig.2 Regressed curves of backscattering probability as a function of absorption coefficient

式中, C、D为模型回归系数。
回归结果如表2所示, 拟合曲线参见图3。可发现, 采用乘幂函数模拟后向散射概率与波长的关系结果较好, 决定系数R2均在0.6以上。

表2 后向散射概率与波长的回归结果Tab.2 Regressed results of backscattering probability as a function of wavelength

图3 后向散射概率与波长的关系Fig.3 Regressed curves of backscattering probability as a function of wavelength
3.3 叶绿素荧光
叶绿素荧光在全荧光波段近似遵循高斯正态分布(Mobley, 1994), 中心位置 λ0在 683nm附近, 标准偏差 σf为 10.6nm, 半极大全宽(Full Width at Half Maximum, FWHM)为25nm, 则叶绿素荧光可表示为:

式中, FLH为荧光基线高度, 与叶绿素浓度有关。
荧光基线高度按公式(10)计算得到:
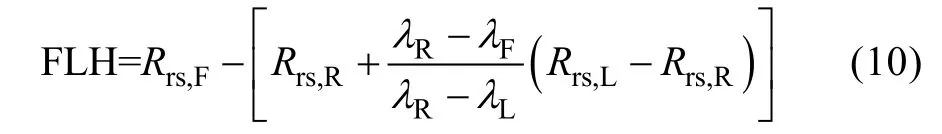
式中, λF、λL、λR分别为荧光峰通道、荧光峰左侧通道以及荧光峰右侧通道, Rrs,F、Rrs,L、Rrs,R分别为荧光峰通道、荧光峰左、右两侧通道的遥感反射率。依据本研究中反射光谱特征, λF、λL、λR分别设定为683、665、746nm。
将现场采集的反射光谱数据计算得到 FLH, 并采用乘幂函数模拟荧光基线高度与叶绿素浓度的关系, 形式如下:

式中, E、F为模型回归系数, c(Chl)为叶绿素浓度。
回归方程及拟合曲线如图4所示。可发现, 两者存在明显正相关关系, 相关性R2为0.87。据此实测的叶绿素浓度数据, 可计算得到FLH, 从而进一步计算得到全波段的叶绿素荧光。

图4 荧光基线高度与叶绿素浓度的关系Fig.4 Regressed curves of fluorescence line height as a function of chlorophyll concentration
4 反射光谱形成机理分析
利用上述方法计算总吸收系数、总后向散射系数以及叶绿素荧光, 并代入方程(2)、(3), 从而得到与实测光谱对应的模拟光谱, 如图5所示。可发现, 模拟光谱与实测光谱接近; 不考虑叶绿素荧光时, 弹性散射作用下模拟光谱的红光波段反射峰仍然存在; 加入叶绿素荧光后, 模拟光谱红光波段反射峰的位置与高度出现不同程度的改变。此外, 总吸收光谱峰、谷波长与实测反射光谱峰、谷波长相呼应, 叶绿素浓度较高时尤为明显, 但存在偏移, 可能与叶绿素荧光或后向散射系数的光谱特征有关。因此, 可确定赤潮水体实测光谱的“荧光峰”, 并非真正理论意义的荧光峰, 该峰由吸收、后向散射以及叶绿素荧光共同控制。
4.1 反射峰红移的控制因素
三个输入变量中, 叶绿素荧光峰位于 683nm位置不变, 总后向散射光谱未见明显峰、谷特征, 而总吸收光谱的吸收谷非常显著且位置存在变化。吸收谷波长、模拟及实测光谱反射峰波长列于表3中。可发现, 红光波段的吸收谷和反射峰波长均随叶绿素浓度的增加出现红移, 最大波长708nm; 吸收谷波长与弹性散射作用下模拟光谱的反射峰波长位置基本一致, 表明红光波段反射峰的红移与水体的后向散射关系不大, 主要与水体成分的吸收有关。水体的吸收成分中海水的吸收为常量, 恒定不变; 有色可溶性有机物和非色素颗粒物在红光波段吸收微弱, 可忽略不计; 因此, 造成反射峰红移的主要原因在于浮游藻类的强吸收作用。进一步分析发现, 红光波段吸收谷的形成原因在于左侧浮游藻类吸收的急速衰减与右侧纯海水吸收的快速增加, 随叶绿素浓度的增大, 浮游藻类吸收峰不断增高增宽, 即吸收谷左侧的光谱曲线不断提升且右移, 而右侧纯海水吸收引起的光谱曲线并未变化, 最终导致红光波段吸收谷的红移,在反射光谱中则表现为反射峰红移。此外, 弹性散射作用下模拟光谱的反射峰波长普遍大于其它两种;加入叶绿素荧光后, 模拟光谱的反射峰波长向短波移动, 与实测光谱的反射峰波长更为接近, 表明叶绿素荧光对反射峰的红移有一定的抑制作用。
4.2 反射峰高低的控制因素

图5 S1, S2, S3, S4, S5及S6站位各光学变量的光谱曲线(黑色实线: 实测光谱; 红色实线: 模拟光谱; 绿色实线: 弹性散射作用下的模拟光谱; 紫色虚线: 总吸收光谱; 蓝色虚线: 叶绿素荧光; 粉色虚线: 后向散射光谱)Fig. 5 Spectra curves at Stations S1, S2, S3, S4, S5 and S6 (black: measured spectrum; red: simulated spectrum; green: simulated spectrum caused by elastic scattering; purple: total absorption spectrum; blue: chlorophyll fluorescence; pink: total backscattering spectrum)实测反射光谱、模拟反射光谱及叶绿素荧光对应左侧纵坐标; 总吸收光谱和总后向散射光谱对应右侧纵坐标

表3 吸收谷波长、模拟及实测光谱反射峰波长的统计结果Tab.3 The statistical results of valley wavelength in total absorption spectra, peak wavelength in simulated spectra and measured spectra
按照荧光基线高度的计算方法, 依据实际反射峰的波长位置计算得到模拟光谱和实测光谱的基线高度, 如表4所示。可发现, 随叶绿素浓度的增加, 各种光谱反射峰的基线高度不断增大, 模拟光谱与实测光谱反射峰的基线高度较接近, 但实测结果略大于模拟结果; 值得注意的是, 当叶绿素浓度较高时,弹性散射作用下模拟光谱的基线高度却高于加入叶绿素荧光之后的模拟光谱, 分析原因在于, 加入叶绿素荧光之后, 模拟光谱的红光反射谷由 675nm左移至 667nm(与现场实测光谱吻合), 同时反射光谱值增大, 但叶绿素荧光对反射峰影响微弱, 这样计算基线高度的左侧波段升高, 而反射峰基本不变, 从而导致计算的基线高度没有增加, 反而减小; 但当叶绿素浓度较低时, 反射峰位置与叶绿素荧光峰波长接近, 叶绿素荧光对基线高度的左侧波段有提升作用, 但对反射峰影响更大, 可看出明显的升高, 此时加入叶绿素荧光模拟光谱的基线高度大于仅弹性散射作用下的模拟光谱。

表4 模拟光谱与实测光谱荧光基线高度的统计结果Tab.4 The statistical results of fluorescence baseline height in simulated spectra and measured spectra
5 结论
基于前向辐射传输模型, 综合考虑反射光谱中弹性散射光与非弹性散射光的影响, 确定模型输入未知量包括: 总吸收系数、总后向散射系数及叶绿素荧光, 经直接测量、间接转化及反演建模可分别得到。将获取的三个未知变量输入模型中, 得到模拟光谱, 与实测光谱对比, 可发现赤潮水体红光波段的反射峰由吸收、后向散射以及叶绿素荧光共同控制, 当叶绿素浓度较高时, 吸收和散射作用强于叶绿素荧光的影响, 而当叶绿素浓度较低时, 则相反; 而文献中通常提及的“荧光峰”红移实际与叶绿素荧光无关,主要是浮游藻类红光波段的强吸收作用导致, 而叶绿素荧光对反射峰的红移有抑制作用; 此外, 实测光谱中 667nm 的反射谷, 由叶绿素荧光峰(中心波长683nm)与浮游藻类 675nm吸收峰引起的反射谷叠加后产生, 因此, 叶绿素荧光对红光波段反射光谱的高低、形状均具有重要影响, 不可忽略。
近几年, 利用红光波段的反射峰、谷等特征信息遥感探测近岸水体叶绿素浓度的研究成果不断涌现,与荧光遥感探测相比, 反演精度有了大幅提升(Gilersonet al, 2010; Moseset al, 2012; Liet al, 2012;Zhouet al, 2013; Ampeet al, 2014)。本研究可为优化近岸水体水色信息遥感算法、提升反演精度提供支持。
马万栋, 邢前国, 张渊智等, 2010. 水体红波段反射光谱对叶绿素浓度变化的响应. 光谱学与光谱分析, 30(2):313—317
赵冬至, 丛王福, 2000. 渤海叉角藻赤潮的光谱特征研究. 见:渤海赤潮灾害监测与评估研究文集. 北京: 海洋出版社,109—116
赵冬至, 杜 飞, 赵 玲等, 2004a. 基于表面反射率的赤潮卫星荧光线高度算法比较. 高技术通讯, (11): 93—97
赵冬至, 张丰收, 杜 飞等, 2004b. 基于高光谱反射率的藻类水体基线荧光峰高度与叶绿素a浓度关系研究. 高技术通讯, (5): 68—72
赵冬至, 张丰收, 杨建洪等, 2005a. 表征赤潮水体太阳激发的叶绿素荧光高度的波段优化―归一化荧光高度法. 海洋学报, 27(6): 146—153
赵冬至, 张丰收, 杜 飞等, 2005b. 不同藻类水体太阳激发的叶绿素荧光峰(SICF)特性研究. 遥感学报, 9(3): 265—270
Ahmed S, Gilerson A, Gill Aet al, 2004. Separation of fluorescence and elastic scattering from algae in seawater using polarization discrimination. Opt Commun, 235(1—3):23—30
Ampe E M, Hestir E L, Bresciani Met al, 2014. A wavelet approach for estimating chlorophyll-afrom inland waters with reflectance spectroscopy. IEEE Geosci Remote Sens Lett, 11(1): 89—93
Gitelson A, 1992. The peak near 700nm on radiance spectra of algae and water: Relationships of its magnitude and position with chlorophyll concentration. Int J Remote Sens, 13(17):3367—3373
Gitelson A, 1993. Algorithms for remote sensing of phytoplankton pigments in inland waters. Adv Space Res,13(5): 197—201
Gilerson A, Oo M, Chowdhary Jet al, 2005. Polarization characteristics of water leaving radiance: application to separation of fluorescence and scattering components in coastal waters. In: Frouin R J, Babin M, Sathyendranath S eds. Remote Sensing of the Coastal Oceanic Environment.San Diego, California, USA: SPIE, 5885: 95—105
Gilerson A, Zhou J, Oo Met al, 2006. Retrieval of chlorophyll fluorescence from reflectance spectra of algae in sea water through polarization discrimination: modeling and experiments. Appl Opt, 45(22): 5568—5581
Gilerson A, Zhou J, Hlaing Set al, 2007. Fluorescence component in the reflectance spectra from coastal waters.Dependence on water composition. Opt Express, 15(24):15702—15721
Gilerson A A, Gitelson A A, Zhou Jet al, 2010. Algorithms for remote estimation of chlorophyll-ain coastal and inland waters using red and near infrared bands. Opt Express,18(23): 24109—24125
Gordon H R, Brown O B, Evans R Het al, 1988. A semianalytic radiance model of ocean color. J Geophys Res, 93(D9):10909—10924
Gordon H R, McCluney W R, 1975. Estimation of the depth of sunlight penetration in the sea for remote sensing. Appl Opt,14(2): 413—416
Gordon H R, Morel A Y, 1983. Remote Assessment of Ocean Color for Interpretation of Satellite Visible Imagery: A Review. New York: Springer, 114
Gower J F R, 1980. Observations of in situ fluorescence of chlorophyll-a in Saanich inlet. Bound-Layer Meteorol, 18(3):235—245
Gower J F R, Borstad G A, 1990. Mapping of phytoplankton by solar-stimulated fluorescence using an imaging spectrometer.Int J Remote Sens, 11(2): 313—320
Gower J F R, Doerffer R, Borstad G A, 1999. Interpretation of the 685nm peak in water-leaving radiance spectra in terms of fluorescence, absorption and scattering, and its observation by MERIS. Int J Remote Sens, 20(9): 1771—1786
Li Y M, Wang Q, Wu C Q et al, 2012. Estimation of chlorophyll a concentration using NIR/Red bands of MERIS and classification procedure in inland turbid water. IEEE Trans Geosci Remote Sens, 50(3): 988—997
Kirk J T O, 1983. Light and Photosynthesis in Aquatic Ecosystems. Cambridge: Cambridge University Press
Kou L H, Labrie D, Chylek P, 1993. Refractive indices of water and ice in the 0.65 to 2.5-μm spectral range. Appl Opt,32(19): 3531—3540
Marshall B R, Smith R C, 1990. Raman scattering and in-water ocean optical properties. Appl Opt, 29(1): 71—84
Mobley C D, 1994. Light and Water: Radiative Transfer in Natural Waters. San Diego, Calif: Academic Press, 592
Morel A, Prieur L, 1977. Analysis of variations in ocean color.Limnol Oceanogr, 22(4): 709—722
Moses W J, Gitelson A A, Berdnikov S et al, 2012. Operational MERIS-based NIR-red algorithms for estimating chlorophyll-a concentrations in coastal waters-The Azov Sea case study. Remote Sens Environ, 121: 118—124
Neville R A, Gower J F R, 1977. Passive remote sensing of phytoplankton via chlorophyll a fluorescence. J Geophys Res, 82(24): 3487—3493
Pope R M, Fry E S, 1997. Absorption spectrum (380—700nm) of pure water. II. Integrating cavity measurements. Appl Opt,36(33): 8710—8723
Smith R C, Baker K S, 1981. Optical properties of the clearest natural waters (200—800nm). Appl Opt, 20(2): 177—184
Tao B Y, Mao Z H, Pan D L et al, 2013. Influence of bio-optical parameter variability on the reflectance peak position in the red band of algal bloom waters. Ecol Inform, 16: 17—24
Zhou L G, Xu B, Ma W C et al, 2013. Evaluation of hyperspectral multi-band indices to estimate chlorophyll-a concentration using field spectral measurements and satellite data in Dianshan Lake, China. Water, 5(2): 525—539
