伤寒沙门菌质粒pR ST98对细菌生物膜形成能力及毒力的影响
2016-01-14刘珍,阙凤霞,李嫄渊等
伤寒沙门菌质粒pRST98对细菌生物膜形成能力及毒力的影响
刘珍,阙凤霞,李嫄渊,吴淑燕,黄瑞
(苏州大学医学部病原生物学系,江苏 苏州 215123)
摘要:目的探讨伤寒沙门菌质粒pRST98对鼠伤寒沙门菌和大肠埃希菌生物膜形成能力及毒力的影响。方法将伤寒沙门菌质粒pRST98接合转移导入鼠伤寒沙门菌和大肠埃希菌,制备单个游离悬浮状态下的细菌菌液;将接合导入质粒pRST98前、后的受试菌分别在相同条件下形成生物膜,制备生物膜状态下的菌液。浮游细菌与生物膜形成细菌调节至同一浓度后分别与CT26细胞进行黏附侵袭、血清杀菌以及抗巨噬细胞吞噬实验,比较不同状态下受试菌毒力的差异。结果伤寒沙门菌质粒pRST98能够促进鼠伤寒沙门菌和大肠埃希菌形成生物膜;黏附实验显示除大肠埃希菌外,鼠伤寒沙门菌在生物膜状态下对CT26细胞的黏附力明显增强,形成生物膜的细菌对CT26细胞的侵袭力明显下降;生物膜状态的鼠伤寒沙门菌和大肠埃希菌在兔血清和豚鼠血清中的存活率均高于浮游状态;生物膜状态下的鼠伤寒沙门菌在巨噬细胞内的存活率明显高于浮游状态下的细菌。结论质粒pRST98能够促进鼠伤寒沙门菌和大肠埃希菌形成生物膜;生物膜的形成能促进细菌对细胞的黏附,同时抑制细菌对细胞的侵袭力;增强细菌抵抗血清杀菌及巨噬细胞吞噬的能力。
关键词:伤寒沙门菌,质粒pRST98;鼠伤寒沙门菌;大肠埃希菌;生物膜;毒力
中图分类号:
文章编号:1673-8640(2015)10-1033-06R378.2
文献标志码:A
DOI:10.3969/j.issn.1673-8640.2015.10.017
Abstract:ObjectiveTo investigate the influence of Salmonella typhi plasmid pRST98 on bacterial biofilm formation and virulence. MethodsSalmonella typhi plasmid pRST98 was conjugated into Salmonella typhimurium and Escherichia coli to form Salmonella typhimurium/pRST98 and Escherichia coli/pRST98. These bacteria were cultured under suitable conditions to form biofilm. The planktonic bacteria were prepared. Biofilm bacteria and planktonic bacteria were adjusted to the same concentration then carried on adhesion and invasion experiments with CT26,anti-serum killing experiments and anti-macrophage phagocytosis experiments to compare virulence in different states. ResultsSalmonella typhi plasmid pRST98 can advance biofilm formation of Salmonella typhimurium and Escherichia coli, and biofilm promoted all bacterium adhesion capabilities to CT26 except for Escherichia coli. The biofilm formation of Salmonella typhimurium and Escherichia coli decreased invasion capabilities to CT26 . The survival rates of Salmonella typhimurium and Escherichia coli in biofilm were higher than the bacteria in planktonic states for rabbit serum and guinea pig serum. Salmonella typhimurium survival rate within macrophages in biofilm state was significantly higher than that under planktonic state. Conclusions Plasmid pRST98 can promote the biofilm formation of Salmonella typhimurium and Escherichia coli. Biofilm formation promotes adhesion to cells while inhibiting invasion capability,and enhances anti-serum killing and anti-macrophage phagocytosis.
基金项目:江苏省自然科学基金面上项目(BK2011286)
作者简介:刘珍, 女, 1985年, 硕士, 技士,主要从事细菌生物膜形成的研究。
通讯作者:黄瑞, 联系电话:0512-65880973。
收稿日期:(2014-12-10)
The influence ofSalmonellatyphiplasmid pRST98on bacterial biofilm formation and virulenceLIUZhen,QUEFengxia,LIYuanyuan,WUShuyan,HUANGRui.(DepartmentofPathogenicBiology,MedicalCollege,SoochowUniversity,JiangsuSoochow215123,China)
Key words:Salmonellatyphi; Plasmid pRST98;Salmonellatyphimurium;Escherichiacoli; Biofilm; Virulence

细菌生物膜(biofilm,BF)是指细菌在生长过程中,附着在有生命或无生命体表面形成的由细菌及其分泌的水合性基质所组成的膜样复合物[1]。在微生物感染的防治和研究领域,细菌生物膜已引起临床医生和科研人员的极大关注。据美国国家健康研究所报道,大约80%人类细菌性感染由生物膜中的细菌引起[2]。
鼠伤寒沙门菌是一种常见的人畜共患病原菌[3]。有数据显示沙门菌生物膜与肝癌和胆囊癌的发生有相关性[4];大肠埃希菌黏附于导尿管表面或尿道上皮细胞表面形成生物膜,是导尿管相关尿路感染(catheter-associated urinary tract infection,CAUTI)最重要的原因[5]。
伤寒沙门菌质粒pRST98是本实验室在一次暴发于我国的伤寒流行中分离鉴定的一个独有的伤寒沙门菌质粒。既往研究证实该质粒除编码抗药性外还能增强宿主菌的毒力[6]。此外pRST98还是一种接合性质粒,在自然环境和实验室条件下均可以进入到鼠伤寒沙门菌和大肠埃希菌内,对疾病和耐药性的传播具有非常重要的作用[6]。因此,我们选取这2种细菌作为宿主菌,探索此质粒对宿主细菌生物膜形成能力的影响,同时比较2种细菌在形成生物膜后细菌毒力的差异。
材料和方法
一、菌株与细胞株
鼠伤寒沙门菌标准毒株χ3306(简称χ3306)及弱毒株χ3337(简称χ3337,由χ3306消除其质粒后得到)由美国亚利桑那州立大学生命科学学院的Roy Curtiss Ⅲ教授惠赠;鼠伤寒沙门菌χ3337/pRST98(简称χ3337/pRST98)是将伤寒沙门菌质粒pRST98接合转移导入χ3337中形成的接合子;本实验室保存的大肠埃希菌K12W1485不含质粒,系经实验室诱变仅在染色体上有利福平耐药基因的、无性菌毛的雌性菌(以E.coli表示);将伤寒沙门菌质粒pRST98经接合转移导入E.coli中得到的接合子E.coliK12W1485/pRST98(以E.coli/pRST98表示)。
小鼠结肠癌细胞系CT26细胞购自上海中国科学院细胞库。J774A.1细胞购自上海中国科学院细胞库。
二、主要仪器和试剂
PHILIPS xL-20型扫描电子显微镜(荷兰菲利浦公司);TCS-SP2型共聚焦激光扫描显微镜(德国Leica公司)。兔血清(nomal rabbit serum, NRS)和豚鼠血清(guinea pig serum, GPS)分别分离自5只健康雌兔和5只健康豚鼠的血液,取血后4 ℃静置过夜,离心收集血清,混合过滤除菌并做无菌试验后分装备用。
三、实验方法
1. 伤寒沙门菌质粒pRST98的接合转移质粒pRST98的接合转移参照文献[7]进行。以携带pRST98的耐药伤寒杆菌为供体,χ3337和E.coli为受体,选择培养基为中国蓝培养基含100 μg/mL利福平和供体菌上某一耐药标志的抗菌药物,如20 μg/mL克拉霉素 、15 μg/mL卡那霉素、25 μg/mL四环素、25 μg/mL氨苄西林和25 μg/mL萘夫西林等。将供、受体菌分别接种于3 mL LB肉汤中,37 ℃振荡培养6 h,按等比例接种于0.5 mL新鲜LB肉汤中。由于接合性质粒具有在不同温度时接合频率不同的特点,故选择37 ℃和26 ℃ 2种温度混合培养3 h,取0.1 mL此菌液做适当稀释后均匀涂布于上述相应的选择性中国蓝培养基,并同时作供、受体菌对照。37 ℃培养24或48 h后选择接合子并进行血清学、生化反应鉴定并作药敏试验和质粒电泳检测。比较pRST98结合前、后细菌生物膜的形成情况以及有无生物膜对待检菌毒力和抵抗力的影响。受试菌为导入质粒pRST98前、后的同一株细菌。
2. 浮游细菌的制备将保存于-80 ℃的受试菌接种于3 mL LB液体培养基,37 ℃培养过夜后转移至血平板活化。将细菌接种至SS培养基37 ℃培养过夜,用接种环挑取无色伤寒沙门菌单菌落,分区划线接种于LB固体培养基平板,37 ℃培养过夜,做生化和血清学鉴定后用于实验。每次使用前在LB平板上划线接种后,挑取单个菌落至3 mL LB液体培养基,培养至对数生长期。细菌定量方法参照文献[8]进行。
3. 生物膜状态菌液的制备LB肉汤培养过夜至对数生长期后,在600 nm下测定吸光度(A600 nm)值,检测菌液浓度;同时做平板菌落计数,计算菌落形成单位(colony-forming unit,CFU)。将菌液浓度调整致1×1010CFU/mL,分别将等量待测菌加入含0.1%葡萄糖的LB肉汤后, 加入24孔板,每孔1 mL,24孔板用封口膜密封后培养3 d形成成熟生物膜。
4. 细菌黏附、侵袭力的检测CT26细胞用含10% 胎牛血清的RPMI1640常规培养,胰酶消化后离心,调整细胞浓度为1.5×105CFU/mL,24孔板1 mL/孔,5% CO2、37 ℃平衡12 h待用。浮游细菌在A600 nm下测定菌液浓度,同时做平板菌落计数,计算CFU,调整菌液浓度。生物膜中的细菌使用超声作用20 min,将其中的细菌释放出来,并调整细菌浓度。将受试菌按感染复数(multiplicity of infection,MOI)=100∶1加入细胞培养板,450×g离心10 min,继而在5% CO2、37 ℃条件下共培养1 h,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗3次,加入预冷的细胞裂解液裂解细胞。裂解后的各组细胞做平板菌落计数检测CFU,48 h后观察并计数。细菌黏附力(%)=黏附细菌数/每孔加入细菌总数×100。细菌的侵袭力检测方法基本同上,只是细菌与细胞共同孵育1 h后,弃去菌液并用PBS轻柔洗3遍,然后每孔加入含100 μg/mL阿米卡星的RPMI1640培养液,以杀死未侵入胞内的细菌,作用3 h后按上法进行细胞内活菌计数。细菌侵袭率(%)=细胞内细菌数/细胞内外细菌总数×100。
5. 血清杀菌实验为区别血清杀菌过程中补体经典途径与旁路途径的不同作用,将血清置于50 ℃水浴15 min,以灭活大多数参与旁路途径(another complement pathway, ACP)的成分,并将全血清和1∶10稀释的血清用于实验。将浮游细菌和生物膜状态的细菌调整浓度至1×104CFU/mL。分别吸取浮游菌和来自生物膜中的菌液20 μL,各自加入含0.2 mL相应血清的试管和不含血清的普通肉汤管。根据预实验结果,选37 ℃ 2 h为杀菌的作用条件。用CFU计算存活细菌数。以上实验重复3次,每份样品均做2次,取其平均值。细菌存活率(%)=血清作用后CFU/对照组CFU×100。
6. 抗巨噬细胞吞噬实验将生物膜状态和浮游状态下的受试菌浓度调整至1×107CFU/mL待用。J774A.1细胞用含10%胎牛血清的RPMI1640培养基维持培养(含100 μg/mL链霉素和100 μg/mL青霉素)。实验时用胰酶消化贴壁生长的J774A.1细胞,使其分散,用不含抗菌药物的培养液洗涤细胞3次,血细胞计数板计数后将细胞浓度调整至5×105个/mL,分别加入6孔板,每孔1 mL。37 ℃、5% CO2条件下平衡1 h。将1 mL不同状态的受试菌加入到各孔中,在37℃、5% CO2条件下与细胞共作用1 h。用含100 μg/mL阿米卡星的RPMI1640培养液离心洗涤3次以除去胞外菌,重新悬浮于含100 μg/mL阿米卡星的培养液中,此时定为“0”点,分别于0、10、30和60 min加入预冷的细胞裂解液裂解细胞,做细菌CFU计数。
四、统计学方法
结果
一、 伤寒沙门菌质粒pR ST98对宿主细菌生物膜形成的影响
结晶紫染色实验结果显示,将伤寒沙门菌质粒pRST98接合导入到鼠伤寒沙门菌和大肠埃希菌后,宿主细菌形成生物膜的能力明显增强。与接合前比较差异有统计学意义(P<0.05),见图1。

图1 伤寒沙门菌质粒pR ST98对宿主细菌生物膜形成的影响
二、伤寒沙门菌质粒pR ST98对不同状态下受试菌黏附CT26细胞的影响
分别将浮游状态和生物膜状态下的实验菌株χ3306、χ3337、χ3337/pRST98、E.coli和E.coli/pRST98按MOI=100∶1与CT26细胞共培养,1 h后收集细胞用PBS洗涤,破膜后用平板菌落计数法检测CFU,比较受试菌对细胞的黏附力。结果显示在生物膜状态和浮游状态下,伤寒沙门菌质粒pRST98对宿主细菌的黏附力无明显差异(P>0.05)。除E.coli外,其余几种受试菌在生物膜状态下对细胞的黏附力明显增强,与浮游状态比较差异有统计学意义(P<0.05)。与大肠埃希菌相比,鼠伤寒沙门菌对CT26细胞的黏附力更强,见图2。
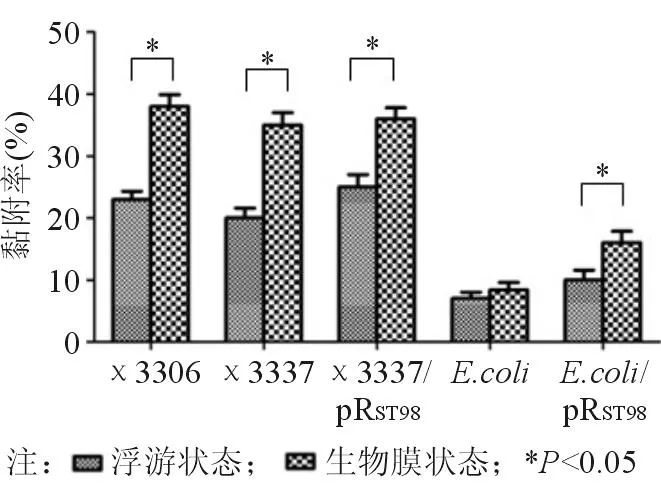
图2 伤寒沙门菌质粒pR ST98对不同状态下受试菌黏附CT26细胞的影响
三、伤寒沙门菌质粒pR ST98对不同状态下受试菌侵袭CT26细胞的影响
伤寒沙门菌质粒pRST98在生物膜和浮游状态下对宿主菌侵袭CT26细胞的能力均无明显影响,生物膜的形成能抑制各受试菌对CT26细胞的侵袭能力。生物膜状态的鼠伤寒沙门菌对细胞的侵袭力与浮游状态相比明显下降(P<0.01),大肠埃希菌在生物膜状态下对细胞的侵袭力也低于浮游状态(P<0.05)。见图3。

图3 伤寒沙门菌质粒pR ST98对不同状态下受试菌侵袭CT26细胞的影响
四、伤寒沙门菌质粒pR ST98对不同状态下受试菌抗血清杀菌能力的影响
χ3337/pRST98无论是浮游状态还是生物膜状态,其抗兔血清和豚鼠血清杀菌能力均明显高于χ3337(P均<0.05)。由此可见,伤寒沙门菌质粒pRST98能明显提高宿主细菌不同状态下的抗血清杀伤能力。生物膜状态下的χ3306、χ3337和χ3337/pRST98在兔血清和豚鼠血清中的存活率均高于浮游状态的细菌(P<0.05),见图4、图5。
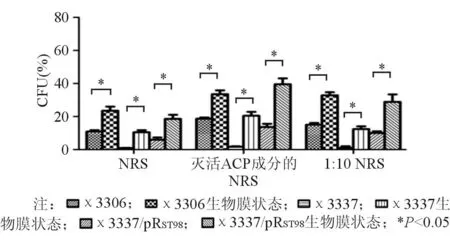
图4 伤寒沙门菌质粒pR ST98对不同状态下受试菌兔血清杀菌抵抗力的影响
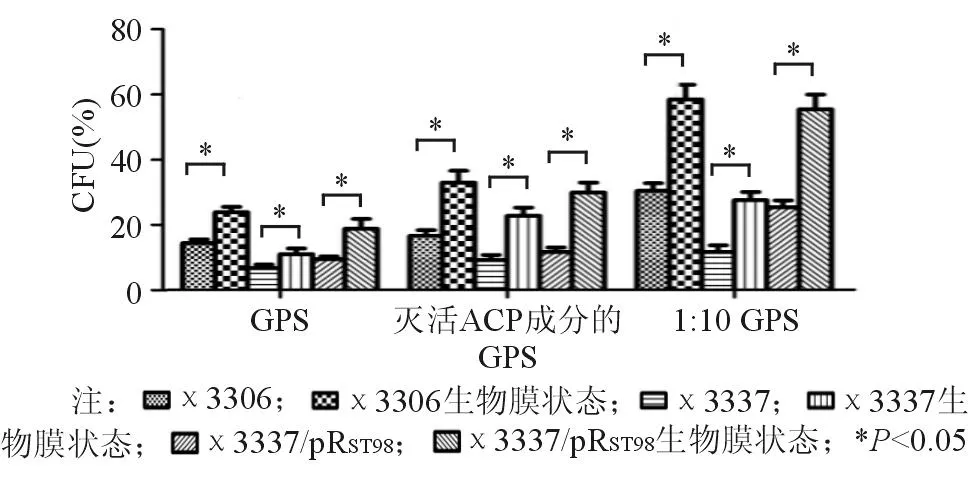
图5 伤寒沙门菌质粒pR ST98对不同状态下受试菌豚鼠血清杀菌抵抗力的影响
无论是在浮游状态还是生物膜状态下,E.coli/pRST98抗兔血清和豚鼠血清杀菌能力均明显高于E.coli,说明伤寒沙门菌质粒pRST98能明显提高大肠埃希菌抗血清杀伤能力。生物膜状态的E.coli和E.coli/pRST98在兔血清和豚鼠血清中的存活率均高于浮游状态(P<0.05),见图6。
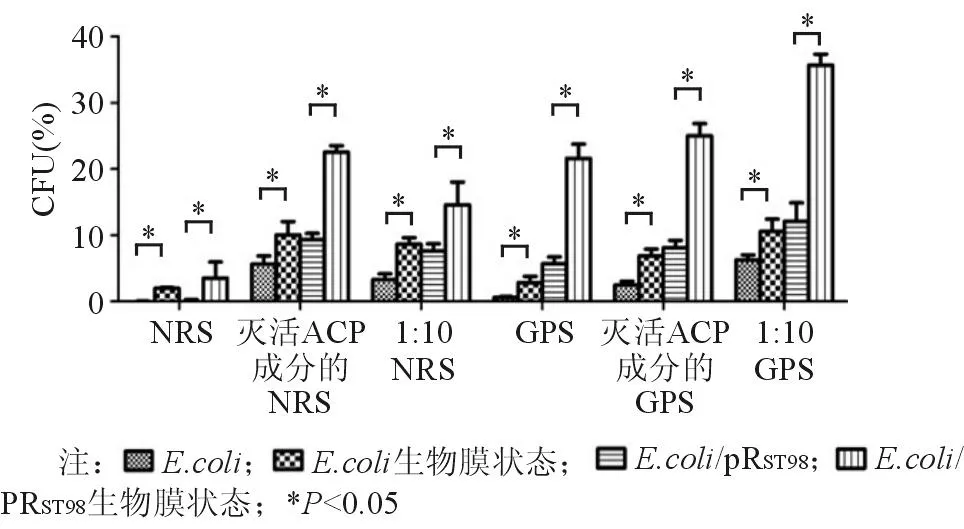
图6 伤寒沙门菌质粒pR ST98对不同状态下 E. coli抗血清杀菌能力的影响
五、伤寒沙门菌质粒pR ST98对不同状态下的受试菌抗巨噬细胞吞噬作用的影响
在不同时间点,巨噬细胞内鼠伤寒沙门菌数量不一;且随着时间延长,细胞内的活菌数量下降。生物膜状态下的鼠伤寒沙门菌在巨噬细胞内的存活率明显高于浮游状态(P<0.05)。说明在生物膜状态下,细菌抗巨噬细胞吞噬能力增强。在不同状态下和各时间点,χ3337/pRST98在巨噬细胞内的存活率均高于χ3337(P<0.05)。说明伤寒沙门菌质粒pRST98在浮游状态和生物膜状态下均能促进宿主菌抵抗巨噬细胞吞噬的能力。见图7。
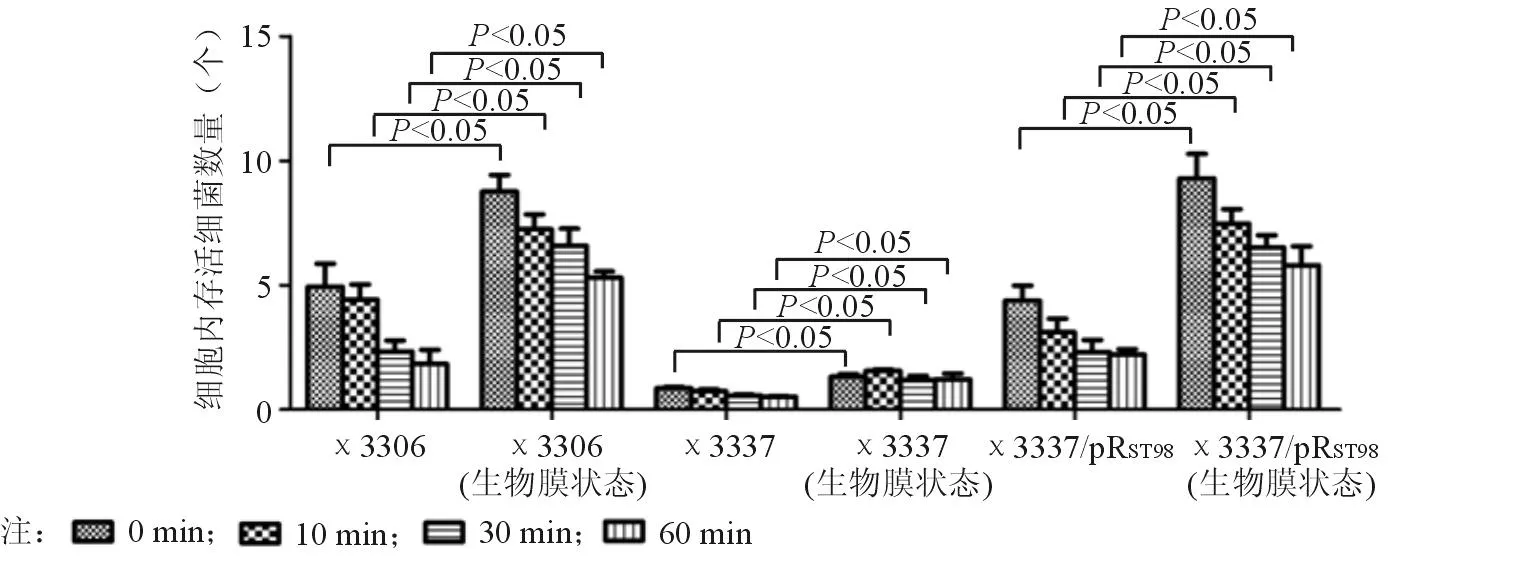
图7 伤寒沙门菌质粒pR ST98对不同状态下鼠伤寒沙门菌抵抗巨噬细胞吞噬杀伤的影响
讨论
伤寒沙门菌质粒pRST98能明显促进鼠伤寒沙门菌和大肠埃希菌在实验室条件下形成生物膜。既往研究已经证实接合性质粒能促进多种细菌形成生物膜。本研究首次在鼠伤寒沙门菌中证实此联系。另外与大肠埃希菌相比,鼠伤寒沙门菌形成生物膜的能力较强。宿主菌的遗传背景影响了接合性质粒促进细菌形成生物膜的过程。
伤寒沙门菌质粒pRST98不仅能促进游离状态宿主细菌的毒力,也能促进生物膜状态下宿主细菌抗血清杀菌和抗巨噬细胞吞噬的能力。有文献[9]报道,除伤寒沙门菌外所有致病沙门菌均有约8 Kb的与细菌血清抗性、黏附和定居有关的高度保守序列——沙门菌质粒毒力(Salmonellaplasmid virulence,spv)基因。伤寒沙门菌质粒pRST98上存在与spv基因中spvR和spvB同源性达99.6%的毒力基因片段。既往研究证实伤寒沙门菌质粒pRST98能促进宿主细菌形成生物膜,生物膜的形成有利于接合性质粒在不同宿主菌之间的接合转移[10]。 这两方面可以互相影响,彼此促进,加剧感染和疾病。
本研究结果显示细菌生物膜的形成能明显影响细菌的黏附侵袭、抗血清杀菌和抵抗巨噬细胞吞噬能力。菌毛是细菌生物膜的重要组分,这可能导致本研究中生物膜状态下的鼠伤寒沙门菌χ3306、χ3337、χ3337/pRST98和E.coli/pRST98对CT26细胞的黏附力明显增高。但是E.coli在两种状态下对细胞的黏附力无明显差异,这可能与E.coli的弱毒性相关。
有研究报道,细菌csgD基因的表达能抑制沙门菌1型Ⅲ型分泌系统效应蛋白如SopE2 和 SipA的表达,而csgD基因是细菌生物膜形成的关键基因[11]。CRULL等[12]在小鼠模型中发现,生物膜的形成能抑制鼠伤寒沙门菌侵袭肿瘤细胞。本研究在体外细胞模型中也证实了鼠伤寒沙门菌和大肠埃希菌在生物膜状态对细胞的侵袭力明显降低。在两种不同的状态下,与大肠埃希菌相比,鼠伤寒沙门菌对CT26细胞的侵袭力更高。这是因为CT26细胞是小鼠结肠癌细胞,鼠伤寒沙门菌对其亲和力较强。探讨不同状态下细菌对细胞黏附及侵袭性的差异在利用细菌作为工具开发抗肿瘤治疗方案的领域具有重要的意义。
生物膜的形成可以诱导微生物某些重要基因的表达发生改变,以适应不利的环境压力[13]。大肠埃希菌的基因表达分析显示,生物膜能促进细菌中某些毒力基因的表达[14]。位于鼠伤寒沙门菌2型毒力岛上的毒力基因sipA的表达随着生物膜的形成而增加。而此基因突变会影响沙门菌生物膜的形成量。这说明了生物膜与细菌毒力之间有密切的联系。铜绿假单胞菌作为研究生物膜的代表细菌,已有充分数据说明生物膜状态和浮游状态下的铜绿假单胞菌的表型有明显差异[15]。
细菌生物膜形成导致毒力产生变化,使人体的免疫系统不能有效地清除相关病原菌,导致某些部位出现迁延难治的感染症状。基因水平的研究结果显示,与浮游状态相比,生物膜状态下某些毒力基因的表达增加;而且在生物膜形成进程中可以发现,随着生物膜的成熟,毒力基因的表达量呈上升趋势[16]。另一种解释是细菌生物膜的形成可能导致细菌某些病原相关抗体的隐藏,从而导致机体免疫系统不能及时发现病原菌并对其进行攻击杀伤。研究从慢性生物膜感染患者体内分离到的细菌发现,这些细菌失去了鞭毛和菌毛等。在体外成熟的铜绿假单胞菌生物膜中分离到的铜绿假单胞菌也具有同样的特征。细菌的这些变异是导致毒力差异的原因[17]。
参考文献
[1]BROWNE SH,HASEGAWA P,OKAMOTO S,et al. Identification ofSalmonellaSPI-2 secretion system components required for SpvB-mediated cytotoxicity in macrophages and virulence in mice [J]. FEMS Immunol Med Microbiol,2008,52(2): 194-201.
[2]LI H,XU H,ZHOU Y,et al. The phosphothreonine lyase activity of a bacterial type Ⅲ effector family [J]. Science,2007,315(5814): 1000-1003.
[3]JANTSCH J,CHIKKABALLI D,HENSEL M. Cellular aspects of immunity to intracellularSalmonellaenterica[J]. Immunol Revi,2011,240(1):185-195.
[4]GONZALEZ-ESCOBEDO G,MARSHALL JM,GUNN JS. Chronic and acute infection of the gall bladder bySalmonellatyphi: understanding the carrier state [J]. Nat Rev Microbiol,2011,9(1):9-14.
[5]TOVAL F,KÖHLER CD,VOGEL U,et al. Characterization ofEscherichiacoliisolates from hospital inpatients or outpatients with urinary tract infection [J]. J Clini Microbiol,2014,52(2):407-418.
[6]黄瑞, 吴淑燕,闻玉梅. 伤寒杆菌耐药质粒pRST98介导细菌毒力的研究[J]. 中华微生物学与免疫学杂志,2001,21(3):302-305.
[7]ROE DE,WEINBERG A,ROBERTS MC. Mobile rRNA methylase genes coding for erythromycin resistance inActinobacillusactinomycetemcomitans[J]. J Antimicrob Chemother,1996,37(3): 457-464.
[8]PARK JM,GRETEN FR,LI ZW,et al. Macrophage apoptosis by anthrax lethal factor through p38 MAP kinase inhibition [J]. Science,2001,297(5589): 2048-2051.
[9]YGBERG SE,CLEMENTS MO,RYTKÖNEN A,et al. Polynucleotide phosphorylase negatively controls spv virulence gene expression inSalmonellaenterica[J]. Infect Immun,2006,74(2): 1243-1254.
[10]MADSEN JS,BURMØLLE M,HANSEN LH,et al. The interconnection between biofilm formation and horizontal gene transfer [J]. FEMS Immunol Med Microbiol,2012,65(2):183-195.
[11]MIKA F,HENGGE R. Small regulatory RNAs in the control of motility and biofilm formation inE.coliandSalmonella[J]. Int J Mol Sci,2013,14(3):4560-4579.
[12]CRULL K,ROHDE M,WESTPHAL K,et al. Biofilm formation bySalmonellaentericaserovar Typhimurium colonizing solid tumours [J]. Cell Microbiol,2011,13(8):1223-1233.
[13]LIU Z,NIU H,WU S,et al. CsgD regulatory network in a bacterial trait-altering biofilm formation [J]. Emerg Microbes Infect,2014,3(1): e1.
[14]AL SAFADI R,ABU-ALI GS,SLOUP RE,et al. Correlation between in vivo biofilm formation and virulence gene expression inEscherichiacoliO104:H4 [J]. PLoS One,2012,7(7):e41628.
[15]JAIN R,BEHRENS AJ,KAEVER V,et al. Type Ⅳ pilus assembly inPseudomonasaeruginosaover a broad range of cyclic di-GMP concentrations [J]. J Bacteriol,2012,194(16):4285-4294.
[16]MONTEIRO C,FANG X,AHMAD I,et al. Regulation of biofilm components inSalmonellaentericaserovar Typhimurium by lytic transglycosylases involved in cell wall turnover [J]. J Bacteriol, 2011,193(23):6443-6451.
[17]SAUER K,CAMPER AK,EHRLICH GD,et al.Pseudomonasaeruginosadisplays multiple phenotypes during development as a biofilm [J]. J Bacteriol,2002,184(4):1140-1154.
(本文编辑:龚晓霖)
