金属离子介导下欧前胡素和异欧前胡素与人血白蛋白的相互作用
2016-01-13仝月菊,郝娟,付正卿等
金属离子介导下欧前胡素和异欧前胡素与人血白蛋白的相互作用
仝月菊,郝娟,付正卿,王娟,韩冬,张爱平
(山西医科大学药学院,山西 太原 030001)
摘要:目的在模拟人体生理条件下,获得7种金属离子介导下,欧前胡素和异欧前胡素与人血白蛋白(HSA)相互作用的荧光猝灭强度、结合位点数、结合常数、作用力类型及对其空间构象的影响。方法采用荧光光谱法和同步荧光光谱法结合,研究金属离子介导下,欧前胡素和异欧前胡素与HSA的相互作用。结果金属离子介导下,欧前胡素和异欧前胡素对HSA的荧光猝灭增强,同时结合作用增强。作用力主要为氢键和范德华力,不同金属离子介导下其作用力类型不变,但作用力强弱有所改变。对于欧前胡素作用力顺序为:Mg2+>Cu2+>Ni2+>Co2+>Zn2+>Fe3+>Al3+,异欧前胡素作用力顺序为:Cu2+>Zn2+>Fe3+>Co2+>Mg2+>Al3+>Ni2+。同步荧光光谱结果显示金属离子介导下,欧前胡素和异欧前胡素与HSA相互作用后,HSA的构象均发生改变。结论金属离子的存在促进欧前胡素和异欧前胡素与人血白蛋白相互作用。
关键词:金属离子;人血白蛋白;欧前胡素;异欧前胡素;荧光光谱法;同步荧光光谱法
基金项目:山西省自然科学基金资助项目(No.2010011048-1);山西医科大学科技创新基金(No.01200806)
作者简介:仝月菊,女,研究方向:药物小分子与生物大分子的相互作用,E-mail:minfriendtong@163.com
通讯作者:张爱平,女,教授,研究方向:药物小分子与生物大分子的相互作用,Tel:13834679353,E-mail:zhangap1@163.com
中图分类号:R285.5文献标识码:A
The interaction of imperatorin and isoimperatorin with HSA in the presence of metal Ions
TONGYue-ju,HAOJuan,FUZheng-qing,WANGJuan,HANDong,ZHANGAi-ping
(DepartmentofPharmacy,ShanxiMedicalUniversity,Taiyuan030001,China)
Abstract:ObjectiveTo obtain the intensity of fluorescence quenching,binding-site number,binding constant,the influence of reaction type and its effect on the space conformation under simulated human physiological conditions.MethodsThe interaction of imperatorin and isoimperatorin with human serum albumin (HSA) were investigated using the fluorescence spectroscopy and synchronous fluorescence spectroscopy in the presence of metal ions.ResultsImperatorin and isoimperatorin enhanced the fluorescence quenching of HSA in the presence of metal ions,as well as conjugation.The hydrogen bond and vander waals force were the major driving force between the imperatorin,imperatorin and HSA.Their strength of force was changed,but the type of driving force unchanged in the presence of different metal ions.For the imperatorin,the order of force strength was Mg2+>Cu2+>Ni2+>Co2+>Zn2+>Fe3+>Al3+,for isoimperatorin,the order was Cu2+>Zn2+>Fe3+>Co2+>Mg2+>Al3+>Ni2+.The results of synchronous fluorescence spectroscopy indicated that the conformation of HSA was changed by imperatorin or isoimperatorin in the presence of metal ions.ConclusionThe presence of metal ions promoted the imperatorin and isoimperatorin interact with human serum albumin.
Key words:Metal ions;Human serum albumin;Imperatorin;Isoimperatorin;Fluorescence spectroscopy;Synchronous fluorescence spectroscopy
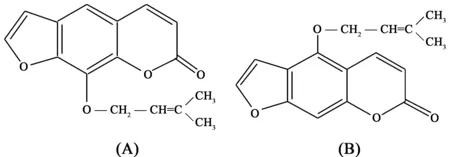
图1 欧前胡素(A)和异欧前胡素(B)的结构
欧前胡素(imperatorin)和异欧前胡素(isoimperatorin) 均具有抗病毒、抗肿瘤和抗炎等作用,只是二者药效强弱不同[1~3],其结构式见图1。欧前胡素和异欧前胡素进入人体后首先与人血白蛋白(HSA)结合,进而影响其在人体内的吸收、分布、转运和代谢[4]。然而人体是一个复杂的生命体系,其中含有多种金属离子,这些金属离子既可与欧前胡素或异欧前胡素结合,又会与人血白蛋白结合,进而影响其相互作用。因此有关金属离子介导下对欧前胡素和异欧前胡素与人血白蛋白的相互作用越来越受到关注。开展欧前胡素/异欧前胡素-金属离子-HSA三元体系的研究对于指导患者合理用药及对新药的设计研究与开发等均具有重要的指导意义[5~8]。
本实验在模拟人体生理条件下,以Mg2+等7种金属离子为研究对象,采用荧光光谱法与同步荧光光谱法,考察金属离子介导下,欧前胡素及异欧前胡素与人血白蛋白的相互作用。
1材料与方法
1.1实验仪器与试剂
1.1.1仪器Cary Eclipse荧光光度计 (Peltier电子恒温装置,美国Varian公司);TU-1901紫外可见分光光度计 (北京普析通用仪器有限责任公司);AL-104型电子天平[Mettler Toledo 仪器 (上海) 有限公司];pHS-3C型酸度计(上海雷磁仪器厂)。
1.1.2试剂欧前胡素、异欧前胡素(纯度≥98%,成都曼思特生物科技有限公司,批号:A0011、A0012);其他试剂均为分析纯,实验用水为二次蒸馏水。
1.2实验方法
1.2.1溶液配制配制Tris-HCl 缓冲溶液 (pH 7.40,内含0.10 mol·L-1的NaCl),用该缓冲溶液配制2.02×10-4mol·L-1HSA储备液;用甲醇配制 1.96×10-3mol·L-1欧前胡素储备液和 2.07×10-3mol·L-1异欧前胡素储备液,用时根据需要稀释。
1.2.2荧光光谱的测定将欧前胡素或异欧前胡素与金属离子按物质的量之比1∶1配成二元体系(欧前胡素/异欧前胡素-Mn+)溶液,移取2.02×10-6mol·L-1HSA溶液2.0 mL于1 cm石英池中,用二元体系溶液对HSA溶液进行荧光滴定,差减相应的欧前胡素或异欧前胡素的光谱,在Cary Eclipse荧光光度计上记录290~500 nm波长范围内的发射光谱。
固定HSA溶液的浓度,逐渐滴加二元体系(欧前胡素/异欧前胡素-Mn+)溶液,差减相应浓度的欧前胡素或异欧前胡素的光谱,分别在Δλ=15 nm和Δλ=60 nm下扫描荧光激发光谱,得到HSA中酪氨酸残基和色氨酸残基的同步荧光光谱。
2结果
2.1金属离子介导下欧前胡素和异欧前胡素对HSA的荧光猝灭固定HSA的浓度为2.02×10-6mol·L-1,将欧前胡素或异欧前胡素与金属离子按物质的量之比1∶1配成二元体系(欧前胡素/异欧前胡素-Mn+)溶液,逐渐滴加二元体系溶液,用pH 为7.40的Tris-HCl缓冲溶液定容,摇匀,差减相应浓度的欧前胡素或异欧前胡素的光谱,在290~500 nm范围内扫描荧光发射光谱,以Mg2+为代表附图,结果见图2,其余金属离子的荧光猝灭光谱图与之类似,本文所用荧光强度均为考虑稀释效应后的值。

图2 Mg 2+介导下,欧前胡素和异欧前胡素对HSA猝灭荧光光谱图
注:CHSA:2.02×10-6mol·L-1,C欧前胡素/异欧前胡素=Mg2+(a→i):0.00、0.20、0.40、0.58、0.95、1.31、1.65、2.14、2.61(×10-6mol·L-1)
由图2可知,Mg2+介导下,随着欧前胡素或异欧前胡素溶液浓度的增加,HSA的内源荧光强度均有规律地降低,但发射峰位和峰型基本不变[9],说明金属离子的存在使得两种呋喃香豆素类药物对HSA的荧光猝灭作用增强。
2.2金属离子介导下,欧前胡素和异欧前胡素与HSA作用的结合位点数和结合常数的确定在静态猝灭[10]作用中,荧光强度与猝灭剂的关系可由公式(2-1)表示[11]:
lg (F0-F)/F= lgK+nlg[Q]
(2-1)
F0和F分别为人血白蛋白和药物作用前后的荧光强度,[Q]为药物的浓度,K表示药物与人血白蛋白相互作用的结合常数。
以lg(F0-F)/F对lg[Q]作图,结果见图3,以Mg2+为代表附图,其余离子的双对数图与之类似。

图3 Mg 2+介导下,不同温度下欧前胡素和异欧前胡素 对HSA的双对数图(a:298K;b:303K;c:308 K)
由图3中直线的斜率和截距可求出,Mg2+介导下,欧前胡素和异欧前胡素与HSA分子的结合位点数n和结合常数K,同理也可求出其他金属离子介导下的结合位点数n和结合常数K,结果见表1。

表1 7种金属离子介导下,欧前胡素和异欧前胡素
由表1可知,金属离子介导下,欧前胡素和异欧前胡素与HSA作用结合位点数均接近于1,结合常数均增大,但不同金属离子介导下作用力强弱有所不同。对于欧前胡素其作用力顺序为:Mg2+>Cu2+>Ni2+>Co2+>Zn2+>Fe3+>Al3+>空白,对于异欧前胡素其作用力顺序为:Cu2+>Zn2+>Fe3+>Co2+>Mg2+>Al3+>Ni2+>空白。
在欧前胡素(异欧前胡素)-Mn+-HSA三元体系中,金属离子可能通过以下4种途径参与欧前胡素(异欧前胡素)与HSA的结合过程(见图4)。
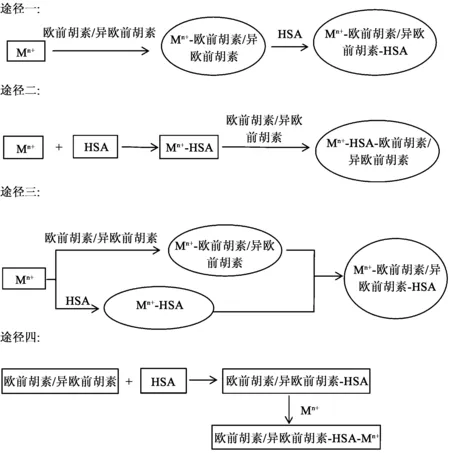
图4 金属离子参与欧前胡素/异欧前胡素 与HSA的结合模式
以上4种过程体现了欧前胡素(异欧前胡素)-Mn+-HSA相互作用过程中Mn+的可能参与途径。
2.3金属离子介导下,欧前胡素和异欧前胡素与HSA结合的热力学参数和作用力类型的确定药物等小分子和蛋白质等生物大分子之间的结合力主要有疏水作用力、氢键、范德华力和静电引力[12]等,不同药物与蛋白的结合力类型是不同的。当温度变化不大时,反应的焓变ΔH可视为常数,根据热力学公式[13]可计算药物小分子与生物大分子结合过程的有关热力学参数。
ln(K2/K1)=ΔH(1/T1-1/T2)/R
(2-2)
ΔG=-RTlnK
(2-3)
ΔS=(ΔH-ΔG)/T
(2-4)
可分别得到不同温度下药物与人血白蛋白相互作用的焓变ΔH、熵变ΔS和生成自由能变ΔG。
根据药物与蛋白相互作用的相关热力学参数,可以判断二者的作用力类型。若ΔH>0,ΔS<0,则分子间作用力主要为静电作用和疏水作用力;若ΔH<0,ΔS<0,分子间作用力主要为范德华力和氢键;若ΔH<0,ΔS>0,则分子间作用力主要为静电作用力;若ΔH>0,ΔS>0,分子间作用力主要为疏水作用力[14]。
金属离子介导下,欧前胡素和异欧前胡素与HSA的热力学参数见表2。
由表2知,ΔH、ΔS均小于0,表明金属离子存在时,欧前异欧前胡素与HSA的相互作用力类型没有改变,均为范德华力和氢键。
2.4金属离子介导下,欧前胡素和异欧前胡素对HSA构象的影响蛋白质的荧光主要来自色氨酸和酪氨酸残基。当Δλ=15 nm时,所得同步荧光光谱只显示酪氨酸残基的特征荧光;Δλ=60 nm时,所得同步荧光光谱只显示色氨酸残基的特征荧光[15,16]。而色氨酸、酪氨酸残基的最大发射波长与其所处的微环境密切相关,据此考察蛋白质构象变化情况。
固定HSA的浓度,逐渐增加二元体系(欧前胡素/异欧前胡素-Mn+)溶液,分别固定Δλ=15 nm和Δλ=60 nm,可得HSA中酪氨酸和色氨酸残基的同步荧光光谱,实验结果表明,欧前胡素和异欧前胡素与HSA在不同金属离子的介导下所得的同步荧光光谱图相似,故以Mg2+为代表附图,结果见图5。

表2 七种金属离子对欧前胡素和异欧前胡素与HSA热力学参数的影响
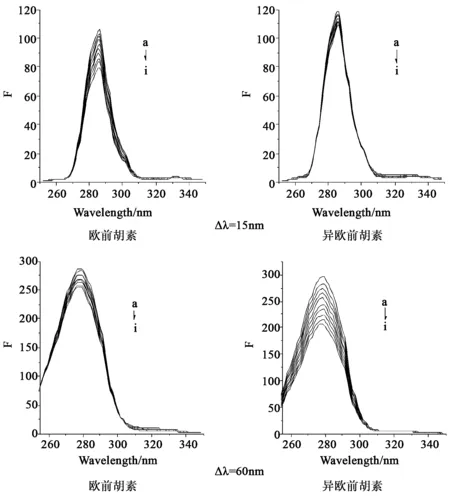
图5 Mg 2+介导下,欧前胡素和异欧前胡素 与HSA作用的同步荧光光谱图
注:CHSA:2.02×10-6mol·L-1,C欧前胡素/异欧前胡素=Mg2+(a→i):0.00、0.20、0.40、0.58、0.95、1.31、1.65、2.14、2.61(×10-6mol·L-1)
图5结果显示,金属离子介导下,HSA中酪氨酸和色氨酸残基的荧光同时被淬灭,其中色氨酸残基的荧光强度降低更显著,推测欧前胡素和异欧前胡素与HSA的结合位点更接近色氨酸残基。同时HSA中色氨酸和酪氨酸的最大发射波长均发生红移,表明欧前胡素和异欧前胡素的加入均使HSA中色氨酸残基附近的极性增强,疏水性环境减弱,肽链的伸展程度有所增加,即加入金属离子后,欧前胡素和异欧前胡素与HSA相互作用,HSA的构象均发生变化。
3讨论
本实验研究结果表明7种金属离子的介导促进了欧前胡素及异欧前胡素与HSA的相互结合,但不同金属离子介导下其相互作用力的强弱不同:对于欧前胡素其作用力顺序为:Mg2+>Cu2+>Ni2+>Co2+>Zn2+>Fe3+>Al3+>空白,对于异欧前胡素其作用力顺序为:Cu2+>Zn2+>Fe3+>Co2+>Mg2+>Al3+>Ni2+>空白。由此可知:7种金属离子介导下,欧前胡素/异欧前胡素-Mn+-HSA的结合常数均增大,即K(欧前胡素/异欧前胡素-Mn+-HSA>K(空白),表明金属离子促进了欧前胡素和异欧前胡素与人血白蛋白的相互作用,推测金属离子可能以途径三参与其相互作用,起“离子架桥”的作用[17],促进欧前胡素和异欧前胡素与HSA的结合,使得欧前胡素、异欧前胡素在血浆中潴留时间相应延长,释放更缓慢,可减小其毒副作用。
不同金属离子介导下,欧前胡素/异欧前胡素-Mn+-HSA的作用力强弱不同,即结合常数大小不同,也可以看做是稳定性不同。
第一过渡系二价金属离子形成配合物的稳定性顺序为Zn2+>Cu2>Ni2+>Co2+>Fe2+,此为Irving-Williams序列[18],欧前胡素-Mn+-HSA三元体系的稳定性顺序基本与其一致,由金属离子介导下,欧前胡素与HSA作用强弱顺序可知,Mg2+与欧前胡素和人人血白蛋白的结合能力较强,即Mg2+介导下,可以促进欧前胡素与HSA的结合作用,也就是说可以延长其在人体内的作用时间,而Mg2+和欧前胡素均对心脑血管疾病的防治有着重要的作用[19],因此在服用此类药物时,应注意对Mg2+的摄取量,使其既能发挥最大药效,又能避免其毒副反应。
对于异欧前胡素,其稳定性顺序不符合Irving-Williams序列,推测可能是Fe3+的3d5半满和Cu2+、Zn2+3d10全满均为稳定状态,二者受配位场的影响较小,因此作用力比较强。Al3+对欧前胡素和异欧前胡素与HSA结合作用的影响均较小,但Al3+对于人体有害,应该尽量避免其摄入。
相同金属离子介导下,其对欧前胡素和异欧前胡素与HSA的促进作用也不相同。由表1知,Mg2+、Co2+、Fe3+、Ni2+对欧前胡素与HSA结合的促进作用较异欧前胡素与HSA结合的促进作用强,而Zn2+、Cu2+、Al3+则恰好相反。7种金属离子中,Mg2+和Ni2+两种金属离子介导对欧前胡素和异欧前胡素与HSA的结合促进作用差异较大,而Cu2+的介导对两种药物与HSA相互作用结合促进作用相差不大。
参考文献:
[1] 杨小花,胡晓.欧前胡素和异欧前胡素的药理学研究进展[J].南昌大学学报(医学版),2012,52(3):95-97.
[2] 胡华杰,楼召欢,吕圭源,等.HPLC法测定不同产地白芷饮片中欧前胡素和异欧前胡素的含量[J].浙江中医药大学学报,2010,34(3):418-419.
[3] 张爱平,郝娟,黄茜,等.欧前胡素及同分异构体与DNA的作用机理及构效关系研究[J].分子科学学报,2012,28(1):36-42.
[4] 王宁,刘忠英,胡秀丽,等.黄芩类药物与人血清白蛋白的相互作用[J].高等学校化学学报,2011,32(2):241-245.
[5] Zhang GW,Chen XX,Guo JB,et al.Spectroscopic investigation of the interaction between chrysie and bovine serum albumin[J].J Mol Struct,2009,921(1-3):346-351.
[6] Zhang YH,Yue YY,Li JZ,et al.Studies on the interaction of caffeic acid with human serum albumin in membrane mimetic environments[J].J Photochem Photobiol B,2008,90(3):141-151.
[7] 张海蓉,边贺东,潘英明,等.光谱法研究儿茶素与牛血清白蛋白的相互作用[J].光谱学与光谱分析,2009,29(11):3052-3056.
[8] Faizul FM,Kadir HA,Tayyab S.Spectroscopic studies on the binding of bromocresol purple to different serum albumins and its bilirubin displacing action[J].J Photochem Photobiol B,2008,90(1):1-7.
[9] 屈冉,张骁,张鹏.L-瓜氨酸与牛血清白蛋白相互作用的研究[J].北京化工大学学报(自然科学版),2012,39(1):77-82.
[10] 王迎进,张艳青,李亚雄,等.光谱法研究根皮苷与人血清白蛋白的相互作用[J].分析测试学报,2013,32(2):239-243.
[11] 袁道琴,冯素玲,崔凤灵.甘草酸二铵与牛血清白蛋白相互作用的光谱[J].应用化学,2009,26(8):918-922.
[12] 何文英,史载锋,陈光英,等.光谱法与分子模拟表征2种呫吨酮类化合物键合人血清白蛋白[J].药物分析杂志,2011,31 (1):59-65.
[13] 谢孟峡,徐晓云,王英典,等.4′,5,7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究[J].化学学报,2005,63 (22):2055-2062.
[14] 迟燕华,庄稼,丁飞.血清白蛋白与巴比妥钠相互作用的光谱研究[J].分析测试学报,2007,26(5):658-661.
[15] Bi SY,Pang B,Wang TJ,et al.Investigation on the interactions of clenbuterol to bovine serum albumin and lysozyme by molecular fluorescence technique[J].Spectrochim Acta A Mol Biomol Spectrosc,2014,120:456-461.
[16] Bhogale A,Patel N,Sarpotdar P,et al.Systematic investigation on the interaction of bovine serum albumin with ZnO nanoparticles using fluorescence spectroscopy[J].Colloids Surf B Biointerfaces,2013,102:257-264.
[17] Liu XF,Xia YM,Fang Y.Effect of metal ions on the interaction between bovine serum albumin and berberine chloride extracted from a traditional Chinese Herb coptis chinensis franch[J].J Inorg Biochem,2005,99(7):1449-1457.
[18] 刘雪峰,李磊,方云,等.中草药成分七叶内酯-BSA-金属离子的相互作用[J].化学研究与应用,2007,19(2):145-149.
[19] 洪炳哲,朴海南,李胜范,等.血管内皮生成因子165诱导血管形成中镁离子作用的研究[J].中华心血管病杂志,2007,35(3):260-264.
