短时间机械循环压力对3D培养脊柱终板软骨细胞的影响
2016-01-11张巍,徐宏光,俞云飞
短时间机械循环压力对3D培养脊柱终板软骨细胞的影响
张巍,徐宏光,俞云飞
(皖南医学院附属弋矶山医院脊柱外科,安徽芜湖241001)
【摘要】目的:探究短时间的机械循环压力对终板软骨细胞的影响,并探讨其机制。方法:大鼠终板软骨细胞的分离制备大鼠终板软骨细胞琼脂糖模板进行培养,然后通过FX-5000T对大鼠终板软骨细胞琼脂糖模板加载短时间的机械循环压力。通过活死染色对细胞进行活死分析,通过RT-PCR和Western blotting检测ANK基因表达。通过RT-PCR和ELISA检测TGF-β1的表达。结果:大鼠终板软骨细胞加载短时间的机械循环压力后ANK基因和TGF-β1表达量增加,加载短时间的机械循环压力的实验组跟实验对照组活死染色没有显著改变。结论:短时间的压力刺激下终板软骨ANK基因和TGF-β1表达量上调抑制终板软骨的退变,短时间的压力刺激并不影响终板软件细胞的活死。这个实验结果可能在椎间盘退变的防治中提供一种新的方法。
【关键词】短时间机械循环压力;终板软骨细胞;椎间盘;ANK基因;TGF-β1表达
【文献标识码】【中图号】R 681.5A
DOI【】10.3969/j.issn.1002-0217.2015.01.005
文章编号:1002-0217(2015)01-0030-03
收稿日期:2014-04-05
作者简介:邱钧(1963-),男,副主任医师,(电话)13505531206,(电子信箱)13505531206@163.com.
文章编号:1002-0217(2015)01-0021-05
收稿日期:2014-08-08
作者简介:强娣(1980-),女,住院医师,硕士,(电话)15855971687,(电子信箱)qd-1980@163.com.
Short-term effects on the 3D cultured spinal endplate chondrocytesinvitroby cyclic mechanical stimulationZHANGWei,XUHongguang,YUYunfei
Department of Orthopedic Surgery,Yijishan Hospital,Wannan Medical College,Wuhu 241001,China
Abstract【】Objective: To investigate the mechanisms and short-term impact on the 3D cultured spinal endplate chondrocytes in vitro by exerting cyclic mechanical stimulation.Methods:The endplate chondrocytes were isolated from rats and cultured in agarose constructs for 48 hours.Then FX-5000TTM Flexercell® Tension PlusTM unit was applied to exert short-term cyclic mechanical stimulation on the cultured chondrocytes.Endplate chondrocytes viability was determined with LIVE/DEAD viability/cytotoxicity kit,and ANK gene expression was examined by RT-PCR and Western blot.Both RT-PCR and ELISA were performed to measure TGF-β1 expression.Results:Short-term cyclic mechanical stimulation increased the ANK gene and TGF-β1 expression in rat endplate chondrocytes.Live/Dead assay verified that the non-loading (NC) group and experimental group had no change in viability following the application of short-term cyclic mechanical compression.Conclusion:Short-term cyclic mechanical stimulation increased the ANK gene and TGF-β1 expression in endplate chondrocytes and inhibited the cartilage degeneration of endplate,yet failed to cause viability of the chondrocytes.The findings suggest that this may be a new approach to treatment of the intervertebral disc degeneration.
【Key words】 short-term cyclic mechanical stimulation;end-plate chondrocytes;intervertebral disc degeneration;ANK gene;TGF-β1 expression
椎间盘由椎体间的薄层透明软骨与髓核及纤维环组成,是人体内最大的无血管组织,对维持椎体的正常功能形态和营养交换以及保护椎间盘应对外界力学刺激等方面均起着非常重要的作用。终板软骨途径作为椎间盘的主要营养通路,主要通过椎体的骨髓腔-血窦-软骨终板弥散途径来获取营养。终板途径的营养障碍最终会导致椎间盘的退变[1-2]。在椎间盘退变模型中不稳定的机械刺激作用于颈椎或腰椎可观测到终板软骨的异常钙化,提示终板钙化参与椎间盘退变过程中[3-4]。因此,我们推断椎间盘终板软骨钙化可能与椎间盘所受的力学刺激相关。众所周知,ANK基因作为软骨钙化相关基因对于软骨钙化起着非常重要的作用,而TGF-β1作为细胞的增殖、分化、迁移、凋亡中非常重要的细胞因子,在终板软骨的钙化中也起着重要的作用。我们前期研究发现长时间的间歇循环张力可以通过TGF-β1下调终板软骨ANK基因mRNA和蛋白表达水平[12],而体外短时间张力的机械刺激可以通过TGF-β1-p38-MAPK通路调控终板软骨ANK基因的表达[15],但压力刺激对于其作用仍不明确。因此,在研究中,我们通过观察体外3D培养的终板软骨细胞加载短时间的间歇机械循环压力后TGF-β1及ANK的表达,检测短时间机械刺激对终板软骨细胞钙化的影响。
1材料与方法
1.1材料
1.1.1实验动物10只清洁级SD大鼠,雌雄不限,体质量(160±20)g(上海西普尔-必凯实验动物有限公司),合格证号:SCXK(沪)2003-0004。
1.1.2试剂和仪器胰蛋白酶、Ⅱ型胶原酶(美国Sigma-A1drich),DMEM/F12(美国Hyclone),胎牛血清(美国GlBICO),Cell Counting Kit-8(CCK-8,Dojind),SDS-PAGE凝胶配制试剂盒和ECL发光液(上海碧云天公司),ANK及GAPDH兔抗大鼠多克隆抗体(CST),羊抗兔辣根过氧化物酶lgG(上海碧云天公司),Nano-Drop 2000 (美国Thermo & Scintific)细胞计数仪和TRIzol(美国Invitrogen),实时PCR试剂盒(中国TOYOBO);实时PCR仪(德国RocheLightCycler480)PCR反应体系和反转录试剂盒(美国Fermentas,USA),PCR仪(德国Eppendorf),倒置荧光显微镜TE2000-U(日本 Nikon)牵张力系统Flexcell FX-5000TM(美国 Flexcell International Corporation),BioFlexTM多向加力板(美国Flexcell International Corporation)。
1.2方法
1.2.1大鼠终板软骨细胞的分离与培养取SD大鼠10只。采取断颈法处死,然后浸泡于75%乙醇消毒10 min。以下步骤均超净台中实施,取出整个大鼠脊椎,取下L1~L5,削去髓核及纤维环,提取所有的终板软骨。用含青霉素和链霉素的PBS液(终浓度为青霉素 50 U/mL和链霉50 μg/mL)冲洗 2遍,用眼科剪剪碎,骨块控制在约1 mm×1 mm× 1 mm大小,吸除PBS。用 0.2%的Ⅱ型胶原酶室温消化10 min后,放入37 ℃细胞培养箱中继续消化4 h,收集所有消化液,并用120目不锈钢滤筛网过滤悬浊液,将过滤后的液体离心10 min(1 000 r/min),吸除上清液,并用PBS漂洗2次,加入8 mL含有10%胎牛血清和1%双抗的DMEM/F12完全培养基,细胞计数仪计数。然后将收集的细胞,用DMEM/F12(20%FBS)反复吹打混匀,制成细胞悬液,按2×105/mL密度均匀种植于10 cm2培养皿中,再将其放入37°C、5%CO2培养箱中培养,每2 d换液1次。当培养皿中细胞增殖融合为层时进行传代,细胞传至第二代(P2)后终止传代。吸除所有培养液,并PBS清洗,再取0.25%胰蛋白酶2 mL加入培养皿,37°C孵育1~2 min,后加入10%胎牛血清2 mL以终止胰酶消化,离心10 min(1 000 r/min)收集细胞。
1.2.2 制备大鼠终板软骨细胞琼脂糖模板取收集的P2终板软骨细胞经细胞计数后加入含有1%双抗和0.29 mg/mL谷酰胺的培养基,使琼脂糖溶液在37°C时达到每mL 107个细胞。细胞琼脂糖于室温下在一个专门设计的模具内胶凝10 min,细胞琼脂糖模板(直径8 mm,厚1.5 mm)。
1.2.3细胞的3D培养和加载循环机械压力终极软骨细胞(P2)琼脂糖的模板放置在FlexCell压力专用的加力板中央进行培养48 h后,实验组的软骨细胞琼脂糖模板通过FX-5000T加载1Hz 10%的机械循环压力,分别加载了20 min和40 min。细胞培养于37°C、5%CO2,细胞经机械循环压力加载后收集。
1.2.4ELISA分析收集对照组和加载了机械循环压力的实验组培养板上清液,使用ELISA法进行TGF-β1的检测。
1.2.5细胞活死分析将收集的细胞琼脂糖模板通过丙酮固定后进行蔗糖梯度脱水,将脱水后的终板软骨细胞模板进行O.C.T.包埋后冰切。切片后的细胞通过活死染色进行分析。
1.2.6RNA提取和实时PCR取出加力板内的琼脂糖模板,用PBS冲洗2次,加入Trlzol,按照说明书提取RNA。首先将样品使用玻璃搅拌器短暂搅拌混匀,然后在室温下孵育5 min。加入氯仿混合30 s后,通过离心法(12 000 g,15 min,4°C)将混合物分离成上层水相下层酚氯仿相,上层清液转移到一个新的EP管后,添加异丙醇室温孵育15 min沉淀后离心(12 000 g,10 min,4°C)提取RNA和琼脂糖混合物,75%乙醇清洗和-80°C过夜后室温下晾干,然后加入焦碳酸二乙酯摇匀后离心(12 000 g,15 min,4°C),从琼脂糖中提取出RNA是用于分析基因表达。实时PCR:检测Ⅱ型胶原、Sox-9、蛋白多糖转录因子和Ank的表达变化。
1.2.7Western blotting 检测取出的终板软骨细胞琼脂糖模板用PBS冲洗2次后置于0.125 mol/L Tris-HCl、5%SDS缓冲液、10%2-巯基乙醇、20%蔗糖、0.04%溴酚蓝(每个模板100 μL缓冲液) 中加热至100°C 5 min,后-80°C过夜,过夜后离心(12 000 g,10 min,4°C)分离蛋白溶液。BCA法检测蛋白浓度,SDS-PAGE电泳,用0.22 μm孔径的PVDF膜转膜,5%BSA封闭1 h,一抗4°C过夜,然后用0.05%TBST洗10 min,一共3次;二抗室温孵育1 h,0.05%TBST洗3次,常规ECL发光液显色。
表1实时PCR引物列表
Tab 1Sequences of primers used in the realtime RT-PCR

引物序列(5'→3')产物长度(bp)GAPDH上游:CTCAACTACATGGTCTACATGTTC-CA81下游:CTTCCCATTCTCAGCCTTGACTⅡ型胶原上游:CCTGAAACTCTGCCACCCAG151下游:GTTCTTCCGAGGCACAGTCG蛋白多糖上游:ACACCCCTACCCTTGCTTCT124下游:AAAGTGTCCAAGGCATCCACSox-9上游:CGTCAACGGCTCCAGCA69下游:TGCGCCCACACCATGAANK上游TTCAAGATCCTGGACCGAGTGAC142下游:AGACACCATCCTGGCGAGTTTC
注:ANK 钙化相关蛋白;GAPDH:磷酸甘油醛脱氢酶
1.3统计学分析多组间采用F检验,P<0.05表示有统计学意义。
2结果
2.1细胞活死分析细胞活死染色的结果显示,实验组和对照组终板软骨细胞的存活率没有显著差异(图1)。
2.2ELISA分析对收集的培养板上清液,使用ELISA法进行TGF-β1检测,分别比较实验组与对照组、加载20 min和40 min的机械循环压力的实验组,结果显示短时间的机械循环压力的刺激下终板软骨细胞的TGF-β1的表达量呈上升的趋势(F=22.576 7,P<0.05),见图2。

After the application of ICMC,LIVE/DEAD assay,there is no significant viability of endplate chondrocytes of NC groups,20 min groups and 40 min groups.Original magnification:100×,n=3.NC indicates nonloading;ICMC,intermittent cyclic mechanical compress
图1加载机械循环压力20 min、40 min后,细胞活死染色的倒置相差显微镜×100观察比较(n=3)
Fig 1 The changes of endplate chondrocytes after loading of ICMC

The columns represent themean±SE.*P< 0.05
图2ELISA法检测实验对照组、加载20 min和40 min的机械循环压力的实验组的TGF-β1(n=3)
Fig 2The result of ELISA showed up-regulation of TGF- β 1 expression after 20 min and 40 min ICMC
2.3实时PCR实时PCR结果表明,加载循环压力20 min和40 min的实验组中,Ⅱ型胶原的mRNA水平表达明显高于对照组(1.44±0.08、1.92±0.20、1.04±0.01,P<0.05),ANK的mRNA水平表达明显高于对照组(1.42±0.09、2.10±0.33、1.05±0.03,P<0.05),见表2。
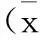


基因对照组20min40minF值P值TypeⅡ1.04±0.011.44±0.08*1.92±0.20*37.70420.0004Aggrecan1.16±0.091.39±0.08*2.03±0.39*11.29010.0092SOX-91.10±0.031.62±0.14*1.85±0.13*38.63520.0003ANK1.05±0.031.42±0.09*2.10±0.33*21.87400.0016
注:与对照组相比,*P<0.05
2.4Western blottingWestern blotting检测结果显示,分别加载机械循环压力20 min和40 min的实验组,ANK的表达量都明显高于实验对照组。

图33组终板软骨细胞中ANK基因的蛋白表达量(n=3)
Fig 3The ANK expression of both protein were increased after 20 min and 40 min ICMC(n=3)
3讨论
颈肩痛、腰腿痛的主要原因——椎间盘退变(intervertebral disc degeneration,IDD)是脊柱退行性疾病发生的始动因素。随着年龄的增长,人椎间盘退变的程度也在逐渐加深,其主要表现为髓核中细胞数的减少,基质的降解以及终板软骨钙化的形成[7]。软骨终板作为位于椎间盘与椎体间的薄层透明软骨,是椎间盘的主要营养途径,对于椎间盘的营养提供以及力学性能的维持都具有十分重要的作用。大量研究表明[8-9],对脊椎施加异常应力刺激可以诱导软骨终板及椎间盘出现退变现象,而在此异常应力刺激下,细胞内环境稳态被打破,基质中成分出现了急剧变化,进而引起终板软骨钙化,致使终板软骨的生物学功能结构产生变化,削弱其吸收振荡和均匀传递载荷的能力,导致终板软骨退变。终板软骨细胞中Shahin等[10]通过对人类组织工程软骨施加一个静态的机械压力(轴向应变6.5%)2.5周后,发现软骨细胞中的粘多糖和Ⅱ型胶原合成量明显增多。碱性磷酸钙(BCP)作为软骨内异常钙化重要的钙盐类型,其存在3种形式,羟基磷灰石(HA)、碳酸磷灰石、磷酸八钙,而羟基磷灰石(HA)是终板软骨钙化中的主要钙盐亚型。焦磷酸作为一种钙盐形成的有效抑制剂,可以抑制软骨中钙盐的形成,其生成过少将导致碱性磷酸钙(BCP)的形成,从而诱导软骨细胞钙化现象的发生。ANK蛋白作为一种阴离子通道,广泛存在于终板软骨细胞上,其作为一种多次跨膜蛋白,可以将细胞内的焦磷酸转运到细胞外,同时通过细胞外焦磷酸酶将核苷酸分解生成焦磷酸,起到非常重要的抑制矿化调控作用。Ho等[11]通过观察ANK基因突变的老鼠发现,在关节内和周围存在大量碱性磷酸钙沉积,诱导骨赘形成,破坏关节软骨的正常结构功能,最后因不能活动而致死。我们前期工作[12]也发现,间歇循环张力可以通过改变TGF-β1来调控ANK基因的表达,从而诱导大鼠终板软骨细胞钙化现象的发生,而在终板软骨退变过程中的间歇机械压力以及与ANK基因的相互作用,尚不十分清楚。本实验通过对大鼠终板软骨细胞加载短期机械循环压力刺激,观察终板软骨细胞变化发现,随着压力刺激时间的延长,软骨标志基因Ⅱ型胶原、蛋白多糖、转录因子Sox-9以及ANK基因的表达水平也呈现时间依赖性的增高趋势,与上述研究结果一致。由此,我们认为在短期的机械循环压力刺激下,终板软骨细胞中的ANK基因存在一种类似快速应激机制。由于焦磷酸不能正常通过细胞膜渗透到细胞外,压力刺激下合成增加的ANK蛋白,可以将细胞内生成的焦磷酸转运到细胞外,从而抑制细胞外碱性磷酸钙的沉积,并抑制软骨细胞的钙化进程。
TGF-β1作为一种重要的细胞生长因子,可促进软骨细胞细胞内外基质合成,从而有效阻止和修复软骨的损伤,但其过度的表达可以诱导骨赘的形成,如果其表达过少,则促使软骨基质降解。Davidson等[13]通过对小鼠的研究发现,在正常膝关节软骨内TGF-β1表达很高,而在发生退变的软骨中表达很低。Derfus等[14]发现软骨细胞内的TGF-β1可以刺激细胞内和细胞外焦磷酸明显增多。TGF-β1可通过上调ANK基因的表达,阻止细胞外碱性磷酸钙结晶的沉积。我们的前期研究发现[12],内源性TGF-β1可以刺激终板软骨细胞内ANK基因表达水平的增加;同时在机械循环张力诱导终板软骨细胞钙化的过程中,内源性TGF-βl与ANK基因的表达均呈现明显的刺激时间依赖性下调,而在机械循环压力条件下,两者的变化及相互作用尚不明确。本实验通过对大鼠终板软骨细胞加载短期机械循环压力刺激,观察终板软骨细胞变化发现,TGF-β1可以明显刺激细胞内ANK基因的表达上调,同时随着压力刺激时间的延长,内源性TGF-β1呈现明显的上调趋势。我们推测短期的机械循环压力对于终板软骨细胞表型的维持起着极其重要的作用,可以上调标志基因Ⅱ型胶原、蛋白多糖、转录因子Sox-9的表达,同时可以上调内源性TGF-β1的表达增加,从而调节ANK基因的表达水平,促进细胞外焦磷酸生成的增加,抑制细胞外碱性磷酸钙结晶沉积,进而阻碍细胞钙化进程,两者之间具体的作用机制有待进一步研究。
综上所述,本研究的结果表明对脊柱终板软骨细胞进行较短时间的机械循环压力刺激后细胞的ANK基因和TGF-β1表达量上调。较短时间的机械循环压力刺激并不影响终板软骨细胞的活死,同时通过上调TGF-β1来调控细胞ANK基因的表达,从而促进细胞外焦磷酸生成的增加,抑制细胞外碱性磷酸钙结晶的沉积,进而阻碍细胞钙化现象的发生及发展,研究结果可以为椎间盘退变的治疗提供一种新的方法。
【参考文献】
[1] Lindblom K.Intervertebral-disc degeneration considered as a pressure atrophy[J] .J Bone Joint Surg Am,1957,39-A:933945.
[2] Higuchi M,Abe K,Kaneda K.Changes in the nucleus pulposus of the intervertebral disc in bipedal mice.A light and electron microscopic study[J] .Clin Orthop Relat Res,1983,175:251-257.
[3] 俞云飞,徐宏光,王弘,等.自噬在张力诱导终板软骨细胞退变过程中的变化[J] .中华骨科杂志,2014,34(3):317-322.
[4] 俞云飞,徐宏光,宋俊兴.力学刺激对软骨细胞影响研究进展[J] .国际骨科学杂志,2012,05(33):297-299.
[5] BIAN Qin, LIANG Qiangqian, WAN Chao,etal. Prolonged upright posture induces calcified hypertrophy in the cartilage end-plate in rat lumbar spine[J] . Spine (Phila Pa 1976),2011,36(24):2011-2020.
[6] 俞云飞,徐宏光,王弘,等.自噬在不同年龄大鼠终板软骨中的变化[J] .中华医学杂志,2013,93(45):3632-3635.
[7] Adams MA,Roughley PJ.What is intervertebral disc degeneration and what causes it[J] ? Spine (Phila Pa 1976),2006,31(18):2151-2161.
[8] Costello JC,Rosenthal AK,Kurup IV,etal.Parallel regulation of extracellular ATP and inorganic pyrophosphate:roles of growth factors,transduction modulators,and ANK[J] .Connect Tissue Res,2011,52(3):139.
[9] Keorochana G,Johnson JS,Taghavi CE,etal.The effect of needle size inducing degeneration in the rat caudal disc:evaluation using radiograph,magnetic resonance imaging,histology,and immuno-histochemistry[J] .Spine J,2010,10(11):1014-1023.
[10] Shahin K,Doran PM.Tissue engineering of cartilage using a mechanobioreactor exerting simultaneous mechanical shear and compression to simulate the rolling action of articular joints[J] .Biotechnol Bioeng,2012,109(4):1060-1073.
[11] Ho AM,Johnson MD,Kingsley DM.Role of the mouse ank gene in control of tissue calcification and arthritis[J] .Science,2000,289(5477):265-270.
[12] XU Hongguang,ZHANG Xiaohai,WANG Hong,etal.Intermittent Cyclic Mechanical Tension-Induced Calcification and Downregulation of ankh Gene Expression of End Plate Chondrocytes[J] .Spine (Phila Pa 1976),2012,37(14):1192-1197.
[13] Blaney Davidson EN,Scharstuhl A,Vitters EL,etal.Reduced transforming growth factor-beta signaling in cartilage of old mice:role in impaired repair capacity[J] .Arthritis Res Ther,2005,7(6):1338-1347.
[14] Derfus BA,Camacho NP,Olmez U,etal.Transforming growth factor beta-1 stimulates articular chondrocyte elaboration of matrix vesicles capable of greater calcium pyrophosphate precipitation[J] .Osteoarthritis Cartilage,2001,9(3):189-194.
[15] XU Hongguang,ZHANG Xiaohai,WANG Hong,etal.Continuous cyclic mechanical tension increases ank expression in endplate chondrocytesthrough the TGF-β1 and p38 pathway[J] .Eur J Histochem,2013,2557(3):e28.
·临床医学·
·临床医学·
