对盐酸昂丹司琼与地塞米松磷酸钠、盐酸左氧氟沙星在0.9%NS注射液中配伍稳定性的考察
2016-01-11王宇阳秦亚玮刘丹彤
王宇阳 徐 梅⋆ 秦亚玮 刘丹彤
(1.徐州医科大学附属医院药学部 江苏 徐州 221006;2.徐州医科大学药学院 江苏 徐州 221004)
化疗相关性恶心呕吐(CINV)或术后恶心呕吐(PONV)是癌症患者最常见的并发症。5-羟色胺3受体拮抗药可通过选择性拮抗外周神经元和中枢神经系统中5-羟色胺3的受体发挥强效止吐的作用[1]。盐酸昂丹司琼是较早应用于临床的高选择性5-羟色胺3受体拮抗药之一。此药不会引起锥体外系反应、过度镇静等不良反应,在临床上被广泛应用于治疗CINV及PONV。研究发现,糖皮质激素类药物地塞米松具有增强5-HT3RAS对5-HT3R敏感性的作用。将地塞米松与昂丹司琼联合起来治疗CINV及PONV能取得更优的止吐作用。喹诺酮类药物左氧氟沙星是临床上治疗感染性疾病的常用药物。在接受手术治疗的癌症患者发生术后呕吐和感染后可联用左氧氟沙星与昂丹司琼对其进行治疗。但临床研究证实,将地塞米松或左氧氟沙星与昂丹司琼配伍后制成的药液均具有不稳定性,可能导致不可预测的医疗风险。在本次研究中,笔者分别考察将盐酸昂丹司琼注射液与地塞米松磷酸钠注射液、盐酸左氧氟沙星注射液在浓度为0.9%的NS注射液中配伍的稳定性。
1 仪器与试剂
Intersil ODS-3 C18高效液相色谱仪,Phenomenex-C18高效液相色谱仪,MS304S型精密分析天平,ZKT-18F型真空脱气仪,PHS-3C型精密pH计,ZWF-J6型注射液微粒分析仪,净化工作台,盐酸昂丹司琼注射液,盐酸昂丹司琼对照品,地塞米松磷酸钠注射液,地塞米松磷酸钠对照品,盐酸左氧氟沙星注射液,盐酸左氧氟沙星对照品,浓度为0.9%的氯化钠注射液,甲醇(色谱纯),甲酸(分析纯)。L-苯丙氨酸、硫酸铜、三乙胺、磷酸、磷酸二氢钾的纯度均为分析纯。水为新制的注射用水。
2 实验方法
2.1 配伍液的配制方法 在室温(25±1℃)、不避光的条件下,将2支盐酸昂丹司琼注射液(4ml:8mg)注入到含有20ml浓度为0.9%NS的一次性镇痛泵输液袋中混匀,用灭菌注射用水将2支5mg的地塞米松磷酸钠复溶后注入上述的盐酸昂丹司琼输液袋中混匀。另取1支盐酸昂丹司琼注射液注入到含100ml 浓度为0.9%NS的一次性镇痛泵输液袋中混匀。将1支盐酸左氧氟沙星注射液(2ml:0.1g)注入上述的输液袋中混匀,即得到质量浓度为0.8mg/ml的盐酸昂丹司琼与质量浓度为0.5mg/ml的地塞米松磷酸钠的配伍液(A配伍液)、质量浓度为80μg/ml的盐酸昂丹司琼与质量浓度为1 mg/ml盐酸左氧氟沙星的配伍液(B配伍液)。平行配制A配伍液与B配伍液各3份(n=3)。
2.2 含量测定方法
2.2.1 色谱条件 采用高效液相色谱法分别测定A、B配伍液中盐酸昂丹司琼、地塞米松磷酸钠及盐酸左氧氟沙星的含量。对配伍液A进行检测的条件是:色谱柱:Intersil ODS-3 C18(150mm×4.6mm,5μm),流动相:甲醇-0.02mol/L磷酸二氢钾溶液(甲酸调节pH为7.4)(65:35),柱温:25℃,流速:0.8ml/min,检测波长:240nm,进样量:20μl。对配伍液B进行检测的条件是:色谱柱:Phenomenex-C18(250mm×4.6mm,5μm),流动相:甲醇 -手性溶液(0.132%L-苯丙氨酸、0.1%硫酸铜、0.5%三乙胺,用磷酸调节pH至3.0)(15:85),柱温:30℃,流速:1ml/min,检测波长:293nm,进样量:20μl。
2.2.2 对照品溶液的配制 分别取盐酸昂丹司琼、地塞米松磷酸钠和盐酸左氧氟沙星对照品各适量,用流动相进行溶解定容,分别配制获得2.5mg/ml的盐酸昂丹司琼、2.0mg/ml的地塞米松磷酸钠、2.5mg/ml的盐酸左氧氟沙星对照品储备液备用。
2.2.3 标准曲线 精密吸取“2.2.2”项下盐酸昂丹司琼对照品的储备液,置于容量瓶中,加超纯水稀释定容至质量浓度为 10μg/ml、50μg/ml、100μg/ml、400μg/ml、800μg/ml、1000μg/ml的一系列溶液。按照“2.2.1”项下的色谱条件进样,以峰面积为纵坐标,以对照品溶液的浓度为横坐标,求得回归曲线方程为:盐酸昂丹司 琼 A=6437.7C+255.0(r=0.9994,n=6),线性范围:10~1000μg/ml,RSD为0.45%。以同法获得地塞米松磷酸钠和盐酸左氧氟沙星的线性回归方程。地塞米松磷酸钠的线性回归方程为:A=5302.5C+169.9(r=0.9997,n=6),线性范围为15~1000μg/ml,RSD为0.65%。盐酸左氧氟沙星的线性回归方程为:A=4472.1C+386.0(r=0.9998,n=6),线性范围为20~1200μg/ml,RSD为0.55%。
2.2.4 回收率的测定 取适量“2.2.2”项下盐酸昂丹司琼对照品的储备液,用超纯水分别配制成50μg/ml、400μg/ml、900μg/ml的溶液,作为标准曲线线性范围内低、中、高质量浓度的溶液,平行配制三份。在配制样品后立即(0 h)进样,测定峰面积,代入回归方程,计算样品的含量。以同法进行地塞米松磷酸钠和盐酸左氧氟沙星的回收率测定。结果显示,盐酸昂丹司琼、地塞米松磷酸钠及盐酸左氧氟沙星的回收率分别为98.3~102.8%、98.5~101.2%、99.7~102.6%,符合相关的要求。
2.2.5 精密度的测定 精密吸取“2.2.3”项下的盐酸昂丹司琼(20μg/ml)、地塞米松磷酸钠(20μg/ml)和盐酸左氧氟沙星(20μg/ml)对照品溶液各20μl,对其重复测定6次,记录峰面积,并计算RSD。结果显示,盐酸昂丹司琼、地塞米松磷酸钠及盐酸左氧氟沙星的精密度分别为1.28%、1.65%及1.09%,其精密度良好。
2.2.6 标准曲线溶液的稳定性测定 取“2.2.2”项下盐酸昂丹司琼、地塞米松磷酸钠和盐酸左氧氟沙星的对照品溶液,置于室温下,分别于配伍后的1h、2h、5h、10h、15h、24h取样,测定其峰面积,计算各药物的质量浓度,以不同时间的测定浓度与0h测定浓度的百分比表示溶液在24h内的稳定性。结果显示,盐酸昂丹司琼、地塞米松磷酸钠和盐酸左氧氟沙星含量的RSD分别为1.36%、1.25%及0.74%。
2.3 配伍液稳定性的考察 将A、B配伍液的输液袋置于室温(24℃)下,于0h、1h、3h、8h、15h、24h取样,按照“2.2.1”项下的色谱条件进样,记录其峰面积,代入各标准曲线方程,测定A、B配伍液中盐酸昂丹司琼、地塞米松磷酸钠和盐酸左氧氟沙星的浓度。于不同时间点取配伍液各适量,置于洁净具塞的比色管中,以0.9%的NS做为空白对照品,观察配伍液的外观。同时,对A、B配伍液进行pH和不溶性微粒的相关测定。
2.4 统计学处理 采用SPSS 17.0统计学软件对数据进行统计分析,计数资料采用χ2检验,计量资料采t检验,用均数±标准差(χ±s)表示,以P<0.05表示差异有显著性意义。
3 结果
3.1 A、B配伍液中相关的药物在配伍后的不同时间点其含量的变化 以A、B配伍液在配伍后0h其中相关药物的含量为100%做为该药物的初始浓度进行分析,A配伍液在配伍后的24h内,其中盐酸昂丹司琼的浓度降至初始浓度的87.56%,地塞米松磷酸钠的浓度降至初始浓度的97.05%。B配伍液在配伍后的24h内,其中盐酸昂丹司琼的浓度降至初始浓度的89.23%,其中盐酸左氧氟沙星的浓度降至初始浓度的92.38%。国际药物配伍稳定性标准规定,在多种药物配伍后的24h内,其中相关药物的浓度大于其初始浓度的95%,说明其具有化学稳定性[4]。可见,A配伍液中的盐酸昂丹司琼具有化学不稳定性,其与地塞米松磷酸钠存在配伍禁忌。B配伍液中盐酸昂丹司琼和盐酸左氧氟沙星也具有化学不稳定性,同样存在配伍禁忌。详情见表1:
3.2 对A、B配伍液在不同时间点其外观及pH值变化情况的分析 在不同时间点通过比色管观察A、B配伍液的外观是否有颜色的变化或有气体、沉淀产生。用pH计测量A、B配伍液在配伍后的各时间点其pH值的变化情况。对每个样本连续测定3次pH值,取平均值做为检测结果。结果显示,当A配伍液中的盐酸昂丹司琼(质量浓度为0.8mg/ml)与地塞米松磷酸钠(质量浓度为0.5mg/ml)在浓度为0.9%NS的输液袋中混合时,其交界处迅速呈现乳白色,继而出现白色絮状物沉淀,随着时间的延长其沉淀物的颜色逐渐加深,经振摇后不消失。当B配伍液中的盐酸昂丹司琼(质量浓度为80μg/ml)与左氧氟沙星(质量浓度为1mg/ml)混合后立即出现白色浑浊物,稍后出现白色絮状物,在进行振荡后絮状物不消失,无气体产生。在配伍后,A配伍液的pH值在4.71~5.26之间波动,随着时间的延长其pH值逐渐降低,在24h内其pH值的变化率为10.46%。可见,A配伍液在配伍的24h内其pH值不稳定。在配伍后随着时间的延长,B配伍液的pH值逐渐升高,在24h内其pH值的变化率为17.88%,可见其具有不稳定性。详情见表2。
表1 A、B配伍液中相关药物在配伍后不同时间点含量的变化(n=3,±s)

表1 A、B配伍液中相关药物在配伍后不同时间点含量的变化(n=3,±s)
组别 药物 初始浓度(μg/ml) 与初始浓度百分比(%)1 h 3 h 8 h 15 h 24 h A 盐酸昂丹司琼 750.38 95.23±0.1 94.37±0.1 91.28±0.2 89.72±0.1 87.56±0.2地塞米松磷酸钠 459.92 99.38±0.2 99.27±0.1 98.45±0.1 97.23±0.1 97.05±0.2 B 盐酸昂丹司琼 75.41 97.55±0.2 96.08±0.1 93.37±0.2 99.16±0.2 89.23±0.2盐酸左氧氟沙星 892.36 98.72±0.2 97.82±0.2 96.02±0.1 95.44±0.1 92.38±0.1
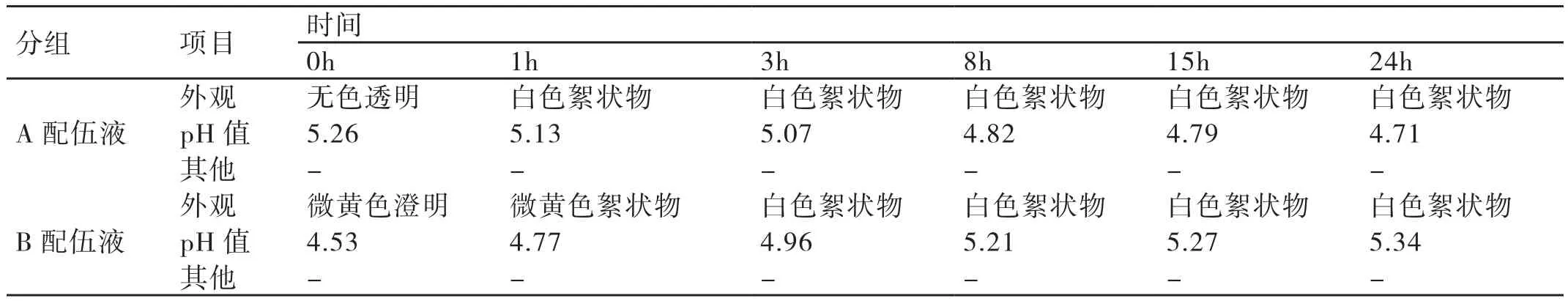
表2 A、B配伍液在配伍后的不同时间点其外观及pH值的变化(n=3)
3.3 对A、B配伍液中微粒数的测定 采用《中国药典》(2015年版)附录IXC中的不溶性微粒检查法-光阻法检测A、B配伍液在配伍后的0h和3h其中微粒的计数。记录A、B配伍液中≧2μm的微粒、≧5μm的微粒、≧10μm的微粒、≧25μm微粒的计数,对同一样品连续测定5次,取平均值做为最终的测定值。按照规定,每1ml的药物溶液中≧10μm的微粒不可超过25粒,且≧25μm的微粒不可超过3粒,否则可判定其不合格。本次研究的结果显示,A、B配伍液在配伍后的3h内其中微粒的计数均有所升高,均属于不合格的药物溶液。详情见表3。

表3 对A、B配伍液中微粒数的测定(个/ml,n=5)
4 讨论
对癌症患者进行化疗及放射治疗能促进其小肠内5-羟色胺(5-HT)的释放。5-HT可作用于5-HT3R,激活迷走神经的传入支,引起呕吐反射。迷走神经传入支的激动又可引起第四脑室底部Postrema 区5-HT的释放,加强呕吐中枢的功能。盐酸昂丹司琼可通过阻断外周和中枢神经的5-HT3受体发挥预防恶心、呕吐的作用[5]。地塞米松磷酸钠抑制呕吐的机制可能是:此药可抑制人体内前列腺素的合成,消除色氨酸前体,降低化学感受诱发区(CTZ)中5-HT3的含量,稳定CTZ的细胞膜,控制肠道内5-HT3的含量,促进内啡肽的释放,改变血-脑脊液屏障对白蛋白的通透性,降低大脑极后区催吐感受区中5-HT3的含量,进而可发挥抑制呕吐的作用。联合应用地塞米松磷酸钠与盐酸昂丹司琼可增强5-HT3R对昂丹司琼的敏感性,而且地塞米松磷酸钠较长的半衰期可弥补盐酸昂丹司琼作用时间短的缺陷[2]。盐酸昂丹司琼注射液的单次常用量为4~32mg。在联用地塞米松磷酸钠与盐酸昂丹司琼治疗CINV时,地塞米松磷酸钠的常用量为4~20 mg[3]。
在临床用药的过程中,药物的稳定性会直接影响到其有效性与安全性。为患者输注澄明度不合格的药液可使其发生静脉炎、肉芽肿、肺动脉瓣闭锁不全等不良反应。
本次研究的结果显示,盐酸昂丹司琼与地塞米松磷酸钠、左氧氟沙星均具有配伍禁忌。将盐酸昂丹司琼与地塞米松磷酸钠或左氧氟沙星配伍使用时,配伍液中盐酸昂丹司琼的浓度可显著降低。导致这一情况的原因可能是:聚氯乙烯(PVC)输液袋具有吸附盐酸昂丹司琼的作用,或配伍液发生理化性质的改变。雷凯的研究结果显示,在将较低质量浓度的盐酸昂丹司琼(质量浓度为0.08 mg/ml)和地塞米松磷酸钠(质量浓度为0.1 mg/ml或0.2 mg/ml)配伍时,在24 h 内其配伍的相容性较高[4]。国内外的文献对于将盐酸昂丹司琼与地塞米松磷酸钠配伍使用是否会使其发生相互作用尚无一致的结论。这可能是因不同的制药厂家生产这两种药物的工艺及辅料不同所致。在临床用药的过程中,医师、药师及护士都要全面了解为患者进行用药治疗时可影响其所用药物稳定性的因素,在循证医学的指导下谨慎地把好药物配伍的关卡,不联用存在配伍禁忌的药物,并加强用药巡视(尤其应警惕个别药物可引起的迟发性反应)。笔者建议,在为患者联用盐酸昂丹司琼与地塞米松磷酸钠或盐酸左氧氟沙星时,不要在同一静脉通路中使用三通管同时为其输注两种药物。我们应在使用茂非滴管为患者输注盐酸昂丹司琼后,用20ml浓度为0.9%的 NS注射液或浓度为5%的葡萄糖注射液冲管,然后为其滴注地塞米松磷酸钠或盐酸左氧氟沙星(或在为其静脉注射两种药物的间期为其输注少量浓度为0.9%的 NS注射液或浓度为5%的葡萄糖注射液),以免这两种药物因直接接触而引起不良反应[5]。在为患者联用盐酸昂丹司琼注射液与地塞米松磷酸钠或盐酸左氧氟沙星时若其已出现不良反应,应立即为其更换输液器,加强对其用药反应的观察,并耐心地为其做好病情解释和安抚工作。
[1] 余勇军,纪木火. 地塞米松联合昂丹司琼预防腹腔镜胆囊切除术后恶心呕吐的疗效观察[J]. 齐齐哈尔医学院学报,2010,3l(7):1072-1073.
[2] 韩清波,罗峰. 地塞米松注射液与昂丹司琼注射液存在配伍禁忌[J]. 中国实用护理杂志,2011,27(9):33.
[3] 纪春青. 地塞米松磷酸钠注射液与盐酸昂丹司琼注射液存在配伍禁忌[J]. 中国药物经济学,2012,7(3):274.
[4] 雷凯,何光照,卢明,等. 盐酸昂丹司琼注射液与注射用地塞米松磷酸钠的配伍相容性研究[J]. 中国药学杂志,2016,51(6):494.
[5] 赵娜. 盐酸昂丹司琼注射液与地塞米松注射液存在配伍禁忌[J]. 护理研究,2009,23(7):1906.
