红花中影响山柰素含量测定的化合物研究
2016-01-11马久太,卢新义,孙宝平等
红花中影响山柰素含量测定的化合物研究
马久太,卢新义,孙宝平,孙宇宏,单娜,谢伟
(陕西步长制药有限公司,西安710077)
摘要:目的对红花中影响山柰素含量测定的未知化合物(Imp)进行分离、纯化和结构鉴定。方法采用溶剂法和柱层析法提取、分离得到未知化合物(Imp),并通过理化性质和光谱数据鉴定该化合物的分子结构。结果从红花乙醇提取、酸水解物中分离得到的未知化合物(Imp),经结构鉴定为6-甲氧基山柰酚。结论明确影响红花中山柰素含量测定的化合物为6-甲氧基山柰酚。为红花中山柰素的准确测定提供了依据,且该化合物为红花中首次发现。
关键词:红花;6-甲氧基山柰酚;化合物
doi:10.3969/j.issn.1004-2407.2015.06.006
中图分类号:R284文献标志码:A
基金项目:国家十二五重大新药创制(编号:2011ZX11201);陕西省“13115”重大科技专项(编号:2010ZDKG-106)
收稿日期:(2015-03-05)
Study on the compound affecting the determination of kaempferol inCarthamustinctoriusL.
MA Jiutai,LU Xinyi,SUN Baoping,SUN Yuhong,SHAN Na,XIE Wei(Shaanxi Buchang Pharmaceutical Limited Company,Xi ′an 710077,China)
Abstract:ObjectiveTo study the unknown compound affecting the determination of kaempfero in Carthamus tinctorius L. by separation, purification and structure identification. MethodsBy solvent extraction and column chromatography,the unknown compound was isolated,and the molecular structure was identified by physical and chemical properties and spectral data. ResultsThe unknown compound from the ethanol extraction and acid hydrolysate separation was identified as 6-methoxy kaempferol.ConclusionThe unknown compound affecting the content determination of kaempferide was 6-methoxy kaempferol.
Key words:CarthamustinctoriusL.;6-methoxy kaempferol;compounds
红花为菊科植物红花CarthamustinctoriusL.的干燥花,是传统的活血化瘀中药,具有活血通经、散瘀止痛的功效。红花中主要成分为以山柰酚和槲皮素为母体的多种黄酮类化合物[1]。研究发现,按照《中国药典》2010年版红花质量标准项下的含量测定方法[2],在对新疆不同地区、多个批次的红花药材进行山柰素含量测定时,有未知化合物包埋于山柰素的色谱峰中,无法分离,导致测量结果偏高。为准确测定红花中山柰素含量,保证方法的可靠性,我们对红花中未知的目标化合物进行了分离、纯化和结构鉴定。
1仪器与试药
1.1仪器Waters e2695-Xevo G2-S QTof 液质联用仪,MassLynx质谱工作站,DMX500型核磁共振仪(德国Brucker);Prominence 20AXR-IT-TOF液质联用仪,LC-MS solution工作站(日本岛津);Waters 2545制备液相色谱仪(美国Waters);LC-20AD高效液相色谱仪,SPD-M20A DAD检测器(日本岛津);SephadexLH-20(YMC);DV215CD分析天平(美国)。
1.2试药山柰素对照品 (批号110861-200808,供含量测定用,购于中国食品药品检定研究院);红花药材产地为新疆吉木萨尔县,经陕西中医药大学王继涛高级实验师鉴定为菊科植物红花CarthamustinctoriusL.的干燥花;柱层析硅胶(100~200目、200~300目,青岛海洋化工集团公司);甲醇为色谱纯;水为高纯水;其他试剂均为分析纯。
2方法与结果
2.1药典方法测定山柰素含量中存在干扰现象及对该化合物进行初步确证我们对多批红花药材中山柰素含量测定时发现,某个化合物对测定结果存在干扰,使山柰素含量较实际值偏高,为准确测定红花中山柰素的含量,本文对此进行了系列研究。
2.1.1通过DAD检测器发现山柰素色谱峰存在不纯物采用Ch.P.供试品制备方法及色谱条件,通过DAD检测器对5批红花药材中山柰素进行含量测定,特征色谱图详见图1和图2。
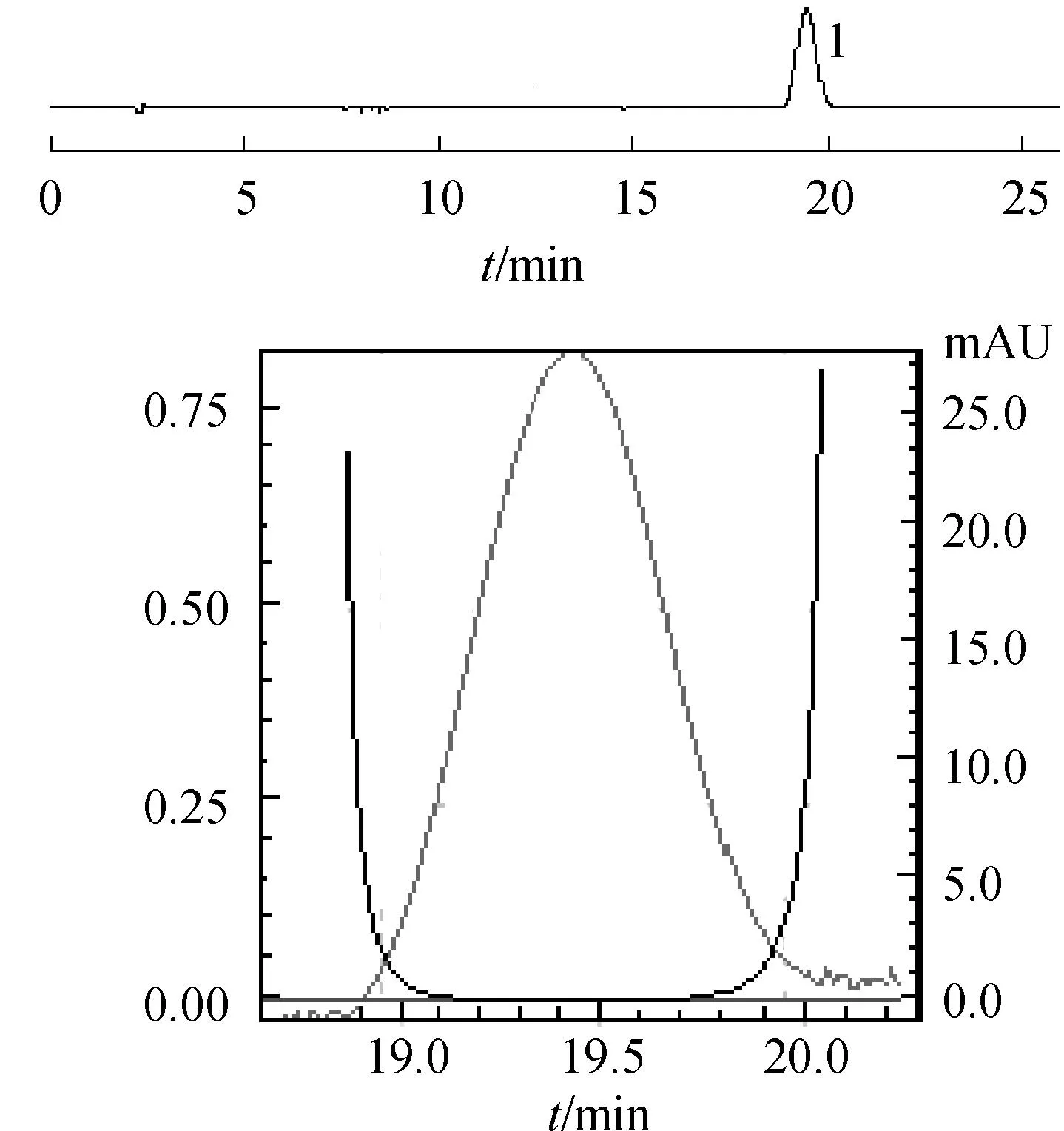
图1山柰素对照品HPLC色谱图及色谱峰纯度图
注:不纯物:未检测到;峰纯度指数:0.999 909;单点阈值:0.997 953;最小峰纯度指数:1 955
Fig.1 Kaempferol reference substance chromatogram & purity chromatogram
Note: impurity:not detected;the index of peak purity:0.999 909;single point threshold: 0.997 953;the minimum index of peak purity: 1 955
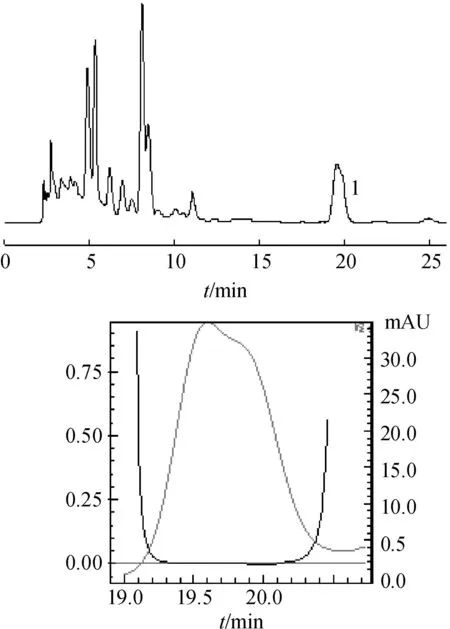
图2红花供试品溶液HPLC色谱图及色谱峰纯度图
注:不纯物:检测于19.96 min;峰纯度指数:0.996 566<0.999 0;单点阈值:0.997 874;最小峰纯度指数:1 308
Fig.2CarthamustinctoriusL. sample solution chromatogram & purity chromatograms
Note: impurity: detected in 19.96 min;the index of peak purity: 0.996 566<0.999 0;the single point threshold: 0.997 874;the minimum index of peak purity:1 308
从图2中可以看出,供试品色谱图中山柰素色谱峰纯度指数仅为0.996 566<0.999 0,不纯物检测于19.96 min,提示供试品中山柰素色谱峰中有其他化合物(Imp)存在,导致在该保留时间下色谱峰纯度降低。
2.1.2运用质谱对存在化合物进行确证通过HPLC-MS对2.1.1中样品进行分析,结果见图3。
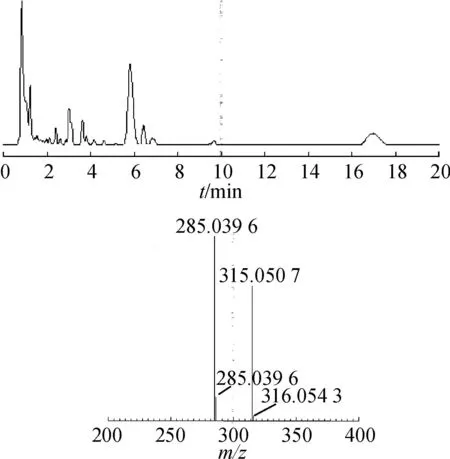
图3红花药材供试品TIC和tR=19.02 min提取的质谱图
Fig.3 The TIC plot ofCarthamustinctoriusL. sample solution & the extract mass chromatogram intR=19.02 min
从图3可以看出,在保留时间19.02 min处的山柰素主峰TIC提取得到的质谱图中有2组分子离子峰,其中质核比(m/z)为285.039 6是山柰素分子离子峰[M-H]-;m/z为315.050 7是Imp的分子离子峰[M-H]-。从结果可以看出,干扰山柰素含量测定的Imp为单一化合物,通过相对分子质量差异可以初步推断,可能为山柰素甲氧基化的衍生物。
2.2对干扰山柰素含量测定的化合物(Imp)的提取、分离纯化及结构鉴定
2.2.1红花中目标化合物的提取红花干燥药材30 kg,以乙醇浸提2次,每次250 kg,过滤,滤液45 ℃减压浓缩至浸膏,浸膏用60 ℃乙醇溶解,置于圆底烧瓶中,加入体积比为3∶1的盐酸溶液(15→37),置于电热套中,加热水解1 h,冷却,水解液减压浓缩至无醇味,加水搅拌,用乙酸乙酯萃取2次,合并萃取液,于65 ℃减压浓缩至约为1 300 g,收率为4.3%。
2.2.2分离纯化取浸膏700 g进行硅胶柱分离,以石油醚-丙酮(100∶0~75∶25)溶剂系统洗脱,目标化合物存在于石油醚-丙酮(75∶25)部分,得量约30 g,对该部分进行硅胶柱分离,再以氯仿-甲醇(70∶1)进行洗脱,收集65~85瓶洗脱液,合并,减压干燥,得到黄色粉末4 g,用Sephadex LH-20及制备液相进行纯化,得到该未知化合物(Imp)约50 mg,浸膏中该未知的目标化合物收率为0.007%。
2.2.3红花中目标化合物的结构鉴定所得化合物为黄色针状结晶(丙酮),盐酸-镁粉反应呈阳性,mp 280.3 ℃。ESI-MSm/z:317 [M+H]+。1H-NMR ( DMSO-d6,500 MHz)δ: 6.55 ( 1H,s,H-8),8.05 ( 2H,d,J=8.5 Hz,H-2′,6′),6.93 ( 2H,d,J=8.5 Hz,H-3′,5′),3.76 ( 3H,s,6-OCH3)。13C-NMR (DMSO-d6,500 MHz)δ:135.8 (C-2),147.4 (C-3),176.6 (C-4),151.9 (C-5),131.3(C-6),157.7 (C-7),94.2 (C-8),151.9 (C-9),103.8(C-10),122.2(C-1′),115.9 (C-2′,6′),130.0 (C-3′,5′),159.7(C-4′),60.5 (6-OCH3),以上光谱数据与文献报道[3]一致,故鉴定目标化合物为6-甲氧基山柰酚,该化合物为首次从红花中分离得到,如图4所示。
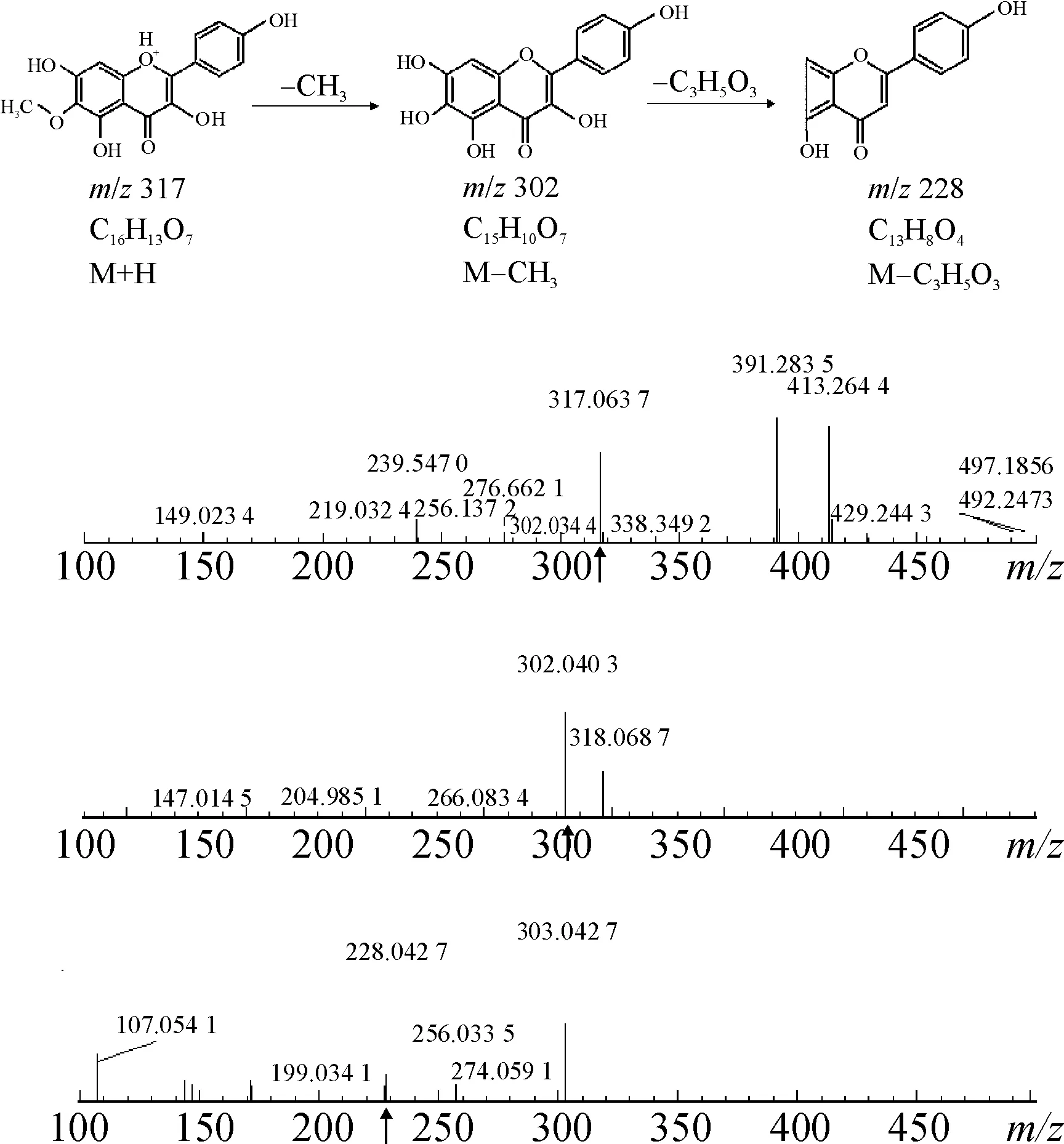
图4目标化合物6-甲氧基山柰酚可能裂解途径及质谱峰归属
Fig.4 The fragmentation pathway of target compound 6-methoxy kaempferol & the mass peaks assignment
3结论
本文对红花进行了醇提、水解及分离纯化,得到未知化合物,并通过理化性质及光谱数据对其结果进行解析,并与参考文献中数据比较,确定该化合物为6-甲氧基山柰酚。
4讨论
红花药材醇提水解物用石油醚-丙酮(100∶0~75∶25)分离,6-甲氧基山柰酚主要存在于石油醚-丙酮(75∶25)部位,对该部位进一步用石油醚-丙酮(10∶1,8∶1,6∶1,4∶1和2∶1)洗脱,结果发现洗脱效果不是很理想,目标化合物和其他化合物未分开,因此更换洗脱溶剂为氯仿-甲醇,经过对洗脱溶剂系统摸索,确定柱分离条件为氯仿-甲醇(70∶1)。由于6-甲氧基山柰酚和山柰素极性相近,用氯仿-甲醇(70∶1)洗脱,不需更换梯度,约15个柱体积,6-甲氧基山柰酚就能完全洗脱。在实验中发现,用Sephadex LH-20对6-甲氧基山柰酚进行纯化,用氯仿-甲醇(1∶1)溶解上样,洗脱,与甲醇相比,其纯化效果更好。
本文对相关数据库及文献进行检索[4-5],均未发现红花药材中已分离纯化得到6-甲氧基山柰酚,因此本次研究从红花中分离得到的6-甲氧基山柰酚,是在红花药材中首次发现。
本文通过对文献资料的检索[6-10],发现6-甲氧基山柰酚药理作用和山柰素及黄酮类化合物基本一致,具有一定抗氧化、清除自由基的作用;具有预防神经系统方面疾病的作用;也具有一定的致突变作用。由于该致突变作用是黄酮类化合物的共同特性,相比其他黄酮类化合物,6-甲氧基山柰酚中甲氧基空间结构较大,故该结构的致畸变作用较弱,故该化合物所导致的致突变作用在安全范围之内。
致谢:核磁共振由沈阳药科大学分析测试中心测定,特对相关人员表示感谢。
参考文献:
[1]徐如英,童树洪.红花的化学成分及药理作用研究进展[J].中国药业,2010,19(20):86-87.
[2]国家药典委员会.中国药典2010年版[S].一部.北京:中国医药科技出版社,2010:1029-1031.
[3]张飞,覃江江,成向荣,等.湖北旋覆花化学成分的研究[J].天然产物研究与开发,2012,24(5):427-431,449.
[4]田兰,吴桂荣,王岩,等.红花黄色素研究进展[J].西北药学杂志,2007,22(4):218-220.
[5]陶春梅,于治国,袁璐,等.红花药材中红花黄色素A的HPLC测定[J].西北药学杂志,2006,21(6):254-255
[6]Zapata-Torres,Gerald. Effects of natural flavones and flavonols on the kinase activity of Cdk5[J]. J Nat Prod, 2004,67(3): 416-420.
[7]王若菁,杨滨.红花的化学成分及质量标准研究进展[J].中国实验方剂学杂志,2007,13(5):65-69.
[8]姜建双,夏鹏飞,冯子明,等.红花化学成分研究[J].中国中药杂志,2008,33(24):2911-2913.
[9]施峰,刘焱文.红花的化学成分及药理研究进展[J].时珍国医国药,2006,17(9):1666-1667.
[10]萨仁高娃,陈红梅,泉山.蒙药红花化学成分及药理活性研究概况[J].内蒙古民族大学学报:自然科学版,2009,24(3):333-335.
