奥沙利铂长循环脂质体的制备及其在小鼠体内的药效学研究
2016-01-11李哲,马海英
·论著·
奥沙利铂长循环脂质体的制备及其在小鼠体内的药效学研究
李哲,马海英*(中国医科大学附属第四医院药学部,沈阳 110032)
[摘要]目的:制备奥沙利铂长循环脂质体,考察其在小鼠体内的药效学。方法:采用乙醇注入法制备奥沙利铂长循环脂质体,观察其形态,测定粒径分布和包封率。以S180荷瘤小鼠为模型,生理盐水为对照,测定奥沙利铂溶液和奥沙利铂长循环脂质体的抑瘤率,考察肿瘤生长情况以及小鼠生存情况。分别测定小鼠的白细胞计数、脾脏指数和胸腺指数,以考察对免疫器官的影响。结果:奥沙利铂长循环脂质体平均粒径为(112.2±0.3) nm,包封率为(59.93±0.67)%(n=3)。与奥沙利铂溶液相比,奥沙利铂长循环脂质体的抑瘤率明显提高[(30.4±1.9)% vs (85.8±2.3)%,P<0.05]。奥沙利铂脂质体组小鼠的白细胞计数、脾脏指数和胸腺指数与生理盐水组相比,无显著性差异(P>0.05),肿瘤体积增长缓慢,小鼠生长状态良好。结论:奥沙利铂长循环脂质体有显著的抑瘤作用,并减少了奥沙利铂的免疫系统毒性。
[关键词]奥沙利铂;长循环脂质体;药效学;小鼠
[中图分类号]R979.1,R944.9[文献标志码]A
DOI:10.5428/pcar20150109
基金项目辽宁省科学技术计划项目(2011225020)
作者简介李哲(女),硕士,药师.
[收稿日期]2014-01-16
Preparation of oxaliplatin long circulating liposomes and their pharmacodynamics in mice
LI Zhe,MA HaiYing*(Department of Pharmacy,the Fourth Hospital Affiliated to China Medical University,Shenyang 110032,China)
ABSTRACT[]Objective:To prepare oxaliplatin long circulating liposomes and study their pharmacodynamics in mice.Methods:The oxaliplatin long circulating liposomes were prepared by ethanol injection and morphology was observed,the grain size and entrapment efficiency were determined.Tumor inhibition rates,tumor growth situation,survival situation of mice administered with oxaliplatin solution and long circulating liposomes were investigated with S180 tumor-bearing mouse as animal models and physiological saline as control.The count of white blood cells,spleen index and thymus index in mice were determined to evaluate the toxicity of oxaliplatin to immune organs.Results: The average grain size of oxaliplatin long circulating liposomes were (112.2±0.3) nm,and the entrapment efficiency was (59.93±0.67)%(n=3).Compared with oxaliplatin solution,tumor inhibition rate of oxaliplatin long circulating liposomes was obviously increased [(30.4±1.9)% vs(85.8±2.3)%,P<0.05].There were no significant differences in the count of white blood cells, spleen index and thymus index, as compared with those of the physiological saline group (P>0.05). Tumor volume in the mice administered with oxaliplatin long circulating liposomes increased rather slowly, and the mice all survived. Conclusion: Oxaliplatin long circulating liposomes seemed to have significant inhibitory effects on tumors and could reduce oxaliplatin toxicity to the immune system.
[KEY WORDS]oxaliplatin; long circulating liposome; pharmacodynamics; mice
[Pharm Care Res,2015,15(1): 27-30]
E-mail: lizhe19850301@126.com
*通信作者(Corresponding author):马海英,E-mail:cmu4h-mhy@126.com
奥沙利铂是第三代铂类抗肿瘤药物,常用于治疗结直肠癌、非小细胞肺癌、卵巢癌和乳腺癌等多种癌症,对顺铂和卡铂耐药肿瘤也有显著抑制作用。该药具有骨髓、心脏、周围神经毒性,可能导致白细胞减少、胃肠功能紊乱、过敏等药物不良反应,其普通剂型还存在不稳定的问题。脂质体作为药物载体具有增强药物靶向性和治疗效果,减少毒副作用等优点[1]。聚乙二醇(PEG)修饰的长循环脂质体能增强药物稳定性,降低清除率,延长作用时间[2]。奥沙利铂为细胞毒性药物,有关奥沙利铂脂质体对免疫器官的影响国内外尚未见相关报道。本研究将奥沙利铂制备成长循环脂质体,以白细胞计数、脾脏指数和胸腺指数为指标,考察其对免疫器官的毒副作用,综合评价其药效学。
1材料
1.1仪器TN型托盘式扭力天平(上海第二天平仪器厂);Nicomp-380激光粒度测定仪(美国PSS公司);756MC型紫外可见分光光度计(上海第三分析仪器厂);TDL80-2B离心机(上海安亭科学仪器厂);PHS-25型pH计(上海精密科学仪器有限公司);DF-101S磁力搅拌器(巩义市英峪予华仪器厂);CP214电子分析天平(美国奥豪斯公司);IX51奥林巴斯倒置显微镜(日本奥林巴斯公司);DAD二极管阵列检测器(大连依利特科学仪器有限公司);Diamonsil C18色谱柱(美国迪马公司)。
1.2药品和试剂奥沙利铂原料药(纯度≥99.0%,齐鲁制药有限公司);葡聚糖凝胶G-50(英国Amersham Biosciences公司) ;氢化大豆卵磷脂(HSPC,德国 Lucas Meyer公司);胆固醇(Chol,南京新百药业有限公司);聚乙二醇单甲醚2000-二硬脂酰磷脂酰乙醇胺(mPEG2000-DSPE,美国 Genzyme 公司);无水乙醇(药用级,安徽安特生物化学有限公司);0.9%氯化钠注射液(生理盐水,沈阳志鹰制药厂);灭菌注射用水(沈阳军区总医院自制);肝素(12 500 U/支,上海第一生化药业有限公司);重蒸水(沈阳药科大学药业有限责任公司);其他试剂均为分析纯。
1.3实验动物和瘤株42只雄性昆明种小鼠,重量18~22 g[沈阳药科大学实验动物中心,实验动物许可证号:SCXK(辽2013-0005)]。S180小鼠肿瘤细胞株(辽宁省肿瘤研究所,批号20130622)。
2方法和结果
2.1脂质体的制备采用乙醇注入法制备奥沙利铂长循环脂质体(oxaliplatin long circulating liposomes,OLCL)。将HSPC、Chol和mPEG2000-DSPE按质量比3∶1∶1混合,加入无水乙醇(使乙醇终浓度为10%),于60 ℃水浴中搅拌溶解。在5 mmol/L的磷酸盐缓冲液(pH 7.1,按《中华人民共和国药典》2010 版二部附录ⅩⅤD法配制)5 ml 中加入10 mg/ml奥沙利铂水溶液5 ml,混合得到奥沙利铂磷酸盐溶液,将其预热至60 ℃,加入磷脂混合物中水化。在水浴中孵育15 min后,冷却至室温,在细胞破碎仪的探头下超声分散(200 w×2 min+400 w×6 min,工作10 s,间歇10 s),最后经0.80、0.45、0.22 μm微孔滤膜依次滤过整粒,得到含奥沙利铂浓度为5 mg/ml的OLCL。

图1 奥沙利铂长循环脂质体的透射电镜图(×10 5) Figure 1 The transmission electron microscope photographs of oxaliplatin long circulating liposomes(×10 5)
2.2脂质体的形态和粒径分布采用磷钨酸负染法制备透射电镜样品。将OLCL用蒸馏水稀释至10倍体积后,取适量滴于铜网上,浸泡于2%磷钨酸溶液(用氢氧化钠溶液调节pH至7.0)中染色2~5 min。用烘箱烘干铜网后,在透射电镜下观察OLCL的形态,见图1。由图1清晰可见,OLCL双层结构明显,呈球形或椭球形,分散良好,未见团聚现象。取OLCL适量,用灭菌注射用水稀释至光密度为250~350,将稀释液放入样品池内,采用激光粒度测定仪测定OLCL粒径。测定条件:光源为He-Ne 激光(空气冷却),波长632.8 nm,功率75 mw,温度23 ℃,测得3批脂质体的粒径为(112.2±0.3) nm(n=3)。
2.3包封率的测定(1)色谱条件色谱柱:Diamonsil C18色谱柱(200 mm×4.6 mm,5 μm);流动相:甲醇-水(10∶90);检测波长:250 nm;流速:l ml/min;进样量:20 μl[3]。(2)检测方法采用葡聚糖凝胶微柱离心法,将葡聚糖凝胶Sephadex G-50在重蒸水中浸泡过夜,充分溶胀后,装于2.5 ml注射器内,凝胶柱柱高约为2.5 cm,使水分自然流下。将装有葡聚糖凝胶的注射器以223.6×g离心4 min(以下同),除去水分。精密吸取0.1 ml OLCL置凝胶柱顶端,离心,加100 μl蒸馏水置凝胶柱顶端,离心,连续操作两次。收集管内液体,转移至5 ml量瓶内,加入1 ml 10%的Triton X-100水溶液,用蒸馏水定容。按上述色谱条件测定峰面积,用外标法计算上清液中奥沙利铂的浓度,即为游离药物浓度(ρ游离)。另取0.1 ml OLCL置5 ml量瓶中,加入1 ml 10%的Triton X-100水溶液,用蒸馏水定容,进样测定,用外标法计算药物总浓度(ρ总)[4]。包封率=[ (ρ总-ρ游离)/ρ总]×100%。计算得到3批脂质体的包封率为(59.93±0.67)%(n=3)。
2.4药效学研究
2.4.1S180瘤株的接种从液氮中取出S180肿瘤细胞冻存管,迅速置37 ℃温水中复苏。将复苏的肿瘤细胞悬液接种于小鼠腹腔内(0.2 ml/只),7 d后在无菌条件下抽取乳白色黏稠腹水, 在倒置显微镜下计数,肿瘤细胞活度>95%。加生理盐水稀释成肿瘤细胞混悬液,使瘤细胞数为1.8×107个/ml。将肿瘤细胞混悬液(0.1 ml/只)接种于昆明种小鼠左前腋下的皮下组织,共接种42只小鼠。
2.4.2白细胞计数、抑瘤率、脾脏指数和胸腺指数的测定将21只接种S180肿瘤细胞混悬液的小鼠随机分为3组:生理盐水组、奥沙利铂溶液组和OLCL组,每组7只。给药剂量为10 mg/kg,分别于接种后第4、7、10天尾静脉注射给药,给药后正常饲养。(1)白细胞计数:在接种S180肿瘤细胞悬液后d 13,于小鼠眼眶静脉丛取血测定白细胞。每次取血20 μl置肝素抗凝的EP管中,加入0.38 ml稀释液(即1.5%冰乙酸溶液,含1%龙胆紫),快速振荡30 s摇匀后,取10 μl滴至白细胞计数板上,盖上盖玻片,在倒置显微镜下计数。数四角大方格的白细胞总数,×50即为白细胞数(单位:个/mm3),再×106转换成白细胞计数(单位:×109/L),结果见表1。由表1可见,与生理盐水组相比,奥沙利铂溶液组的白细胞计数明显降低(P<0.05),而OLCL组基本无变化(P>0.05)。(2)抑瘤率:将小鼠断颈处死,完整剥离皮下肿瘤,称重,计算抑瘤率。抑瘤率=[ (wNS-wOXA)/wNS]×100%,式中wNS指生理盐水组平均瘤重,wOXA指给药组平均瘤重。采用独立t检验法进行统计学分析,结果见表1。由表1可见,OLCL组抑瘤率高,与奥沙利铂溶液组相比,存在显著性差异(P<0.05)。(3)脾脏指数和胸腺指数:将小鼠处死后,分别剥离脾脏和胸腺,称重,计算脾脏指数和胸腺指数。脾脏指数=(脾脏重量/小鼠体重)(mg/g),胸腺指数=(胸腺重量/小鼠体重)(mg/g),结果见表1。由表1可见,与生理盐水组相比,奥沙利铂溶液组小鼠的脾脏指数和胸腺指数明显降低(P<0.05),而OLCL组基本无变化(P>0.05),表明OLCL对脾脏和胸腺的影响明显小于奥沙利铂溶液。
2.4.3肿瘤生长情况另21只小鼠接种S180肿瘤
表1抑瘤率、S180荷瘤小鼠的白细胞计数、
脾脏指数及胸腺指数
Table 1The tumor inhibition rates,count of white
blood cells,spleen index and thymus index of
S180-bearing mice
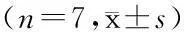
*P<0.05,与生理盐水组比较;△P<0.05,与奥沙利铂溶液组比较
细胞悬液后同2.4.2项法分组及给药。d 4~16每天测定小鼠体重及肿瘤体积,之后每隔一天测定一次,直到d 30,并观察小鼠的生长状态。各组小鼠的肿瘤体积变化见图2(A),体重变化见图2(B)。由图2可见,随着时间延长,肿瘤体积逐渐增大,小鼠体重均有增长。与奥沙利铂溶液组相比,OLCL组小鼠的肿瘤体积更小,而体重更重。从生存状态来看,OLCL组小鼠较活跃,活动状态明显优于生理盐水组和奥沙利铂溶液组。表明OLCL对小鼠正常体重和生存状态的影响比奥沙利铂溶液更小,而肿瘤抑制作用更强。
3讨论
本研究发现,与奥沙利铂溶液组相比,OLCL显著提高了奥沙利铂的抑瘤率。分析原因可能是由于奥沙利铂毒副作用较多,在抑制肿瘤细胞的同时,对正常组织、细胞也有损伤,造成机体功能下降;而脂质体可以提高药物的治疗指数并降低药物毒副作用。将PEG加入到脂质体膜材中,制备长循环脂质体, 进一步延长了脂质体的体内循环时间,降低了奥沙利铂的毒副作用,提高了药物的治疗效果[5,6]。奥沙利铂是一种细胞毒性药物,常见不良反应包括引起中性粒细胞和白细胞减少。本研究发现,奥沙利铂溶液组小鼠的白细胞计数显著低于生理盐水组,而OLCL组小鼠的白细胞计数与生理盐水组无显著性差异,这表明长循环脂质体减少了奥沙利铂对白细胞的杀伤作用。本研究采用脾脏指数和胸腺指数来评价机体免疫水平,由于实验后期各组小鼠体重存在一定差异,因此要比较脏器相对重量来进行免疫评价。脾脏指数和胸腺指数比较结果反映OLCL对免疫系统的副作用小,并未明显抑制小鼠的免疫器官功能,降低了对正常组织、细胞的损伤[7]。
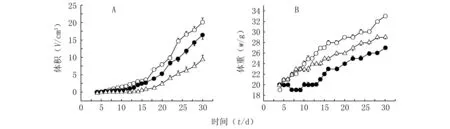
图2 小鼠肿瘤体积和体重随时间的变化曲线 Figure 2 The changing curves of tumor volume and body weight in mice A:肿瘤体积;B:小鼠体重; ○:生理盐水组; ●:奥沙利铂溶液组; △:奥沙利铂长循环脂质体组;n=7, ±s
【参考文献】
[1]倪睿,刘建平.脂质体作为抗肿瘤药物载体的应用研究[J].药学服务与研究,2008,8(2):89-92.
Ni Rui,Liu JianPing.Applied study of liposomes as carriers of anti-cancer drugs[J].Pharm Care Res, 2008,8(2):89-92.In Chinese with English abstract.
[2]张小洪,王建华.修饰性脂质体材料及其药学应用研究[J].化工新型材料,2013,41(5):153-155.
Zhang XiaoHong,Wang JianHua.Material of modified liposome and its applied research in pharmacy[J].New Chem Mater,2013,41(5): 153-155. In Chinese with English abstract.
[3]赵静,赵华,蒋心惠.HPLC法测定奥沙利铂脂质体中奥沙利铂的含量[J].中国药房,2010,21(32):3058-3060.
Zhao Jing,Zhao Hua,Jiang XinHui.Content determination of oxaliplatin in oxaliplatin liposome by HPLC[J].China Pharmacy,2010,21(32):3058-3060.In Chinese with English abstract.
[4]刘阳,郭伟英.Box-Behnken 设计法优化奥沙利铂脂质体的处方工艺[J].中国现代应用药学,2013,30(11):1196-1202.
Liu Yang,Guo WeiYing.Optimization of oxaliplatin liposome formulation by Box-Behnken experimental design[J].Chin J Mod Appl Pharm,2013,30(11):1196-1202.In Chinese with English abstract.
[5]徐洋,石莉,邓意辉.聚乙二醇-脂质衍生物修饰对脂质体稳定性的影响[J].药学学报,2011,46 (10):1178-1186.
Xu Yang,Shi Li,Deng YiHui.Effect of polyethylene glycol-lipid derivatives on the stability of grafted liposomes[J].Acta Pharm Sin,2011,46 (10):1178-1186.In Chinese with English abstract.
[6]时念秋,马毅,张大同,等.长循环脂质体在抗肿瘤药物中的应用进展[J].中国新药杂志,2008,17(3):190-194.
Shi NianQiu,Ma Yi,Zhang DaTong,etal.The progress in the application of long circulation liposomes drugs in anti-tumour therapy[J].Chin J New Drugs, 2008,17(3):190-194.In Chinese with English abstract.
[7]Zalba S,Navarro I,Trocóniz I F,etal.Application of different methods to formulate PEG-liposomes of oxaliplatin:evaluationinvitroandinvivo[J].Eur J Pharm Biopharm,2012,81(2):273-280.
[修回日期]2014-07-26
[本文编辑]兰芬

