异甘草酸镁对成纤维细胞NF-κB信号通路活性的影响
2016-01-11徐建国,刘继勇,胡晋红
·论著·
异甘草酸镁对成纤维细胞NF-κB信号通路活性的影响
徐建国1,刘继勇2,胡晋红2*
(1.第二军医大学基础医学部病理生理学教研室,上海 200433;2. 第二军医大学长海医院药学部,上海 200433)
[摘要]目的:研究异甘草酸镁(magnesium isoglycyrrhizinate,MgIG)对成纤维细胞核因子-kappa B(nuclear factor kappa B,NF-κB)信号通路活性的影响。方法:实验分6组,为空白对照组、TNF-α模型组、地塞米松(dexamethasone,DEX)阳性对照组和0.1、1、10 mg/ml的MgIG组。DEX组和MgIG组分别给予DEX(1 μg/ml)和MgIG(0.1、1、10 mg/ml)预处理4 h后,除对照组外,其余5组加入TNF-α(20 ng/ml)作用1.5 h。提取细胞核蛋白,以免疫印迹法检测NF-κB p65蛋白质表达。提取总RNA,用实时PCR技术检测细胞内IκBα mRNA表达。成纤维细胞经DEX和MgIG预处理4 h后加入TNF-α作用24 h(浓度同上),用报告基因技术检测NF-κB基因表达。结果:成纤维细胞经TNF-α作用1.5 h后,细胞核内NF-κB p65蛋白质表达量明显增加,IκBα mRNA表达上调;TNF-α作用24 h后,NF-κB基因上调。DEX预处理4 h,可以明显减少TNF-α引起的核内NF-κB p65蛋白质表达和细胞内IκBα mRNA表达,明显降低与TNF-α共作用24 h后NF-κB基因表达。MgIG处理成纤维细胞4 h后,能够明显降低TNF-α作用1.5 h后核内NF-κB p65蛋白质表达量,但对IκBα mRNA表达水平无明显影响。1、10 mg/ml的MgIG能够明显降低与TNF-α共作用24 h后NF-κB基因表达水平。结论:MgIG的抗炎作用与抑制NF-κB p65转位入核和NF-κB基因表达,从而抑制NF-κB信号通路活性相关,但与DEX不同的是MgIG不能改变IκBαmRNA表达水平。
[关键词]异甘草酸镁;NF-κB信号通路;抗炎作用
[中图分类号]R285.5,R966,R967[文献标志码]A
DOI:10.5428/pcar20150107
基金项目国家自然科学基金(81373896)
作者简介徐建国(男),博士.E-mail:chxdejia@hotmail.com
[收稿日期]2014-01-10
Effect of magnesium isoglycyrrhizinate on NF-κB signaling pathway activity in fibroblasts
XU JianGuo1,LIU JiYong2,HU JinHong2*(1. Department of Pathophysiology,Faculty of Basic Medical Sciences,Second Military Medical University,Shanghai 200433,China;2. Department of Pharmacy,Changhai Hospital,Second Military Medical University,Shanghai 200433,China)
ABSTRACT[]Objective: To investigate the effect of magnesium isoglycyrrhizinate (MgIG) on the activity of nuclear factor-kappa B (NF-κB) signaling pathway in fibroblast cells (FCs). Methods: The experiment consisted of 6 groups: the blank control group, the TNF-α model group, the dexamethasone (DEX) positive control group, and the 3 different concentrations of MgIG groups (i.e. 0.1,1 and 10 mg/ml subgroups). The DEX group and the MgIG groups were pretreated respectively with DEX (1 μg/ml ) and MgIG (0.1, 1 and 10 mg/ml) for 4 h. Then, with the exception of the control group, all the other 5 groups were treated with TNF-α(20 ng/ml) for 1.5 h. Nuclear proteins and total RNA were collected for detecting the expression levels of NF-κB p65 protein by Western blot. Total RNA was collected and used for detecting the expression levels of IκBα mRNA by real-time PCR. Following pretreatment with DEX and MgIG for 4 h, the FCs were treated with TNF-α(with the same dosage as the above) for 24 h, and then the expression levels of NF-κB were detected by reporter gene technology. Results: Following treatment with TNF-α for 1.5 h, the expression levels of intranuclear NF-κB p65 and intracellular IκBα mRNA in FCs were obviously increased, and 24-h treatment with TNF-α also increased the expression levels of NF-κB. Pretreatment with DEX for 4 h could decrease the expression levels of intranuclear NF-κB p65 and intracellular IκBα mRNA gene induced by TNF-α, and could also significantly reduce the expression levels of NF-κB following combined treatment with TNF-α for 24 h. Treatment of FCs with MgIG for 4 h could significantly lower the expression levels of intranuclear NF-κB p65 after pretreatment with TNF-α for 1.5 h. However, no significant effects could be noted on the expression levels of IκBα mRNA. MgIG with dosages of 1.0 and 10 mg/ml could significantly decrease expression levels of NF-κB following combined treatment with TNF-α for 24 h.Conclusion: The anti-inflammatory effect of MgIG was related with the inhibited NF-κB p65 nuclear transposition and NF-κB gene expression, and was also associated with the inhibited activity of NF-κB signaling pathway. When compared with DEX, MgIG failed to exert significant effect on the expression of IκBα mRNA.
[KEY WORDS]magnesium isoglycyrrhizinate; NF-κB signaling pathway; anti-inflammatory effect
[Pharm Care Res,2015,15(1): 22-26]
*通信作者(Corresponding author):胡晋红,E-mail: hjhong2016@126.com
异甘草酸镁(magnesium isoglycyrrhizinate,MgIG)属于18α-甘草酸中药单体制剂,与具有抗氧化、抗炎、抗肿瘤和保肝活性的异甘草素[1]同属于18α-甘草酸,于2005年开始应用于慢性肝炎的治疗,具有明显的护肝和抑制肝炎发展的作用,对接触性皮炎小鼠MgIG可明显减轻炎症反应[2],但其具体抗炎机制不详。本研究通过检测MgIG对成纤维细胞(fibroblast cells,FCs) NF-κB p65蛋白质表达的启动子变化情况,以及IκBα mRNA水平变化情况,研究MgIG是否通过改变NF-κB信号通路活性而发挥抗炎作用。
1材料和方法
1.1试剂和仪器异甘草酸镁(粉剂,批号:081003,江苏省正大天晴药业股份有限公司提供);TNF-α(美国PeproTech公司);地塞米松(DEX)(粉剂,美国Sigma公司);UNIQ-10柱式Trizol总RNA抽提试剂盒[生工生物工程(上海)股份有限公司];PrimeScriptTM RT-PCR Κit(日本Takara公司);兔多克隆NF-κB p65抗体、小鼠单克隆TATA框结合蛋白(TATA box binding protein,TBP)抗体(美国Santa Cruz公司);辣根酶标记山羊抗兔IgG(上海碧云天生物技术研究所);Micro BCA Protein Assay Kit、Supersignal West Femto 显影试剂盒(美国Pierce 公司);RIPA裂解液(北京百泰克生物技术有限公司);核蛋白抽提试剂盒(上海康成生物工程有限公司);QIAGEN Plasmid Midi Κits(德国Qiagen公司);pGL3-NF-κB-luc质粒和pRL-TΚ-Renilla-luc质粒均由第二军医大学基础医学部病理生理学教研室合成;常见细胞系转染试剂(上海生博生物医药科技有限公司);IκBα基因及内参还原磷甘油醛脱氢酶(GAPDH)的正向、反向引物均由生工生物工程(上海)股份有限公司合成,用聚丙烯酰胺凝胶电泳法(PAGE)纯化。IκBα 正向引物:5′-CTGAAGGCTACCAACTACAATG-3′,反向引物:5′-CATCAGCACCCAAGGACAC-3;GAPDH正向引物:5′-TGAAGGTCGGTGAACGGATTTGGC-3′,反向引物:5′-CATGTAGGCCATGAGGTCCACCAC-3′。Dual-Luciferase Reporter Assay System、Turner DesignsTD-20/20荧光检测仪(美国 Promega公司);PROTEAN II XL 多板电泳槽(美国Bio-Rad公司);ABI 7300 Real-Time定量PCR仪(美国ABI公司);紫外分光光度计(上海光学仪器五厂有限公司)。
1.2实验方法
1.2.1FCs的分离及培养参照朱全刚等[3]建立的方法:取包皮环切术健康人包皮(第二军医大学长海医院整形外科提供),置0.05%的醋酸洗必泰灭菌溶液中反复洗涤2次(约5 min), PBS漂洗3次。在无菌条件下剪去皮下组织,将含表皮及真皮的皮肤组织剪成0.5 cm×0.5 cm×0.5 cm大小的皮块,置于0.2%的分散酶液中,4 ℃消化过夜。次日用无菌镊子揭下已同真皮分离的表皮,剩下的真皮以无菌组织剪充分剪碎,置0.2% Ⅰ型胶原酶溶液中,37 ℃ 消化1 h,吹打制备细胞悬液,200目消毒尼龙筛过滤。200×g离心10 min,弃上清液。加含20%胎牛血清(FBS)及青霉素(100 U/ml)和链霉素(100 μg/ml)的RPMI1640培养液重悬细胞,以105个细胞/瓶接种于25 cm2的培养瓶内培养,每2~3 d换液一次。待细胞接近融合后传代扩大培养,以0.25%胰蛋白酶溶液消化进行传代,取第7~10代细胞用于实验。
1.2.2分组和给药FCs传代于培养瓶,以10%血清1640培养基培养至70%~80%融合后,换以无血清培养基培养,静息24 h后用于实验。实验分成6组,分别为空白对照组、TNF-α模型组、DEX阳性对照组和0.1、1、10 mg/ml的MgIG组。DEX组和MgIG组分别加入DEX(终浓度1 μg/ml)和MgIG(终浓度分别为0.1、1、10 mg/ml)预处理4 h,然后除对照组外,其余5组FCs均加入TNF-α(终浓度20 ng/ml)再培养1.5 h(TNF-α、DEX及MgIG均以无血清培养基溶解稀释)。经药物处理后的6组细胞用于NF-κB p65蛋白质和IκBα mRNA表达水平的测定。
1.2.3核内NF-κB p65蛋白质测定分别收集6组细胞于试管中,按照核蛋白抽提试剂盒说明书提取各组细胞内核蛋白,通过BCA法进行蛋白质定量,蛋白质稀释至相同浓度后,以8%的SDS-PAGE法分离蛋白质,采用Bio-Rad湿式电转移装置15 V,15 min;85 V,90 min将蛋白质转移至聚偏二氟乙烯(PVDF)膜上,依据Marker对应的65 κD条带和内参TBP的38 κD条带,将PVDF膜剪成合适大小,以含5%脱脂奶粉的TBST封闭1 h,分别加入NF-κB p65抗体、TBP抗体4 ℃过夜,随后TBST洗膜后,加入辣根酶标记马抗山羊IgG(1∶1000),室温反应10 min。扫描并通过Image J进行灰度分析,NF-κB p65蛋白质含量以NF-κB p65条带和内参TBP条带的灰度比值表示。
1.2.4IκBα mRNA表达水平的检测按照UNIQ-10柱式Trizol总RNA抽提试剂盒说明书,抽提25 cm2培养瓶培养的各组细胞总RNA。经紫外分光光度计和甲醛变性琼脂糖凝胶电泳进行RNA纯度和含量测定。参照PrimeScriptTM RT-PCR Κit说明书,进行cDNA反转录,获得的cDNA备用。采用20 μl反应体系进行实时PCR:cDNA template 2 μl,正向引物、反向引物各0.4 μl,DEPC水7.2 μl,SYBR Green 10 μl。实时PCR反应条件:采用2复孔进行反应,预变性:95 ℃ 10 s;变性+延伸:95 ℃ 5 s,60 ℃ 20 s,共40个循环;解离:65 ℃ 15 s。用实时定量PCR仪分析数据,结果用IκBα mRNA和内参(GAPDH)相对表达量表示。
1.2.5报告基因检测技术检测NF-κB基因表达另取FCs传代于24孔板,以10%胎牛血清1640培养基培养至70%~80%融合后,换以无血清培养基培养,静息24 h后,按照质粒转染试剂说明书,各培养孔内加入pGL3-NF-κB-luc质粒(为含有NF-κB启动子链接萤火虫蛋白基因的质粒)1 μg、 pRL-TΚ-Renilla-luc质粒(为含表达稳定的结构基因链接海肾素荧光蛋白基因的参照质粒)10 ng和SunbioTM Trans-EZ常见细胞系转染试剂1 μl,培养8 h后换以无血清DMEM培养基,静息培养24 h。依据1.2.2分组,DEX组和3个浓度MgIG组分别用相应药物预处理4 h,然后除对照组外,其余5组FCs均加入TNF-α再静息培养24 h。按照promega双荧光素酶报告基因检测试剂说明书进行荧光检测[4],分别记录560 nm处萤火虫荧光强度(fluorescence intensity,FI)和460 nm处海肾素FI,结果用FI560/FI460比值表示,为NF-κB基因相对表达水平。
2结果
2.1MgIG对TNF-α处理后细胞核内NF-κB p65蛋白质含量的影响实验结果如图1所示,TNF-α刺激真皮成纤维细胞1.5 h后,细胞核内NF-κB p65含量明显增多,表明NF-κB信号通路被激活。与单纯TNF-α(模型)组比较,DEX组细胞核内NF-κB p65含量明显降低(P<0.01),而MgIG同样能够明显降低核内NF-κB p65的含量(P<0.05),但降低程度小于DEX组,差异有统计学意义(P<0.05),说明MgIG能够抑制NF-κB p65信号通路的激活,但抑制作用明显弱于DEX。
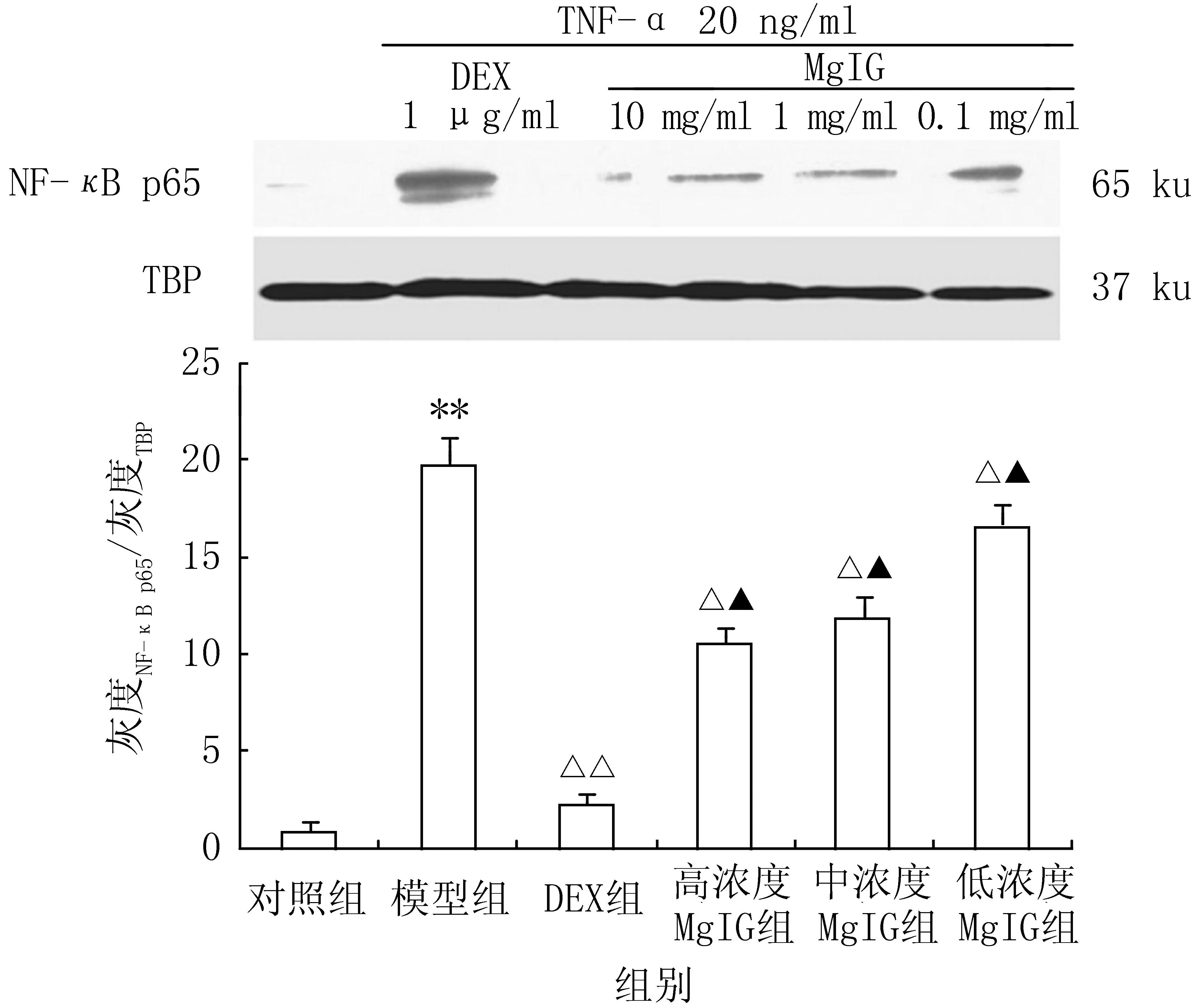
图1 异甘草酸镁对TNF-α引起成纤维 细胞NF-κB p65表达的影响 Figure 1 Effect of magnesium isoglycyrrhizinate (MgIG) on the expression of NF-κB p65 in fibroblast cells induced by TNF-α 模型组:TNF-α 20 ng/ml;DEX组:DEX 1 μg/ml+TNF-α 20 ng/ml;高浓度MgIG组:MgIG 10 mg/ml+TNF-α 20 ng/ml;中浓度MgIG组:MgIG 1 mg/ml+TNF-α 20 ng/ml;低浓度MgIG组:MgIG 0.1 mg/ml+TNF-α 20 ng/ml; **P<0.01,与对照组比较; △P<0.05, △△P<0.01,与模型 组比较; ▲P<0.05,与DEX组比较;n=3, ±s
2.2MgIG对IκBα mRNA表达的影响如图2所示,与对照组比较,模型组的IκBα mRNA水平明显增高,差异具有统计学意义(P<0.05)。与模型组比较,DEX组IκBα mRNA水平略有上调,差异无统计学意义(P<0.05);不同浓度MgIG作用后,仅低浓度组的IκBα mRNA的表达有明显改变(P<0.05)。
2.3MgIG对TNF-α引起成纤维细胞NF-κB基因表达的影响双荧光素酶报告基因检测结果如图2所示。与对照组比较,模型组在TNF-α刺激24 h后,FCs内NF-κB基因表达水平明显上调(P<0.01),DEX能够抑制TNF-α引起的NF-κB基因水平升高,而中、高浓度(1、10 mg/ml)的MgIG作用后也能明显降低NF-κB基因表达水平(P<0.05),但这种作用明显弱于DEX组(P<0.05)。
3讨论
甘草是一种传统中药,主要含有三萜类化合物(包括甘草次酸和甘草酸)和黄酮类化合物(包括甘草苷、异甘草素、异甘草酸苷和香豆素)[5]。临床使用其提取物应用于解毒剂、止痛剂、祛痰剂、止咳药、抗氧化剂和抗炎治疗的辅助用药。甘草甜素(甘草酸)是自甘草中提取的三萜类有效成分,临床显示其在治疗肝炎中有重要作用,同时在多种细胞中的实验表明,甘草酸具有抗氧化,减少caspase-3表达并降低其活性,减少细胞凋亡,抑制TNF-α、IFN-γ、IL-1β和IL-6等炎性细胞因子的表达,且其抗炎作用与促分裂原活化蛋白激酶(MAPK)信号系统密切相关[6]。作为其同分异构体的异甘草素对炎症的抑制同样发挥重要作用,在结肠炎相关的肿瘤发生研究中,发现其通过下调PGE2和IL-6信号通路而抑制M2巨噬细胞极化作用[7],但异甘草素对NF-κB信号通路的影响尚不确定。而甘草的另一个黄酮类化合物甘草查尔酮A通过抑制NF-κB p65中丝氨酸的磷酸化,显著抑制LPS信号通路发挥抗炎作用[8]。在作者的研究中发现MgIG发挥抗炎作用可能是通过抑制NF-κB信号通路活性起作用的。

图2 异甘草酸镁对TNF-α引起成纤维细胞IκBα mRNA和NF-κB基因表达的影响 Figure 2 The effects of magnesium isoglycyrrhizinate (MgIG) on the expressions of IκBα mRNA and NF-κB gene in fibroblast cells induced by TNF-α
NF-κB信号通路广泛参与调节免疫反应、炎症反应、细胞分化和凋亡,以及肿瘤形成等多种生物学功能。NF-κB转录因子通常与其抑制物IκBα结合形成复合物,并在胞浆与胞核间达到平衡,信号通路激活后短时间内复合物解聚,大量活性NF-κB迅速转移入核,与相应靶基因位点结合促进其表达。TNF-α是通路激活的主要介导因子,Shin等[9]证实甘草的另一个重要抗炎成分甘草醇通过抑制RAW264.7巨噬细胞的IκBα磷酸化,减少NF-κB p65转移入核,从而发挥抑制NF-κB信号通路活性的作用。在作者的研究中发现,TNF-α作用于FCs 1.5 h后能够明显提高核内NF-κB p65含量,而经MgIG预处理4 h的FCs,这种激活NF-κB p65转位入核的作用被明显减弱。MgIG对TNF-α引起的IκBα mRNA表达水平升高无明显影响,而DEX在与TNF-α联合作用后进一步增加了IκBα mRNA表达,说明IκBα可能没有参与TNF-α刺激作用下MgIG的抗炎作用过程。在NF-κB信号通路中,IκBα表达的增多能够抑制信号通路活性,TNF-α作用在激活NF-κB信号通路后可能负反馈引起了IκBα mRNA表达的增多,DEX在发挥广泛的抗炎过程中可能通过其他途径增加了IκBα mRNA的表达。另外此实验结果表明,MgIG对IκBα mRNA表达的影响不同于甘草醇[9],可能与Shin等使用的是LPS刺激模型有关。在TNF-α作用24 h后,FCs内NF-κB基因表达水平升高明显,而一定浓度的MgIG能够抑制其表达,这与Shin等的研究结果一致。近几年发现甘草次酸对恶性肿瘤有明显的抑制作用,18β-甘草次酸能够通过PI3K/Akt依赖的NF-κB信号通路的活性,下调MMP-9和VEGF的表达,从而改变肿瘤细胞侵袭能力等生物学活性[10]。甘草制剂这种对NF-κB信号通路活性的抑制作用在作者研究18α-甘草酸MgIG对FCs的影响中也得到证实。
【参考文献】
[1]Kim Y M,Kim T H,Kim Y W,etal. Inhibition of liver X receptor-α-dependent hepatic steatosis by isoliquiritigenin, a licorice antioxidant flavonoid, as mediated by JNK1 inhibition[J]. Free Radic Biol Med,2010,49(11):1722-1734.
[2]徐建国,刘继勇,彭程,等. 异甘草酸镁抗小鼠接触性过敏性皮炎的药效学研究[J].中国中药杂志,2010,35(10):1311-1314.
Xu JianGuo,Liu JiYong,Peng Cheng,etal. Effect of magnesium isoglycyrrhizinate on allergic contact dermatitis (ACD) in mice[J].China J Chin Mater Med, 2010,35(10):1311-1314. In Chinese with English abstract.
[3]朱全刚,胡晋红,范国荣,等. 酮洛芬异丙酯在皮肤细胞中的代谢[J].中国医院药学杂志, 2002,22(4):195-197.
Zhu QuanGang,Hu JinHong,Fan GuoRong,etal. Metabolism of ketoprofen isopropyl ester in skin cells[J]. Chin Hosp Pharm J, 2002,22(4):195-197. In Chinese with English abstract.
[4]俞石芳,李强,洪俊英,等. 双荧光素酶报告基因系统验证has-miR-326对BCL2L1、BAK1的靶向调控[J]. 中国卫生检验杂志, 2014,24(8):1156-1158.
Yu ShiFang,Li Qiang,Hong JunYing,etal. The targeted-regulating role of hsa-miR-326 on geneBCL2L1 andBAK1 by dual luciferase reporter system[J]. Chin J Health Lab Technol,2014,24(8):1156-1158. In Chinese with English abstract.
[5]Dong Yi,Zhao MouMing,Zhao TianTian,etal. Bioactive profiles, antioxidant activities, nitrite scavenging capacities and protective effects on H2O2-injured PC12 cells ofGlycyrrhizaglabraL. leaf and root extracts[J]. Molecules, 2014, 19(7): 9101-9113.
[6]Ye ShaoJun,Zhu Yi,Ming YingZi,etal. Glycyrrhizin protects mice against renal ischemia-reperfusion injury through inhibition of apoptosis and inflammation by downregulating p38 mitogen-activated protein kinase signaling[J]. Exp Ther Med, 2014,7(5):1247-1252.
[7]Zhao HaiXia,Zhang XinHua,Chen XueWei,etal. Isoliquiritigenin, a flavonoid from licorice, blocks M2 macrophage polarization in colitis-associated tumorigenesis through downregulating PGE2and IL-6[J]. Toxicol Appl Pharmacol, 2014, 279(3):311-321.
[8]Furusawa J,Funakoshi-Tago M,Tago K,etal. Licochalcone A significantly suppresses LPS signaling pathway through the inhibition of NF-κB p65 phosphorylation at serine 276[J]. Cell Signal,2009,21(5):778-785.
[9]Shin E M,Zhou HongYu,Guo LianYu,etal. Anti-inflammatory effects of glycyrol isolated fromGlycyrrhizauralensisin LPS-stimulated RAW264.7 macrophages[J]. Int Immunopharmacol,2008,8(11):1524-1532.
[10]Jayasooriya R G P T,Dilshara M G,Park S R,etal. 18β-Glycyrrhetinic acid suppresses TNF-α induced matrix metalloproteinase-9 and vascular endothelial growth factor by suppressing the Akt-dependent NF-κB pathway[J]. Toxicol In Vitro,2014,28(5):751-758.
[修回日期]2014-11-27
[本文编辑]贡沁燕

