μ型阿片受体参与CFA大鼠慢性炎性痛的外周调控
2016-01-09何晓芬,蒋永亮,尹小虎等
研究报告
μ型阿片受体参与CFA大鼠慢性炎性痛的外周调控
何晓芬,蒋永亮,尹小虎,沈亚芳,方剑乔
(浙江中医药大学第三临床医学院,杭州310053)
【摘要】目的观察大鼠慢性炎性痛时背根神经节(dorsal root ganglion,DRG)μ型阿片受体(mu opioid receptor,MOR)表达的变化及炎症局部注射MOR激动剂和拮抗剂对痛阈的干预作用,探讨MOR在慢性炎性疼痛中的作用。 方法 足底注射弗氏完全佐剂(complete freund’s adjuvant,CFA)制备大鼠慢性炎性痛模型,采用免疫组化法检测DRG MOR阳性细胞的表达;经大鼠足跖背部分别注射MOR激动剂、拮抗剂,采用辐射热法检测给药前后大鼠痛阈的变化。 结果 足底注射CFA诱导出大鼠慢性炎性痛,在造模后第18天,痛阈依然低于正常对照组;免疫组化结果表明,与正常对照组相比,CFA大鼠DRG MOR阳性细胞表达增多(P < 0.01);足跖背部注射MOR激动剂减轻CFA大鼠的疼痛,对正常大鼠痛阈无影响;足跖背部注射MOR拮抗剂加重CFA大鼠的疼痛,对正常大鼠痛阈无影响。 结论DRG神经元MOR在慢性炎性痛时表达上调,参与慢性炎性痛的外周调控,可能有助于防止慢性痛的进一步加重。
【关键词】外周;μ型阿片受体;慢性痛;炎症;
[基金项目]国家自然科学基金资助项目(81072855,81303039);浙江省自然科学基金资助项目(LY12H27015,Z2100979);国家中医药管理局重点学科(针灸学)建设经费资助(国中医药发[2009]30号)。
[作者简介]何晓芬(1986-),女,助理研究员。研究方向;针刺镇痛与免疫调节的相关性研究。E-mail: zjhxf1986@163.com。
[通讯作者]方剑乔(1961-),男,教授,博士生导师。研究方向:针刺镇痛与免疫调节的相关性研究。E-mail: fangjianqiao7532@163.com。
【中图分类号】R332【文献标识码】 A
doi:10.3969.j.issn.1671.7856. 2015.001.005
The involvement of mu opioid receptorin peripheral regulation of
chronic inflammatory pain induced by CFAin rats
HE Xiao-fen,JIANG Yong-liang,YIN Xiao-hu,SHEN Ya-fang,FANG Jian-qiao
(The Third Clinical Medical College, Zhejiang Chinese Medical University, Hangzhou 310053, China)
Abstract【】ObjectiveTo investigate the change of mu opioid receptor (MOR) in dorsal root ganglion (DRG) in rat chronic inflammatory pain model and the effect of MOR agonist and antagonis tintraplantarly (i.pl.) injected on pain threshold, so as to determine the role of peripheral MOR in chron in inflammatory pain. Methods Chronicin flammatory pain model was established by i.pl. injection of CFA in rats. The expression of MOR in DRG was detected by immunohistochemistry. Pain threshold before and after i.pl. injection of MOR agonist and antagonist was measured by radiant heat method. ResultsRats suffered from an intraplantar injection of CFA developed chronic inflammatory pain,and the painthreshold still reduced on 18 day after CFA injection compared to that in the normal group. Immunohistochemistry staining revealed that compared with the normal group, the expression of MOR in DRG of CFA rats was increased (P<0.01). After the paw dorsal surface injection of MOR agonist, the pain threshold of CFA rats was increased, while that of normal rats exhibited no significant change. After the paw dorsal surface injection of MOR antagonist, the pain threshold of CFA rats was reduced, while that of normal rats had no significant change. Conclusion Under chronic inflammatory pain condition, DRG MOR expressionis enhanced, which participates in the regulation of chronic inflammatory pain, and may contribute to the prevention of further more serious pain.
【Key words】Periphery;Mu opioid receptor;Chronic pain;Inflammation
疼痛的慢性化是当前疼痛治疗的难点。传统的阿片类药物作为临床上最常用的镇痛药物之一[1-2],主要通过激活中枢阿片受体发挥镇痛作用,但是除镇痛作用外,基于中枢神经系统的镇痛药物具有成瘾性、耐药性和呼吸抑制等中枢副作用[3-4],因此,寻找能有效控制疼痛、减少毒副作用的新型镇痛药物已成为研究的热点。研究表明,阿片受体在背根神经节(dorsal root ganglion,DRG)合成,转运至中枢和外周神经末梢[5]。阿片受体是介导疼痛调节的重要受体之一,通过结合配体阿片肽发挥镇痛作用。在弗氏完全佐剂(complete freund’s adjuvant,CFA)诱导的急性炎性痛模型中,在造模后2 h和96 h,DRG μ阿片受体(mu opioid receptor, MOR)的mRNA表达水平明显增加[6]。研究表明阿片受体参与早期炎性痛的调节[7-8]。但目前尚不清楚慢性炎性痛时DRG MOR表达的变化情况,及是否也参与慢性炎性痛的调制。
本实验采用CFA制作大鼠慢性炎性痛模型,观察慢性炎性痛时大鼠DRG MOR表达的变化,观察炎症局部注射MOR激动剂、拮抗剂对慢性炎性痛的干预作用,探讨外周MOR受体是否参与慢性炎性痛的调节,为临床上阿片类药物的外周局部应用提供科学依据。
1材料和方法
1.1实验动物
选用清洁级雄性Wistar大鼠,体重为190±10 g,购自中国科学院上海实验动物中心【SCXK (沪) 2008-0016】,由浙江中医药大学实验动物中心【SYXK (浙) 2013-0184】饲养。
1.2主要试剂和仪器
试剂:弗氏完全佐剂(complete freund’s adjuvant,CFA)由美国Sigma公司提供;MOR抗体由美国abcam公司提供;生物素标记山羊抗兔IgG和辣根酶标记链酶卵白素均由北京中杉金桥生物技术有限公司提供;MOR拮抗剂和MOR激动剂均由Tocris公司提供。
仪器:足底测量仪(意大利UGO BASILE公司)、DM2500显微镜(德国徕卡)、Thermo冰冻切片机(美国赛默飞世尔科技公司)等。
1.3方法
1.3.1慢性炎性痛模型的制备
除正常(normal)组大鼠外,其余各组大鼠在右后足足底内注射弗氏完全佐剂(CFA)0.1 mL/只,建立大鼠慢性炎性痛模型。正常组大鼠右后足足底内注射相同剂量生理盐水。
1.3.2痛阈测定
采用足底测量仪检测各组大鼠患侧热缩腿阈值(paw withdrawal latency, PWLs)作为痛阈指标。具体操作如下:测量前,将大鼠置于透明塑料盒30 min。待大鼠安静后,将聚焦的红外热源置于大鼠右后足中央,避开足垫,启动“START”按钮对足底进行热刺激,仪器自动记录大鼠缩足反应时的潜伏期和红外辐射强度。20 s是刺激时间最上限,30为最大热辐射强度。连续测量3次,每次间隔5 min。
1.3.3样本采集
大鼠用10%水合氯醛(0.35 mL/100 g)腹腔麻醉,开胸暴露心脏,经升主动脉用生理盐水150 mL快速灌注,再缓慢灌注4 %多聚甲醛 150 mL,然后用500 mL 4 %多聚甲醛溶液先快后慢滴注,快速取出大鼠L5DRG,4 %多聚甲醛溶液中后固定2 h,15%、30%蔗糖溶液梯度脱水,液氮速冻,-80℃保存备用。
1.3.4免疫组化检测CFA大鼠L5DRG的MOR阳性细胞表达
L5DRG行冰冻切片(14 μm),将切片贴于涂有多聚赖氨酸的载玻片上,PBS洗10 min×3次;0.3% H2O237℃孵育30 min以消除内源性过氧化物酶;5%山羊血清37℃孵育30 min以封闭非特异性位点;加兔抗大鼠MOR抗体(1∶2500),4℃孵育过夜;生物素化山羊抗兔IgG(1∶750)中,37℃孵育1 h;辣根酶标记链酶亲合素(1∶400)中,37℃孵育1 h;切片上滴加新鲜配置的 DAB显色液,染色30 s;双蒸水清洗5 min,终止染色反应,自然风干;酒精脱水,二甲苯透明处理,中性树胶封片。每次孵育之间,切片用 PBS清洗 10 min×3次。显微镜下观察以细胞染成棕黄色,细胞轮廓清晰为阳性细胞。
1.3.5足跖局部注射MOR激动剂试验
为进一步验证DRG上调的MOR是否参与慢性炎性痛的调节以及为临床局部应用阿片类药物提供理论基础,在正常大鼠和CFA慢性炎性痛大鼠足跖局部注射MOR激动剂。实验分为模型+生理盐水组、模型+MOR激动剂组、正常+MOR激动剂组,模型+MOR激动剂组和正常+MOR激动剂组大鼠在造模后D18在大鼠足跖局部注射4 μg MOR激动剂,模型+生理盐水组大鼠足底内注射相同剂量0.05 mL生理盐水。检测注射生理盐水或MOR激动剂之前及注射后30 min的痛阈。
1.3.6足跖局部注射MOR拮抗剂实验
为验证DRG上调的MOR是否参与慢性炎性痛的调节,我们在正常大鼠和CFA慢性炎性痛大鼠足跖局部注射MOR拮抗剂。实验分为模型+生理盐水组、模型+MOR拮抗剂组、正常+MOR拮抗剂组,模型MOR拮抗剂组和正常+MOR拮抗剂组大鼠在造模后第18天在大鼠足跖局部注射4 μg MOR拮抗剂,模型对照+生理盐水组大鼠足底内注射相同剂量0.05 mL生理盐水。检测注射生理盐水或MOR 拮抗剂之前及注射后30 min的痛阈。
1.3.7统计方法
统计分析采用SPSS 16.0,实验数据以均数±标准误(mean±SEM)表示。两组比较采用t检验。实验处理前后的统计用配对T检验。P<0.05作为差异有统计学意义的检验标准。
2结果
2.1CFA大鼠痛阈水平
如图1所示,两组大鼠基础痛阈无显著差异(P> 0.05)。CFA足底注射后大鼠足跖出现明显红、肿(彩插4图2),CFA注射后显著降低大鼠痛阈,在第18天,痛阈依然显著低于正常组大鼠(P< 0.01)。
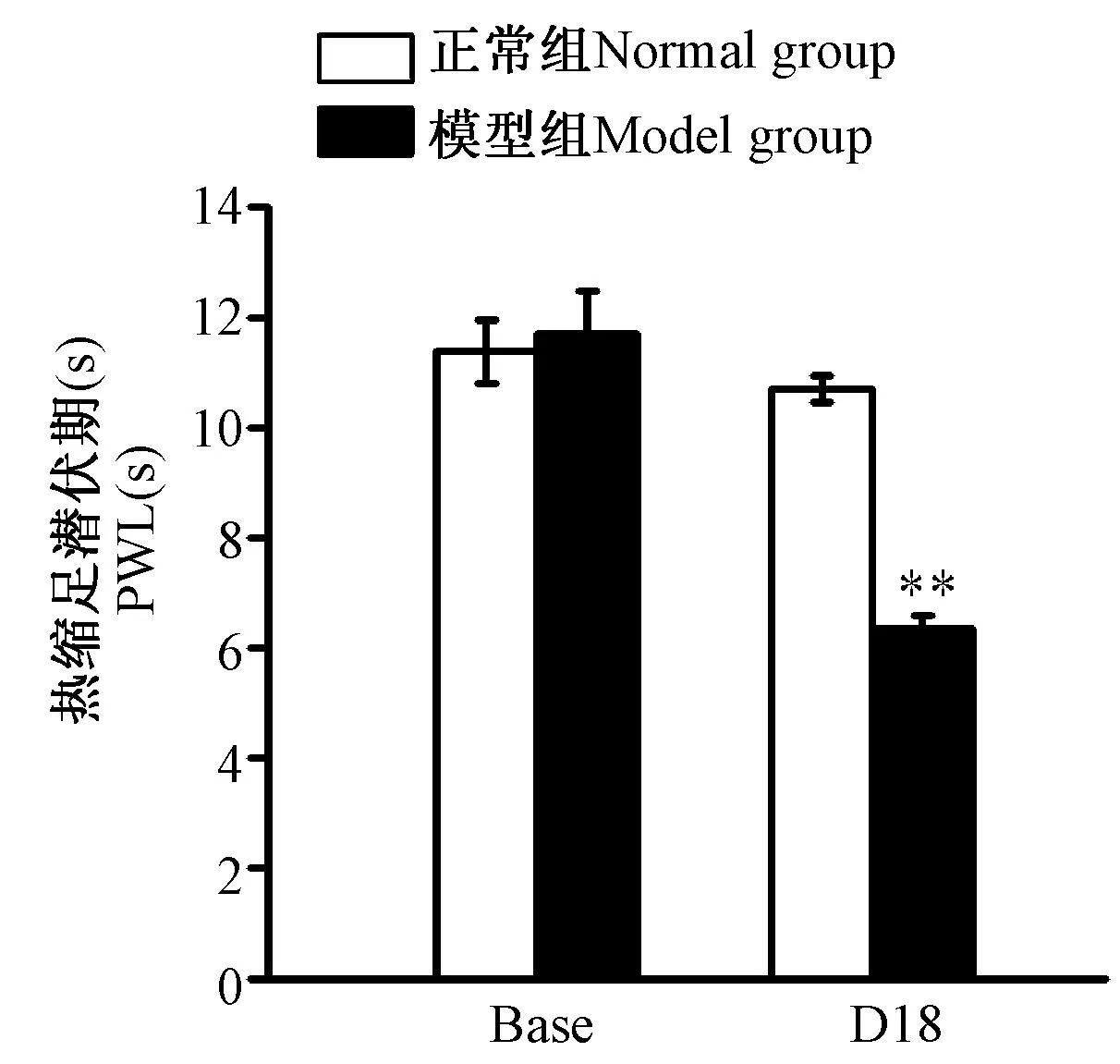
注:与正常组比较, **P< 0.01。 图1 CFA大鼠患侧PWL水平 Note: Compared with normal group,**P < 0.01. Fig.1 Ipsilateral paw PWL level of CFA model rats
2.2CFA大鼠患侧L5DRG MOR阳性细胞表达水平
采用免疫组织化学法检测大鼠患侧L5DRG MOR阳性细胞表达。CFA大鼠患侧L5DRG MOR阳性细胞表达情况(彩插4图3)。如图4所示,与正常组比较,CFA组大鼠患侧L5DRG MOR阳性细胞表达增多44.79%(P< 0.01)
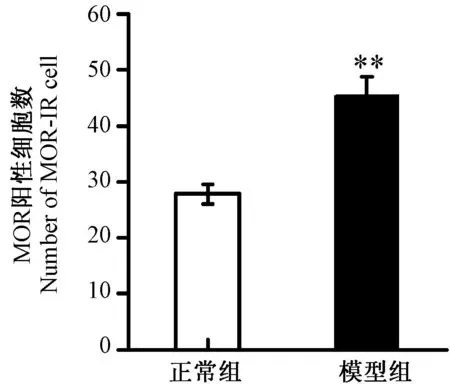
注:与正常组比较, **P < 0.01。 图4 CFA模型大鼠患侧L 5 DRG MOR 阳性细胞表达水平 Note: Compared with normal group, **P < 0.01. Fig.4 Ipsilateral L 5 DRG MOR expression of CFA model rats
2.3足跖背部注射MOR激动剂对大鼠痛阈的作用
如图5A示:在CFA造模后18 d,足跖背部注射MOR激动剂之前,两组大鼠痛阈无显著差异(P> 0.05);足跖背部注射MOR激动剂之后,与模型+生理盐水组比较,模型+MOR激动剂组大鼠痛阈显著提高27.95%(P< 0.01)。如图5B示:在CFA造模后18 d,CFA模型大鼠足跖背部注射MOR激动剂能显著提高CFA模型大鼠的痛阈(P< 0.01),正常大鼠足跖背部注射MOR激动剂则对正常大鼠痛阈无显著影响(P> 0.05)。

注: A:与模型+生理盐水组比较, **P < 0.01; B:注射MOR激动剂之后与注射MOR激动剂之前比较, ##P < 0.01。 图5 足跖背部注射MOR激动剂对大鼠痛阈的作用 Note: A. Compared with model+saline group, **P < 0.01; B.Compared with before injection of MOR agonist, ##P < 0.01. Fig.5 The effect of paw dorsal surface injection of MOR agonist on PWL
2.4足跖背部注射MOR拮抗剂对大鼠痛阈的作用
如图6A示:在CFA造模后18 d,足跖背部注射MOR拮抗剂之前,两组大鼠痛阈无显著差异(P> 0.05);足跖背部注射MOR拮抗剂之后,与模型+生理盐水组相比,模型+MOR拮抗剂组大鼠痛阈显著降低29.21%(P< 0.01)。如图6B:在CFA造模后18 d,CFA模型大鼠足跖背部注射MOR拮抗剂能显著降低CFA模型大鼠的痛阈(P< 0.01),正常大鼠足跖背部注射MOR拮抗剂则对正常大鼠痛阈无明显影响(P> 0.05)。

注:A:与模型+生理盐水组比较, **P < 0.01; B:注射MOR拮抗剂之后与注射MOR拮抗剂之前比较, ##P < 0.01。 图6 足跖背部注射MOR拮抗剂对大鼠痛阈的作用 Note: A. Compared with CFA+saline group, **P<0.01; B.Compared with before injection of MOR antagonist, ##P<0.01. Fig.6 The effect of paw dorsal surface injection of MOR antagonist on PWL
3讨论
CFA模型是炎性痛的经典模型,在造模后1 d即可出现足跖局部的红、肿、热痛觉过敏等类似临床炎性痛的症状和体征[9]。本研究中足底注射CFA 18 d后,模型大鼠热痛觉过敏依然存在;应用免疫组化方法发现造模18 d后模型大鼠患侧L5DRG的MOR阳性细胞数明显高于正常对照组。阿片受体作为疼痛调节的重要受体之一,主要分布在较细的DRG神经元、C纤维和Aδ纤维[10-11],与疼痛信号的产生、传递和调节密切相关,在炎性痛调制中起着重要作用。已有研究表明炎症时DRG MOR的表达增强[13-15],通过轴突转运,阿片受体可从DRG转运至神经元末梢[16-17]。这些表明,慢性炎症本身可引起DRG神经元MOR的上调,这些神经可塑性变化是否对慢性炎性痛发挥着负反馈调节作用有待明确。
通过本研究证实,在炎症局部注射MOR激动剂可产生镇痛作用,注射MOR拮抗剂则使疼痛加剧,而在正常大鼠足跖局部注射MOR激动剂或拮抗剂对大鼠痛阈无明显影响。结果提示慢性炎症本身引起的DRG神经元MOR上调,可能有助于防止疼痛进一步加重,对炎性痛起着负反馈的调制作用。其可能机制是炎症上调DRG MOR表达,并促进阿片受体轴突转运至初级传入神经元末梢,使得内源性阿片类物质更易与初级传入神经元上的阿片受体接近,激活与阿片受体耦联的Gi/Go蛋白,抑制腺苷酸环化酶活性,使cAMP减少,或者通过抑制钙通道,从而使得Ca2+内流减少,K+外流增加,使得传导痛觉信息的神经元兴奋性降低,从而抑制疼痛传递[18];或者进一步抑制感觉神经末梢释放P物质、降钙素基因相关肽和其它传递伤害性信息的神经递质,从而抑制疼痛进一步加重[19]。
综上所述,慢性炎性痛时,DRG神经元MOR表达上调,可能参与慢性炎性痛的负反馈调制。DRG神经元中阿片受体的上调,为局部应用阿片激动剂产生镇痛作用提供基础。我们的研究结果将为临床上阿片类药物的外周局部用药以提示,更为重要的是阿片类药物的外周镇痛作用的发现使开发不透过血脑屏障、避免中枢副作用的镇痛作用成为可能。
参考文献:
[1]White PF, Kehlet H. Improving postoperative pain management: what are the unresolved issues[J]? Anesthesiology, 2010, 112(1): 220-225.
[2]Jensen MK, Thomsen AB,Hojsted J. 10-year follow-up of chronicnon-malignant pain patients: Opioid use, health related quality of lifeand health care utilization[J]. Eur J Pain, 2005,10(5):423-433.
[3]Marinangeli F, Ciccozzi A, Leonardis M,etal. Use of strong opioidsin advanced cancer pain:a randomized trial[J]. J Pain Symptom Manage,2004,27(5):409-416.
[4]De Leon-Casasola OA. Current developments in opioid therapy for management of cancer pain[J]. Clin J Pain, 2008, 24: 3-7.
[5]Coggeshall RE, Zhou S, Carlton SM. Opioid receptors on peripheral sensory axons[J]. Brain Res, 1997, 764(1-2):: 126-132.
[6]Puehler W, Rittner HL, Mousa SA,etal. Interleukin-1 beta contributes to the upregulation of kappa opioid receptor mrna in dorsal root ganglia in response to peripheral inflammation[J]. Neuroscience, 2006, 141(2): 989-998.
[7]Tanaka N, Sakahashi H, Sato E,etal. The efficacy of intra-articular analgesia after total knee arthroplasty in patients with rheumatoid arthritis and in patients with osteoarthritis[J]. J Arthroplasty, 2001, 16(3): 306-311.
[8]Stein C, Hassan AH, Lehrberger K,etal. Local analgesic effect of endogenous opioid peptides[J]. Lancet, 1993, 342(8867): 321-324.
[9]Yu L, Yang F, Luo H,etal. The role of TRPV1 in different subtypes of dorsal root ganglion neurons in rat chronic inflammatory nociception induced by complete Freund’s adjuvant[J]. Mol Pain, 2008, 4: 61.
[10]Coggeshall RE, Zhou S, Carlton SM. Opioid receptors on peripheral sensory axons[J]. Brain Res, 1997, 764(1-2):126-132.
[11]Zhang JQ, Nagata K, Iijima T. Scanning electron microscopy and immunohistochemical observations of the vascular nerve plexuses in the dental pulp of rat incisor[J]. Anat Rec, 1998, 251(2): 214-220.
[12]Ji RR, Zhang Q, Law PY,etal. Expression of mu-, delta-, and kappa-opioid receptor-like immunoreactivities in rat dorsal root ganglia after carrageenan-induced inflammation[J]. J Neurosci, 1995, 15(12): 8156-8166.
[13]Schäfer M, Imai Y, Uhl GR,etal. Inflammation enhances peripheral mu-opioid receptor-mediated analgesia, but not mu-opioid receptor transcription in dorsal root ganglia[J]. Eur J Pharmacol, 1995, 279(2-3): 165-169.
[14]Puehler W, Zöllner C, Brack A,etal. Rapid upregulation of mu opioid receptor mRNA in dorsal root ganglia in response to peripheral inflammation depends on neuronal conduction[J]. Neuroscience, 2004, 129(2): 473-479.
[15]Puehler W, Rittner HL, Mousa SA,etal. Interleukin-1 beta contributes to the upregulation of kappa opioid receptor mrna in dorsal root ganglia in response to peripheral inflammation[J]. Neuroscience, 2006, 141(2): 989-998.
[16]Mousa SA, Cheppudira BP, Shaqura M,etal. Nerve growth factor governs the enhanced ability of opioids to suppress inflammatory pain[J]. Brain, 2007, 130(Pt 2): 502-513.
[17]Hassan AH, Ableitner A, Stein C,etal. Inflammation of the rat paw enhances axonal transport of opioid receptors in the sciatic nerve and increases their density in the inflamed tissue[J]. Neuroscience, 1993, 55(1): 185-195.
[18]Largent-Milnes TM, Guo W, Wang HY,etal. Oxycodone plus ultra-low-dose naltrexone attenuates neuropathic pain and associated mu-opioid receptor-Gs coupling[J]. J Pain, 2008, 9(8): 700-713.
[19]Khasabova IA, Harding-Rose C, Simone DA,etal. Differential effects of CB1 and opioid agonists on two populations of adult rat dorsal root ganglion neurons[J]. J Neurosci, 2004, 24(7): 1744-1753.
〔修回日期〕2014-11-21
