水稻HL—CMS育性恢复蛋白的原核表达及纯化
2016-01-08傅静谭艳平刘学群王春台
傅静 谭艳平 刘学群 王春台


摘要:将水稻目地基因Rf6连接到载体PMD-18T上,测序正确后将目的片段连接到含有GST标签的pGEX-6P-1原核表达载体上,确认正确的重组质粒转化到BL21菌株;通过LB培养至对数生长期后,加入IPTG进行诱导表达,经SDS-PAGE和Western Blot检测是否诱导出目的条带,并且经过Glutathione Resin亲和层析系统纯化及检测。结果表明,20 ℃,4 h,0.3 mmol/L IPTG条件下可诱导出可溶性蛋白,经纯化得到可溶性带GST标签的融合蛋白。
关键词:水稻;恢复基因(Rf6);融合蛋白GST-RF6;原核表达
中图分类号:S511;Q78 文献标识码:A 文章编号:0439-8114(2015)23-6047-04
DOI:10.14088/j.cnki.issn0439-8114.2015.23.064
Prokaryotic Expression,Purification of Fertility Restoration Protein for HL-type Cytoplasmic Male Sterility in Rice
FU Jing, TAN Yan-ping, LIU Xue-qun, WANG Chun-tai
(HuBei Provincial Key Laboratory for Protection and Application of Special Plants in Wuling Area of China/Key Lab for Biotechnology of State Ethnic Affairs Commission, College of Life Science, South-Central University for Nationalities, Wuhan 430074, China)
Abstract:To achieve activated fertility restorarion protein in vitro, the gene of rice was cloned into PMD-18T for sequencing. Then the gene was connected with prokaryotic expression vector pGEX-6P-1 containing the GST-tag and the recombinant prokaryotic expression vector was transformed into E.coli strain BL21. The GST-tagged fusion protein was induced with IPTG in E.coli strain BL21,and confirmed by SDS-PAGE and Western Blot analysis. The results showed that of the soluble fusion protein was induced by 0.3 mmol/L IPTG at 20 ℃ for 4 h, was and purified by Glutathione resin.
Key words:rice; Fertility restoration-6(Rf6); GST-Rf6 fusion protein;prokaryotic expression
细胞质雄性不育(Cytoplasmic male sterility, CMS)不能产生有功能的花粉且具有母性遗传的特征[1]。CMS是线粒体不育基因和核基因的互作所致[2]。一方面,在高等植物中CMS普遍存在[3-5],其作为农作物杂种优势利用的基础,具有极其重要的生产利用价值;另一方面,它又是研究细胞质遗传、核质互作和花药发育的好材料[6]。
三系杂交水稻中,国际公认的细胞质雄性不育水稻类型主要有包台型、红莲型和野败型3种。20世纪70年代初,武汉大学[7]采用常规水稻与野生稻品种互为父母本进行大量杂交,培育出红莲型杂交水稻。多年来,红莲型杂交水稻已经在基础性研究、应用性研究和产业化等多方面取得了重要进展。
Huang等[8]发现只含有一个育性恢复基因Rf5或Rf6的杂交F1代花粉只有50%是正常可育,然而同时含有Rf5和Rf6的群体花粉有75%是正常可育,并对F2和BC1F1遗传群体分析揭示Rf5与Rf6是两个非等位基因,Rf6位于第8号染色体短臂的标记RM7037和RM22355之间。Rf5与Rf6分别独立恢复HL-CMS水稻,模式是配子体恢复模式。
目前,关于恢复基因Rf6的表达模式、相互作用的不育基因以及水稻育性恢复的分子机理等问题亟需解决。笔者通过对水稻Rf6与其同源的PPR序列进行比对后设计引物,分离Rf6特异序列,通过基因克隆和原核表达分离纯化其特异蛋白,为探索水稻Rf6的恢复育性的作用机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试材料 植物材料粤泰A(YTA)、9311、大肠杆菌菌株BL21(DE3)和DH5α、原核表达载体pGEX-6p-1,均由中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室提供。
1.1.2 主要仪器 Centrifuge 5415D、5417R和5810R离心机,购自德国Eppendorf公司;CR22G 高速离心机,购自日本Hitachi公司;C1000 Touch Thermal Cycler PCR仪,购自美国Bio-RAD公司;DYY-5 型稳压稳流电泳仪,购自北京六一仪器厂;凝胶成像系统,购自美国Bio-RAD公司;752N型紫外可见分光光度计,购自上海精科公司;Soniprep 150型超声破碎仪,购自日本SANYO公司;Model 1000 型分子杂交箱,购自美国Robbins Scientific Corporation;FB-SDB-2020型半干式转印槽,购自美国Fisher Scientific公司;Gene Genius系统,购自英国SYNOPTICS LTD。
1.1.3 主要试剂 限制性内切酶BamHⅠ、EcoRⅠ,PCR 扩增反应所需dNTP,rTaq酶,10×PCR Buffer,T载体PMD-18T,蛋白分子量Marker和DNA分子量Marker,T4 DNA 连接酶,皆购自于Takara公司;Pageruler Prestained蛋白分子量Marker,购自FREMENTAS公司。DNA凝胶回收及清洁试剂盒,购自Axygen 公司;GST抗体及二抗,均购自南京金斯瑞生物技术有限公司;引物及测序均在武汉擎科生物技术有限公司进行。
1.2 方法
1.2.1 原核表达中间载体的构建 从NCBI上数据库中获得Rf6基因序列,以BamHⅠ、EcoRⅠ为接头设计引物,以9311为模板PCR扩增目的片段。PCR引物序列为F(5′-CGGGATCCCATGACAAGAGGACCAG-3′),R(5′-CGGAATTCGTTATAAGTGACGACATCCG-3′)。PCR体系:6.7 μL ddH2O,1 μL 10×PCR buffer,0.2 μL引物F(10 μmol/L),0.2 μL引物R(10 μmol/L),0.8 μL dNTP(2.5 mmol/L),1 μL模板DNA,0.1 μL Taq酶(5 U/μL),共10 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s;59 ℃退火30 s;72 ℃延伸90 s,重复34个循环;72 ℃延伸10 min。扩增反应完成后用DNA凝胶回收试剂盒纯化产物,连接载体PMD-18T,热击转化入宿主菌DH5α,挑取单克隆培养后,利用SDS碱裂解提取质粒DNA进行PCR检测及双酶切检测,将检测为阳性的重组质粒送擎科生物技术有限公司测序。
1.2.2 原核表达载体的构建 将pGEX-6P-1和测序正确的原核表达中间载体同时用BamH Ⅰ、EcoRⅠ双酶切,37 ℃酶切6 h。回收纯化暴露粘性末端的目的片段和载体,用T4连接酶将二者连接后热击转化入宿主菌DH5α,同样挑取单克隆培养后,提取质粒DNA进行PCR检测及双酶切检测。两种检测都正确的质粒转入大肠杆菌菌株BL21(DE3)。
1.2.3 重组融合蛋白的表达 将转入正确质粒的BL21涂布平板,经培养后挑取单菌落接种到液体培养基,37 ℃,180 r/min,培养过夜。按1∶100的接种量进行接种,分别吸取1 mL 菌液接种于9瓶100 mL含Amp的液体LB培养基中,37 ℃振荡培养至OD600 nm≈0.6。加入IPTG 至终浓度为0.7 mmol/L,然后分别于8、20、28、37 ℃振荡培养诱导蛋白表达,在诱导6 h时取样10 mL。同时,培养加IPTG诱导的pGEX-6P-1空载体的BL21菌株和不加IPTG诱导的重组载体的BL21菌株作为阴性对照。
选取20 ℃,操作同上,分别加入0、0.3、0.5、0.7、1.0 mmol/L的IPTG进行诱导,均在6 h取样检测;在20 ℃,IPTG终浓度为0.7 mmol/L,不同时间2、4、6、9、20 h取样进行检测。
重组蛋白的SDS-PAGE检测:将诱导表达的菌液转入离心管中,于5 000 r/min 离心10 min,弃上清菌液,收集菌体,加入1.0 mL PBS(pH 7.4)缓冲液,用枪头吹打菌体使菌体重悬,在冰浴中超声波破碎细胞,破碎10 s,间隔10 s,共破碎5 min;收集混合液后4 ℃, 12 000 r/min离心15 min,收集蛋白上清液。沉淀用Buffer B重悬,在冰上放置1 h,期间轻轻摇晃3~4次,12 000 r/min离心10 min,收集蛋白包涵体。在各个取样中加入蛋白质Loading buffer,100 ℃沸水中煮8 min,10%SDS-PAGE检测。恒压100 V电泳,当溴酚蓝指示剂电泳至胶底部边缘时即可停止电泳。
1.2.4 重组蛋白的Western Blot检测 将重组质粒经20 ℃诱导4 h的蛋白上清液与包涵体分别进行Western Blot检测。
1.2.5 纯化蛋白检测 诱导蛋白上清液与谷胱甘肽巯基转移酶(即GST)纯化柱4 ℃孵育过夜。利用谷胱甘肽与GST之间酶和底物的特异性作用力,GST标签的融合蛋白能够与凝胶上的手臂谷胱甘肽结合。25倍体积PBS洗脱杂蛋白,再用还原型谷胱甘肽将带标签的融合蛋白洗脱,流出液即为纯化蛋白。纯化蛋白通过10%SDS-PAGE检测。
2 结果与分析
2.1 原核表达中间载体的构建
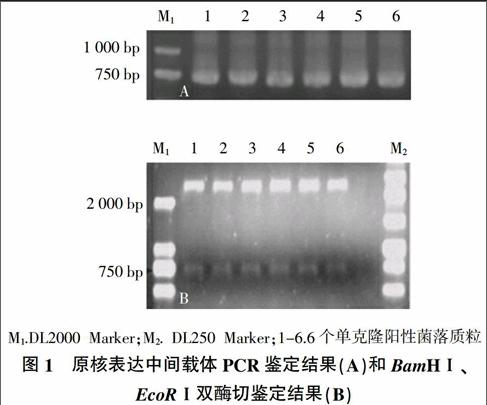
利用PCR扩增得到目的片段,并将目的片段连接PMD-18T载体,经PCR鉴定,产物大小为750 bp;质粒DNA经BamHⅠ和EcoRⅠ双酶切,结果显示原核表达中间载体经过双酶切得到2 700 bp和750 bp两条条带,与预期结果一致(图1)。将构建好的载体进行测序,测序结果验证正确。
2.2 原核表达载体的构建
将构建好的原核表达中间载体用BamHⅠ、EcoRⅠ双酶切切下目的片段,并与pGEX-6P-1连接后,转入大肠杆菌DH5α感受态细胞。然后用BamHⅠ、EcoRⅠ双酶切方法检测是否插入目的片段,结果表明3号和10号单克隆质粒经过双酶切得到5 000 bp和750 bp两条条带,扩增结果与预期结果一致(图2),表明原核表达载体构建成功。测序结果证实序列无误,可以用于后续试验。
2.3 原核表达载体诱导表达条件的优化
经IPTG诱导后,将诱导表达的细菌进行超声波破碎。用10% SDS-PAGE检测表达产物,经过考马斯亮蓝染色,可观察到在40.0~55.0 kD诱导处理后的样品与未经诱导的蛋白间存在明显的差异,其大小与预测的大小相同,表明目的基因在pGEX-6P-1系统中得到了表达。8 ℃,6 h表达的蛋白主要存在于包涵体和上清液中,重组蛋白表达较少。28、37 ℃,6 h表达的蛋白主要以包涵体的形式存在,同时在上清液中几乎没有重组蛋白存在(图3)。
选取20 ℃,分别加入0、0.1、0.3、0.5、0.7和1.0 mmol/L的IPTG诱导6 h取样检测(图4)。没有IPTG的条件下,蛋白有微弱表达,随着IPTG浓度的增加,蛋白表达量增加。0.5 mmol/L IPTG及以上浓度表达蛋白主要以包涵体的形式存在,选择0.3 mmol/L IPTG作为诱导条件。
不同取样时间重组融合蛋白SDS-PAGE检测结果表明,2、4 h上清样和沉淀样中均有表达,沉淀样中的含量比上清样中多。4 h上清样中的可溶性蛋白比2 h多。6、9、20 h蛋白主要存在于沉淀中,以包涵体的形式存在(图5)。
2.4 Western Blot检测目的蛋白
在20 ℃、4 h、0.3 mmol/L IPTG诱导条件下的上清液蛋白和包涵体,以GST的抗体为探针,利用Western Blot进行检测,结果表明(图6),检测得到的蛋白均为融合蛋白,诱导不加IPTG的阴性对照则没有检测出融合蛋白,pGEX-6P-1空载检测出GST标签蛋白,说明可溶性蛋白诱导成功。
2.5 蛋白纯化检测
将含有目的融合蛋白的上清液利用10 mmol/L还原型谷胱甘肽进行洗脱并纯化,通过10% SDS-PAGE电泳检测,结果(图7)显示,融合蛋白成功纯化。
3 小结与讨论
杂交稻具有明显的杂种优势现象,主要表现在生长旺盛、根系发达、穗大粒多、抗逆性强等方面[9]。CMS对于杂交水稻具有重大意义。研究表明,CMS不育主要是由线粒体基因组引起的,而育性恢复要靠细胞核基因组中恢复基因(Rfs)的作用来实现[10]。因此,将其分为不育基因和恢复基因两方面进行研究。纯化出可溶性蛋白为恢复基因和不育基因的体外互作研究提供了可能。
YTA中发现了不育蛋白ORFH79。Peng等[11]将orfH79在细菌和酵母中表达,orfH79对细菌和酵母有抑制作用。胡婧等[12]原核表达水稻HL-CMS中orf216蛋白并制备了抗体。本试验中8 ℃、6 h表达的蛋白主要存在于包涵体和上清液中,重组蛋白表达较少。原因可能是温度比较低,重组蛋白没有变性,同时低温时菌体繁殖没有高温繁殖快,所以出现表达量较少。28 ℃和37 ℃时蛋白主要以包涵体的形式存在,原因可能是温度过高蛋白变性或者是菌体在相对于8 ℃的高温大量繁殖,蛋白大量表达,蛋白正确折叠的效率跟不上表达的效率。IPTG浓度按最优和节约药品原则选取0.3 mmol/L的IPTG进行诱导。本试验纯化得到的蛋白可以制备抗体,并用作后续研究,如RF6蛋白的鉴定,互作蛋白的Pull down试验等。
参考文献:
[1] YOUNG E G, HANSON M R. A fused mitochondrial gene associated with cytoplasmic male sterility is developmentally regulated[J]. Cell,1987,50(1):41-49.
[2] FUJII S, TORIYAMA K. Genome barriers between nuclei and mitochondria exemplified by cytoplasmic male sterility[J]. Plant and Cell Physiology,2008,49(10):1484-1494.
[3] LASER K D, LERSTEN N R. Anatomy and cytology of microsporogenesis in cytoplasmic male sterile angiosperms[J]. The Botanical Review,1972,38(3):425-454.
[4] MACKENZIE S, HE S, LYZNIK A. The elusive plant mitochondrion as a genetic system[J]. Plant Physiology,1994,105(3): 775-780.
[5] SCHNABLE P S, WISE R P. The molecular basis of cytoplasmic male sterility and fertility restoration[J]. Trends in Plant Science,1998,3(5):175-180.
[6] 朱英国,利容千,王明全.水稻雄性不育生物学[M].武汉:武汉大学出版社,2000.
[7] LI S Q, YANG D C, ZHU Y G. Characterization and use of male sterility in hybrid rice breeding[J]. J Integr Plant Biol, 2007, 49: 791-804.
[8] HUANG W, HU J, YU C, et al. Two non-allelic nuclear genes restore fertility in a gametophytic pattern and enhance abiotic stress tolerance in the hybrid rice plant[J]. Theoretical and Applied Genetics,2012,124(5):799-807.
[9] 张朝辉.水稻产量和品质杂种优势研究[J].北京农业,2014(33):8.
[10] SCHNABLE P S, WISE R P. The molecular basis of cytoplasmic male sterility and fertility restoration[J]. Trend Plant Sci, 1998(3):175-180.
[11] PENG X, WANG K, HU C, et al. The mitochondrial gene orfH79 plays a critical role in impairing both male gametophyte development and root growth in CMS-Honglian rice[J]. BMC Plant Biology, 2010, doi:10.1186/1471-2229-10-125
[12] 胡 婧,程 钢,谭艳平,等.水稻HL-CMS中orf216蛋白的原核表达和多克隆抗体制备[J].华中农业大学学报,2010,29(3):257-261.
