盐酸苄丝肼固体分散体制备工艺的研究
2016-01-07马桂芝,马亮英,李文英等
盐酸苄丝肼固体分散体制备工艺的研究
马桂芝1, 马亮英2, 李文英3, 滕亮4
(新疆医科大学1药学院, 乌鲁木齐830011;2第二附属医院药剂科, 乌鲁木齐830000;3第五附属医院药剂科, 乌鲁木齐830011;
4第一附属医院药学部, 乌鲁木齐830054)
摘要:目的优选具有缓释特征的盐酸苄丝肼固体分散体的制备工艺。方法以与左旋多巴微囊溶出行为的相似度为指标,采用均匀试验优选出满足缓释要求的盐酸苄丝肼固体分散体制备工艺,并对其制剂特征进行考察。结果优选出的盐酸苄丝肼固体分散体处方为:主药与辅料的质量比为1∶1,聚乙烯吡咯烷酮(PVP)与乙基纤维素(EC)的质量比为1∶3。结合X-衍射试验结果及释放度行为,采用优选工艺处方制得了盐酸苄丝肼固体分散体。初步稳定性试验表明盐酸苄丝肼固体分散体的理想贮存条件是室温、遮光密封干燥保存。结论优选出的盐酸苄丝肼固体分散体处方合理,制备工艺稳定、科学、可行。制得的固体分散体满足缓释的要求,同时盐酸苄丝肼的释放行为与左旋多巴的释放行为相似。
关键词:盐酸苄丝肼; 固体分散体; 制备工艺
中图分类号:R914文献标识码:A
doi:10.3969/j.issn.1009-5551.2015.07.015
[收稿日期:2015-01-12]
基金项目:新疆医科大学科研创新基金(XJC2012114)
作者简介:沈静(1977-),女,硕士,副教授,硕士生导师,研究方向:药物质量控制研究。
The preparation of solid dispersion of benserazide hydrochloride
MA Guizhi1, MA Liangying2, LI Wenying3, TENG Liang4
(1CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011,China;2Departmentof
Pharmacy,TheSecondAffiliatedHospitalofXinjiangMedicalUniversity,
Urumqi830000,China;3DepartmentofPharmacy,TheFifthAffiliatedHospitalofXinjiang
MedicalUniversity,Urumqi830011,China;4DepartmentofPharmacy,TheFirstAffiliated
HospitalofXinjiangMedicalUniversity,Urumqi83054,China)
Abstract:ObjectiveTo optimize the preparation program of solid dispersion of benserazide hydrochloride. MethodsAccording to the in vitro release behavior of levodopa microcapsules, the data which were analyzed by the statistical method-similar factor method were selected as indexes, the uniform design was used to optimize the process of benserazide solid dispersion. And the character of dosage form was elevated. ResultsThe selected preparation formula is as following: the mass ratio between benserazide and excipients is 1∶1, the mass ratio between polyvinyl pyrrolidone and ethyl cellulose is 1∶3. According to the results of X-ray and dissolution, benserazide solid dispersion is prepared successfully. Benserazide solid dispersion should be stored in shading and seal conditions. ConclusionThe selected preparation formula is reasonable. The condition of preparation is stable, reasonable and feasible. The solid dispersion has slow release behavior and the release behavior is the same as levodopa microcapsules.
Key words: benserazide hydrochloride; solid dispersion; preparation program
帕金森病(Parkinson′s disease,PD)又称为震颤麻痹,是一种中枢神经系统锥体外系功能障碍的慢性进行性疾病[1]。美国神经协会对各种抗帕金森病药物进行评估,结果表明复方左旋多巴制剂(美多芭等)是所有帕金森病药物治疗中最有效的药物[2-3]。但是该片剂使用方法繁琐,给药频率高,中老年患者的用药顺应性差,同时左旋多巴的吸收主要发生在胃和小肠近端 (主要在十二指肠和空肠部位)[4],普通左旋多巴片剂在胃内停留时间短,吸收量有限[5]。因此本课题组结合前期研究结果[6-7],尝试采用复合制剂技术将普通片研发成既可保证药物的疗效又能增加病人用药顺应性的微囊胃漂浮片[8-10],以满足临床用药需求。该微囊胃漂浮片是由左旋多巴的微囊与盐酸苄丝肼的固体分散体作为中间体,与适宜辅料压制而成的片剂。根据课题设计需要,制备的缓释制剂应满足12 h连续释放的要求,课题组前期已经完成了左旋多巴的微囊工艺研究与盐酸苄丝肼稳定性及其影响因素的考察[11]。本研究主要对盐酸苄丝肼固体分散体制备工艺进行了研究,要求制得的固体分散体需满足缓释的要求,同时盐酸苄丝肼的释放行为应与左旋多巴的释放行为相似。
1仪器与试药
1.1仪器S312-60数显恒速搅拌器(上海梅颖浦仪器仪表制造有限公司),LC-20A型高效液相色谱仪(日本岛津),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司),DK-S26电热恒温水浴锅(上海精宏试验设备有限公司),DZF-6090真空干燥箱(上海一恒科学仪器有限公司),BS110S电子天平(北京赛多利斯天平有限公司),ZRS-8G智能溶出试验仪(天津市天大天发科技有限公司),透析袋(Biosharp MW8000~14400,批号LOT201108)。
1.2试药盐酸苄丝肼对照品(Sigma-Aldrich,批号SL09032),盐酸苄丝肼(湖北中和化工有限公司,批号100511),抗坏血酸(上海山浦化工有限公司,批号20100504),无水乙醇(安徽安特生物化学有限公司,批号0808073601),聚维酮(PVP 新疆华世丹药业有限公司提供,批号060614),盐酸(乌鲁木齐天岳化学试剂有限公司,批号070917),氢氧化钠(天津市福晨化学试剂厂,批号20090909),司班-80(天津市福晨化学试剂厂,批号060907),液状石蜡(天津市富宇精细化工有限公司,批号090703),乙酸乙酯(天津市福晨化学试剂厂,批号20100705),邻苯二甲酸二乙酯(天津市福晨化学试剂厂,批号20101110),乙基纤维素(上海赫力思特化工有限公司),十二烷基硫酸钠(上海市四赫维化工有限公司,批号20080415)。
2方法与结果
2.1均匀试验优选盐酸苄丝肼固体分散体制备工艺

2.1.2均匀试验设计将一定量乙基纤维素(EC,粘度为10 mPa/s)、聚乙烯吡咯烷酮(PVP,K30)、盐酸苄丝肼粉和抗坏血酸溶解于由57 mL无水乙醇和3 mL水组成的混合溶液中,升温到80℃,600 r/min搅拌20 min至溶液稠,移入减压干燥箱,55℃减压干燥12 h,干燥后研磨过80目筛,即得盐酸苄丝肼固体分散体。制备全程需遮光处理。根据文献[12-14]和前期预试验结果,发现EC(10 mPa/s)用量、PVP用量以及由盐酸苄丝肼与Vitamin C(质量比为4∶1)组成的主药用量对固体分散体中药物溶出有影响。采用U7(74)均匀设计系统,设主药与辅料的质量比例、PVP与EC(10 mPa/s)的质量比例2个因素,各因素分别设7个水平,因素水平安排见表1,均匀试验安排及结果见表2,各组溶出结果见表3。
试验结果使用均匀设计回归分析及优化系统(UROS)进行处理,得回归方程:Y=71.791 5-1.694 58·X1-30.146 00·X2-39.369 80·X21-4.452 90·X1·X2+11.234 00·X22。方程显著性检验:F=429.38,复相关系数R=0.999 8,方程显著(P<0.05)。优化条件为:主药与辅料的质量比为2∶1,PVP与EC的质量比为5∶1。
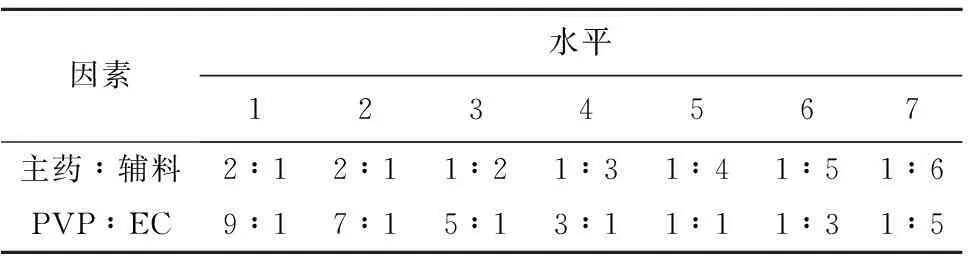
表1 因素水平表

表2 试验安排及结果

表3 溶出试验结果
2.1.3验证试验因为均匀试验预测优化条件的结果超出了f2值的理论范围(f2值的取值范围为0~100),所以根据均匀试验优化条件和均匀试验组中最优处方,各制备3批盐酸苄丝肼固体分散体,按“2.1.1”项下方法测各时间点溶出度,计算f2值,试验结果表明均匀2号处方制得的固体分散体f2平均值为68.33,与左旋多巴微囊溶出行为更为相似,RSD为1.7%,说明工艺合理、稳定、可行。所以将主药与辅料质量比为1∶1、PVP与EC质量比为1∶3定为制备盐酸苄丝肼固体分散体的最终处方,见表4。
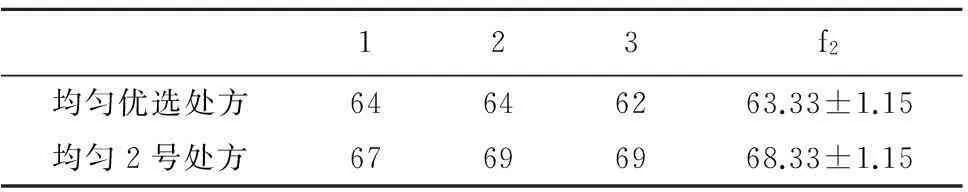
表4 验证试验结果
2.2盐酸苄丝肼固体分散体物相鉴别
2.2.1X-衍射试验优选工艺制备的固体分散体经X-衍射试验,扫描范围:5°~80°,步长:0.02°,步速:0.2 s/步,测试结果表明盐酸苄丝肼具有良好的晶型,在物理混合物中,盐酸苄丝肼的所有衍射峰均出现,且没有出现新的衍射峰,说明盐酸苄丝肼与辅料物理混合后没有发生化学作用,仍然以原晶体形式存在,而在固体分散体中,完全看不到盐酸苄丝肼的衍射峰,说明没有晶体存在,推断盐酸苄丝肼以分子状态分散在辅料中,见图1。
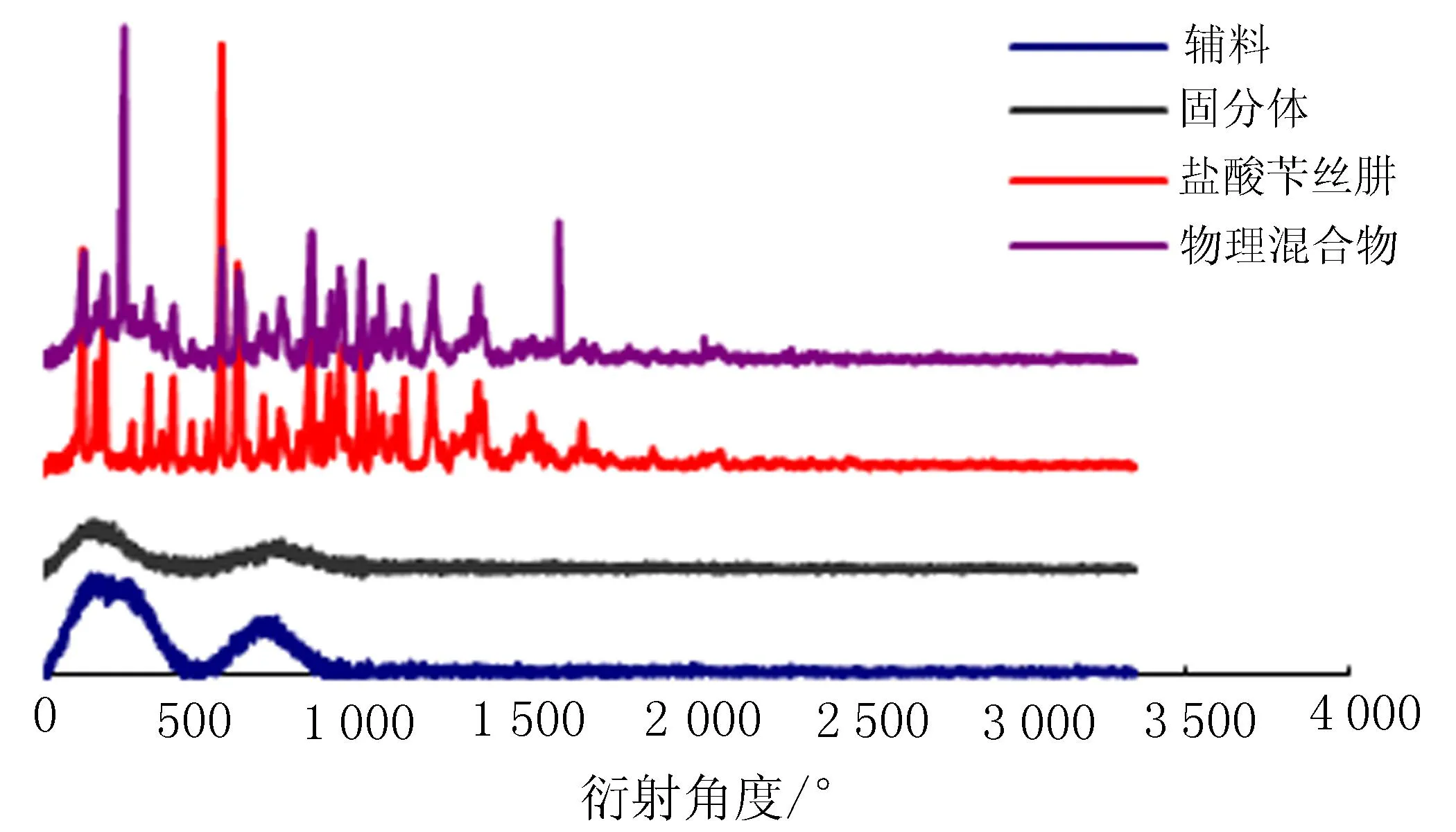
图1 X-衍射图
2.2.2释放度试验参照“2.1.1”项下方法进行盐酸苄丝肼固体分散体释放度试验,结果见图2。对其体外释放规律进行数据拟合,结果见表5。
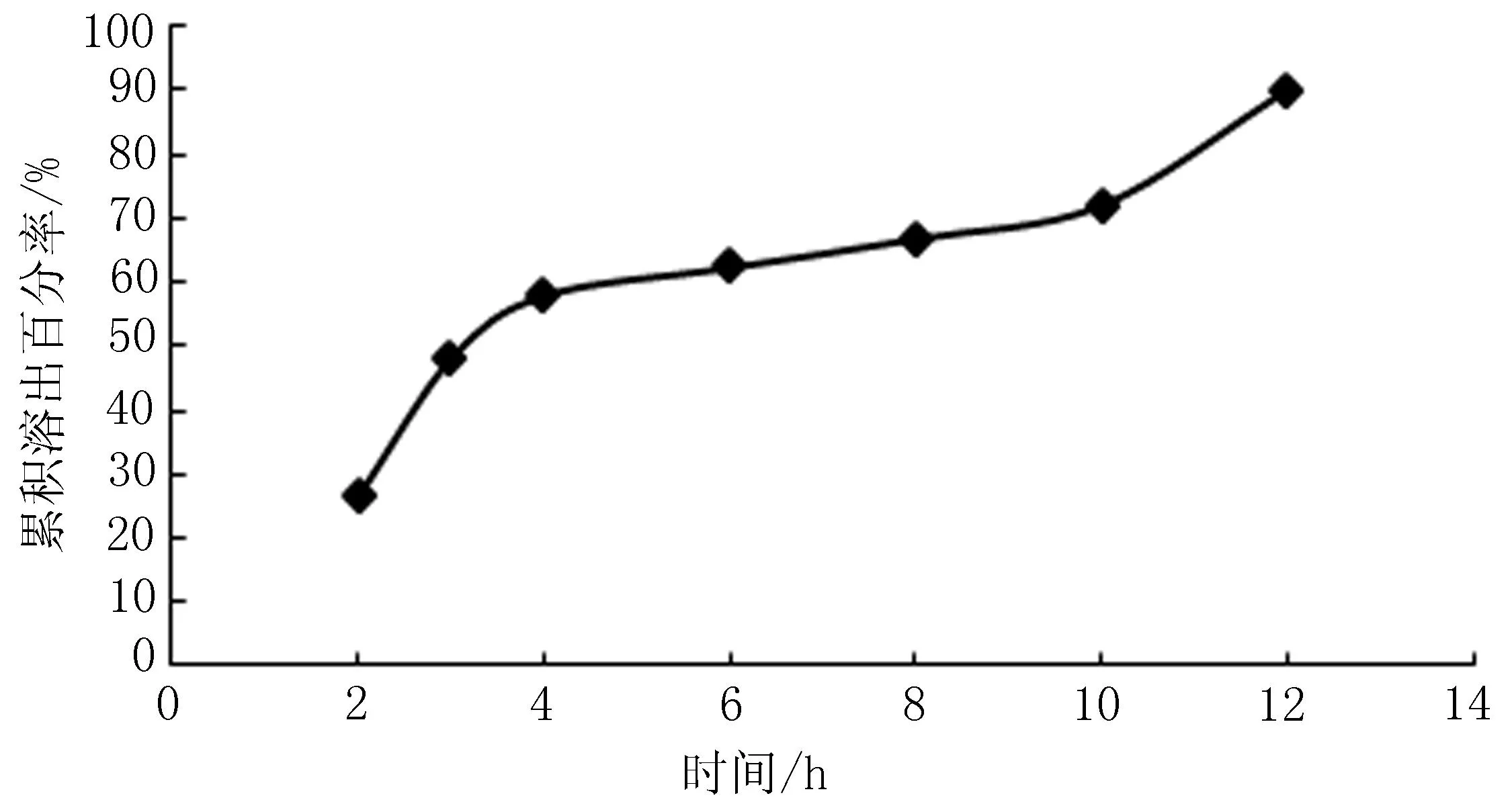
图2 盐酸苄丝肼固体分散体释放曲线

模型拟合方程R单指数函数Y=-0.168X+4.60270.9292威布尔函数Y=0.4461X-0.73410.6482Higuchi方程Y=24.8750X0.9633Ritger-Peppas模型Y=625Xn(n=0.5)0.9654
由表5可以看出,盐酸苄丝肼固体分散体释药符合Ritger-Peppas模型,n=0.5。由于n值在0.46~0.56时,说明药物释放通过Fick扩散机制,也就是Fick扩散和凝胶骨架溶蚀2种机制共协同作用。结果表明盐酸苄丝肼固体分散体在12 h内可实现缓释。结合X-衍射试验结果及释放度行为,可初步认为采用优选工艺处方制得了盐酸苄丝肼固体分散体。
2.3固体分散体贮存条件的研究由于固体分散体存在的老化现象会影响药物的溶出,而不适当的外界条件会加速固体分散体的老化,所以贮存条件对固体分散体的稳定性也很重要。将同批号的固体分散体遮光分别放在不同温湿度环境下,10 d以后测其释放度,计算不同温湿度条件下样品与0 d时溶出行为的相似因子f2值,结果表明盐酸苄丝肼固体分散体在高温高湿的环境下不稳定,湿度较大时,12 h后盐酸苄丝肼的含量降至30%以下,在干燥但温度较高的环境下时,药物在溶出时会出现突释,所以盐酸苄丝肼固体分散体的理想贮存条件是室温、遮光密封干燥保存,见表6。
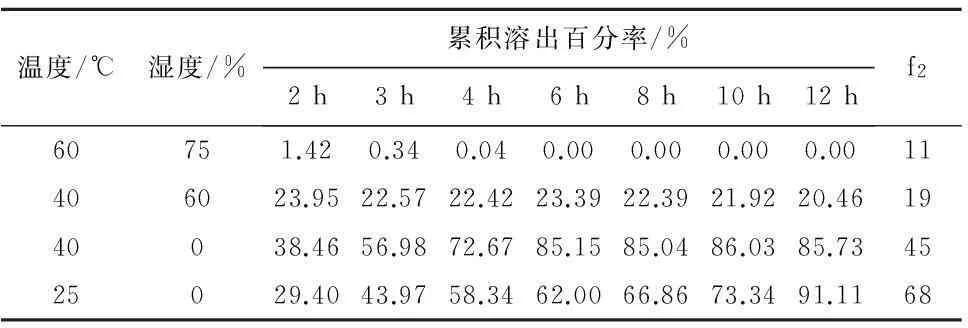
表6 不同温湿度下盐酸苄丝肼溶出变化
3讨论
3.1盐酸苄丝肼稳定性及固体分散体贮存条件的研究固体分散体贮存条件的研究以找到稳定储存条件为目的,根据盐酸苄丝肼原料药稳定性研究的结果,考察不同温湿度下固体分散体的稳定性,最终确定盐酸苄丝肼固体分散体的理想贮存条件是室温、遮光密封干燥保存,与原料药稳定性研究结果一致。
3.2固体分散体制备工艺处方优选指标f2因子方法本课题最终的目的是制备复方左旋多巴苄丝肼的缓释制剂,所以要求左旋多巴与盐酸苄丝肼的溶出行为尽量一致,以保证二者在体内能同步溶出,达到制剂设计要求。因此本研究以优选的左旋多巴微囊溶出曲线做参比制剂计算得到的f2值做为处方优选指标,优选盐酸苄丝肼固体分散体处方及制备工艺。验证试验表明优选出的盐酸苄丝肼固体分散体的溶出行为与优选的左旋多巴微囊溶出行为相似。
相似性因子f2与2条溶出曲线任一时间点平均溶出度的方差成反比,注重具有较大溶出度差值的时间点,由于f2对评价2条溶出曲线中较大差异值的时间点具有更高的灵敏性,有助于确保产品特性的相似性。因此,f2法已被美国FDA和我国SFDA采纳,用于评价制剂条件变更前后溶出或释放特性的相似性。
f2值的范围为0~100,而且f2越大,2条曲线的相似性越高。事实上即使是相同处方的产品,其批次不同,在溶出曲线上也会有一定的差异。如果受试与参比制剂溶出曲线的差异<参比制剂间溶出曲线的差异,那么就可以认为受试与参比制剂溶出曲线具有相似性。通常认为,同一处方不同批次的样品,在任一取样点释放度的平均差异<10%是可以接受的。将10%代入式中计算可得f2约为50,因此,若受试与参比制剂溶出曲线间的相似因子f2值>50,则认为两者溶出行为相似。
参考文献:
[1]Paul HG,Jason MM,Robert CH,et al. Parkinson's disease among American Indians and Alaska natives: a nationwide prevalence study[J]. Mov Disord,2012,27(11):1456-1459.
[2]Navailles S, Lagiere M, Contini A, et al. Multisite intracerebral microdialysis to study the mechanism of L-DOPA induced dopamine and serotonin release in the parkinsonian brain[J]. ACS Chem Neurosci,2013,4(5):680-692.
[3]Lipski J,Nistico R,Berretta N,et al. L-DOPA: a scapegoat for accelerated neurodegeneration in Parkinson's disease[J]. Prog Neurobiol,2011,94(4):389-407.
[4]Di SA,Sozio P,Cerasa LS,et al.L-Dopa prodrugs: an overview of trends for improving Parkinson's disease treatment[J].Curr Pharm Des,2011,17(32):3482-3493.
[5]罗再贵.罗匹尼罗--治疗帕金森病的新型多巴胺激动剂[J].川北医学院学报,2002,17(2):117-119.
[6]马桂芝,滕亮,李文英,等.乳化-溶剂挥发法制备左旋多巴微囊[J].新疆医科大学学报,2014,37(1):47-50.
[7]李文英,马桂芝,滕亮.左旋多巴微囊制备工艺的研究[J].西北药学杂志,2011,26(6):442-445.
[8]赖珺,廖正根,杨明福,等.生物利用度的研究进展[J].中国实验方剂学杂志,2010,16(18):226-229.
[9]陆彬.药物新剂型与新技术[M].北京:人民卫生出版社,1998:222.
[10]贺鑫韬,马桂芝,滕亮.左旋多巴微囊胃内漂浮片犬体内药动学研究[J].西北药学杂志, 2014,29(2):173-177.
[11]马桂芝,李文英,王娟,等.盐酸苄丝肼化学稳定性影响因素的研究[J].中国医药导报,2014,11(35):4-7,11.
[12]金刚,王洁,王涛,等.阿司匹林缓释固体分散体的制备及体外溶出度的研究[J].吉林化工学院学报, 2014, 31(3):35-37.
[13]梁文权. 生物药剂学与药物动力学[M].北京:人民卫生出版社, 2007:38-39.
[14]Bhandari KH, Newa M, Kim JA, et al. Preparation, characterization and evaluation of coenzyme Q10 binary solid dispersions for enhanced solubility and dissolution [J]. Biol Pharm Bull, 2007, 30(6):1171-1176.
(本文编辑施洋)
通信作者:杨淑梅,女,硕士,主任药师,研究方向:临床药学及药品质量安全,E-mail:780869081@qq.com。
