何首乌中蒽醌类物质的超声波提取工艺优化
2016-01-06黄小梅
黄小梅,邓 祥,吴 狄
(1.四川文理学院 化学化工学院,四川 达州 635000; 2.特色植物开发研究四川省高校重点实验室,四川 达州635000)
何首乌中蒽醌类物质的超声波提取工艺优化
黄小梅1,2*,邓祥1,2,吴狄1,2
(1.四川文理学院 化学化工学院,四川 达州 635000;2.特色植物开发研究四川省高校重点实验室,四川 达州635000)
摘要:采用超声波辅助法提取何首乌中蒽醌类物质.讨论了甲醇体积分数、提取时间、提取温度、料液比和提取功率5个因素对提取效率的影响;通过正交试验确定了何首乌中蒽醌类物质的最佳提取工艺条件,甲醇体积分数为80%,提取时间为1.0 h,提取温度为45 ℃,料液比为1∶15 (g∶mL),提取功率为700 W.此条件下蒽醌类物质的最大提取率为1.472 9%.
关键词:何首乌;蒽醌;超声波;正交实验
近年来随着何首乌人工栽培技术的不断进步,何首乌产量日益增多,于是对何首乌药材的质量评价和综合开发利用受到研究工作者的广泛关注.何首乌为蓼科多年生缠绕藤本植物何首乌(polygonum multiflorum thunb)的干燥块根,为传统中药之一,在我国分布较广[1].何首乌中主要含有蒽醌、二苯乙烯苷和黄酮等多种化合物[2-3],具有抗衰老、抗菌、补肝肾、增强免疫力、调血脂、壮筋骨等药理活性[4-7].蒽醌类物质是何首乌中的主要药效成分之一,其主要化学成分包括:大黄酸、大黄素、大黄酚、大黄素甲醚等,具有抗菌消炎、活血化瘀、泻下通便、保肝利胆等功能[8-10].本文作者选取四川达州产何首乌,采用超声提取,并用紫外分光光度法进行检测,快速测定了何首乌中蒽醌类物质的含量.通过单因素试验和正交试验对蒽醌类物质的提取工艺进行了优化,得到最佳提取工艺参数.
1实验部分
1.1 主要实验仪器
XH-2008D型电脑智能温控低温超声波合成萃取仪(宁波新芝生物科技股份有限公司);UV-2550型紫外-可见分光光度计(日本岛津公司);TG20-WS型离心机(长沙湘智离心机仪器有限公司);60目筛子;FW-135型中草药粉碎机(上海隆拓仪器设备有限公司);FA1104N型电子天平(上海菁海仪器有限公司).
1.2 样品和试剂
何首乌(四川达州);大黄素标准试剂(阿拉丁试剂有限公司);甲醇、乙酸镁均为分析纯(成都恒信化学试剂有限公司);实验用水均为超纯水.
1.3 对照储备液的制备
准确称取大黄素标准品0.005 3 g,用适量甲醇溶解并定容至50 mL容量瓶中,摇匀作对照储备液.储备液中大黄素浓度为106 mg/L.
1.4 标准曲线的绘制[11]
分别准确移取大黄素对照储备液0.0、1.0、3.0、5.0、7.0、9.0 mL于25 mL容量瓶1~6号瓶中,加入1%(质量分数,下同)乙酸镁显色剂2.5 mL,摇匀,显色20 min,用甲醇定容至刻度,摇匀.以第一瓶空白为对照,在最大吸收波长506 nm处测定吸光度,以分光光度法测得的吸光度为纵坐标,大黄素浓度为横坐标绘制标准曲线(图1).得到线性回归方程为:y= 0.031 4x+ 0.006 5,r= 0.999 6,其线性关系良好.
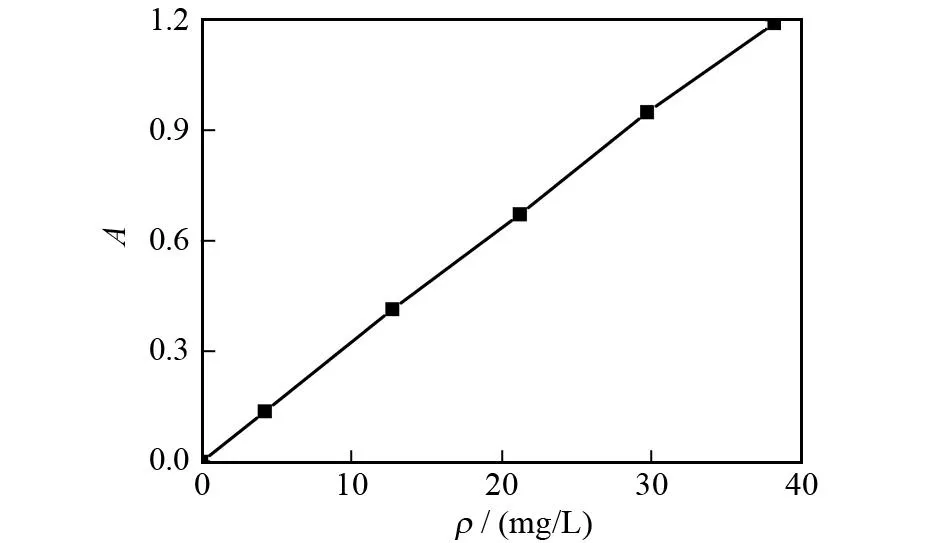
图1 大黄素标准曲线Fig.1 Standard curve of the emodin
1.5 样品中蒽醌的提取及测定[12]
将何首乌置于40 ℃的干燥箱恒温干燥24 h,冷却,用粉碎机粉碎,过60目筛子除去大颗粒.准确称取0.500 0 g何首乌粉末,用甲醇溶液进行超声提取.将提取液离心分离,取上层清液加入25 mL容量瓶中,用1%乙酸镁显色剂显色,用甲醇定容.按1.4操作测定提取液的吸光度,根据线性回归方程得出提取液中蒽醌类物质的质量浓度,再按下式计算得到蒽醌类物质的提取率.
式中:ρ为样品液中蒽醌的质量浓度,mg/L;V为样品液的体积,mL;M为样品的质量,g.
1.6 正交试验
以蒽醌类物质提取率为指标,在固定提取功率的情况下,对料液比(A) 、提取温度(B)、提取时间(C)和甲醇体积分数(D)进行L9(34) 三水平四因素正交试验,其正交试验设计见表1.
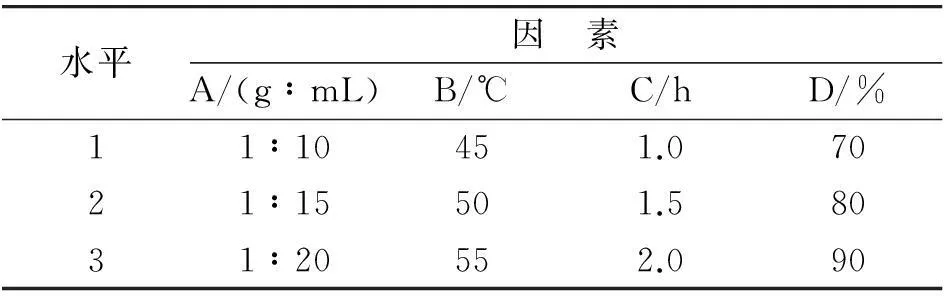
表1 水平与因素表Table 1 Levels and factors chart
2结果与分析
2.1 单因素实验结果与分析
2.1.1甲醇体积分数
在提取功率为800 W,提取温度为45 ℃,提取时间为2.0 h和溶剂用量为10 mL的条件下,讨论甲醇体积分数(20%、40%、60%、80%、100%)对蒽醌类物质提取率的影响,其结果如图2所示.由图2可知,随着甲醇浓度的增加,蒽醌类物质的提取率不断增加,当甲醇体积分数达到80%时,蒽醌类物质提取率达到最大值(0.826%);但当甲醇体积分数超过80%后蒽醌类物质的提取率反而降低.这可能是由于随着甲醇浓度的增加,溶剂极性差异性变大,醇溶性物质相互竞争溶解,限制了某些蒽醌类物质的溶出,使蒽醌类物质得不到充分溶解,提取率反而减少.因此甲醇的最佳体积分数为80%.
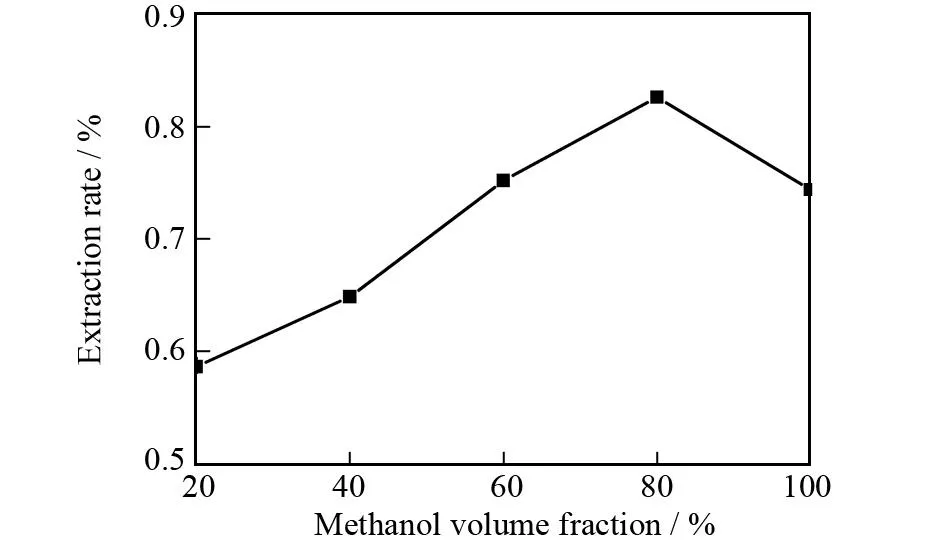
图2 甲醇体积分数对提取率的影响Fig.2 The effect of methanol volume fraction on the extraction rate
2.1.2提取时间
在提取功率为800 W,提取温度为45 ℃,甲醇体积分数为80%和溶剂用量为10 mL的条件下,讨论提取时间(0.5、1.0、1.5、2.0、2.5 h)对蒽醌类物质提取率的影响,测试结果如图3所示.从图3中可以看出,随着提取时间的延长,蒽醌类物质的提取率不断增加,当提取时间达到1.5 h后蒽醌类物质的提取率曲线趋于平稳.提取时间为1.5 h时蒽醌类物质的提取率为0.869%.因此选取1.5 h为最佳提取时间.
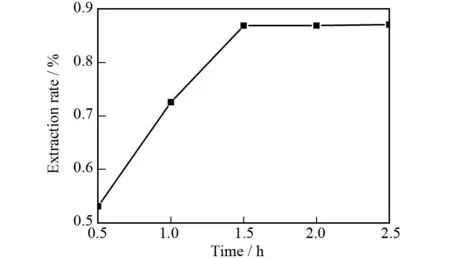
图3 提取时间对提取率的影响Fig.3 The effect of extracting time on extraction rate
2.1.3提取温度
在甲醇体积分数为80%,提取功率为800 W,提取时间为1.5 h和溶剂用量为10 mL的条件下,讨论提取温度(30、40、50、60、70 ℃)对蒽醌类物质提取率的影响,其结果如图4所示.由图4可知,当提取温度低于50 ℃时,随着提取温度的升高蒽醌类物质的提取率不断升高;当提取温度达到50 ℃时蒽醌类物质提取率达到最大值(0.924%);但当提取温度超过50 ℃后蒽醌类物质的提取率反而呈缓慢下降趋势.这是由于蒽醌类物质具有热不稳定性,随着温度的升高,蒽醌类物质容易分解或者部分被氧化而破坏,导致提取率呈缓慢下降趋势,故选取50 ℃为最佳提取温度.
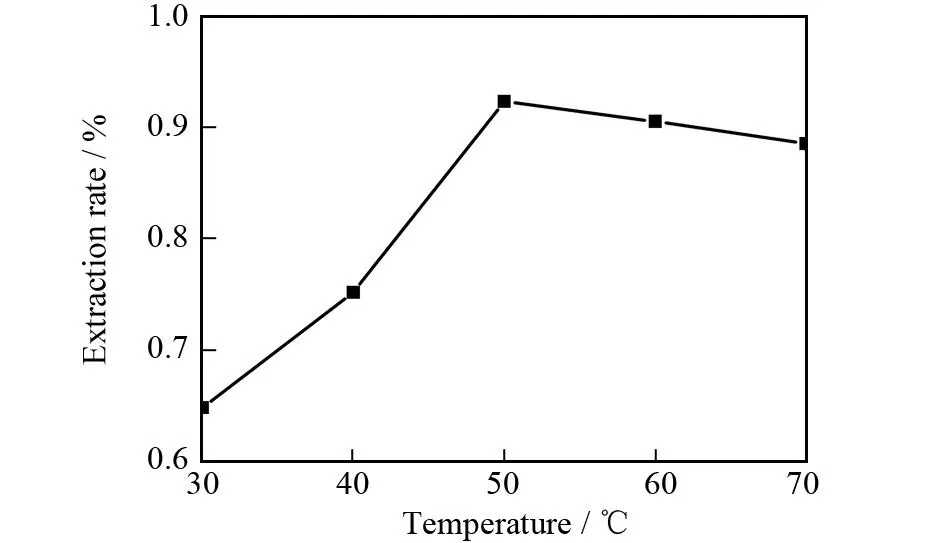
图4 提取温度对提取率的影响Fig.4 The effect of extracting temperature on extraction rate
2.1.4料液比
在提取功率为800 W,提取温度为50 ℃,提取时间为1.5 h和甲醇体积分数为80%的条件下,讨论了料液比(1∶5、1∶10、1∶15、1∶20、1∶25 (g∶mL))对蒽醌类物质提取率的影响,其实验结果如图5所示.由图5可知,随着料液比的增加,蒽醌类物质的提取率不断增加,当料液比达到1∶15时,蒽醌类物质提取率趋于平稳,料液比为1∶15时,蒽醌类物质的提取率为0.905%.故其最佳料液比为1∶15.
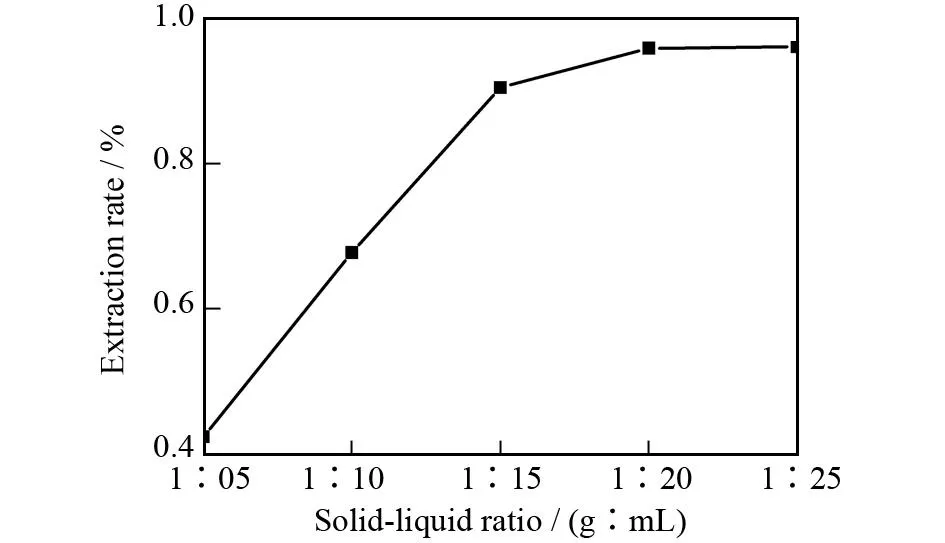
图5 料液比对提取率的影响Fig.5 The effect of solid-liquid ratio on extraction rate
2.1.5提取功率
在甲醇体积分数为80%,提取温度为50 ℃,提取时间为1.5 h和溶剂用量为7.5 mL的条件下,考察了提取功率(500、600、700、800、900 W)对蒽醌类物质提取率的影响,其实验结果如图6所示.从图6中可以看出,随着提取功率的增加蒽醌类物质的提取率不断增加,当提取功率达到700 W时蒽醌类物质的提取率达到最大值0.974%,此后随着提取功率的增加蒽醌类物质的提取率不断降低.这可能是因为提取功率过高,提取物种的杂质含量增加,而这些杂质会吸附包裹部分蒽醌类物质,从而使提取率降低,因此选取最佳提取功率为700 W.
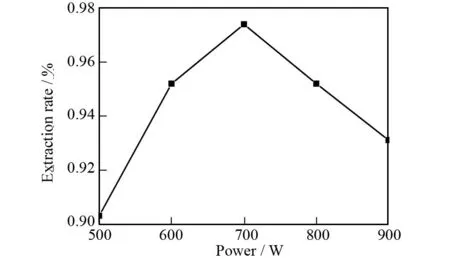
图6 提取功率对提取率的影响Fig.6 The effect of extracting power on extraction rate
2.2 正交实验结果与分析
根据上述单因素实验结果,在固定提取功率的情况下,设计了L9(34) 3水平4因素正交实验,其正交实验结果如表2.从表2的极差分析可以看出,极差R1>R4>R3>R2,得知实验各因素对何首乌中蒽醌类物质的提取率影响主次顺序是A>D>C>B,即料液比影响最大,其次是甲醇体积分数和提取温度,最后是提取时间.通过正交实验的k值得到最佳工艺组合为A2B1C1D2.即料液比为1∶15 (g∶mL),提取温度为45 ℃,提取时间为1.0 h,甲醇体积分数为80%.
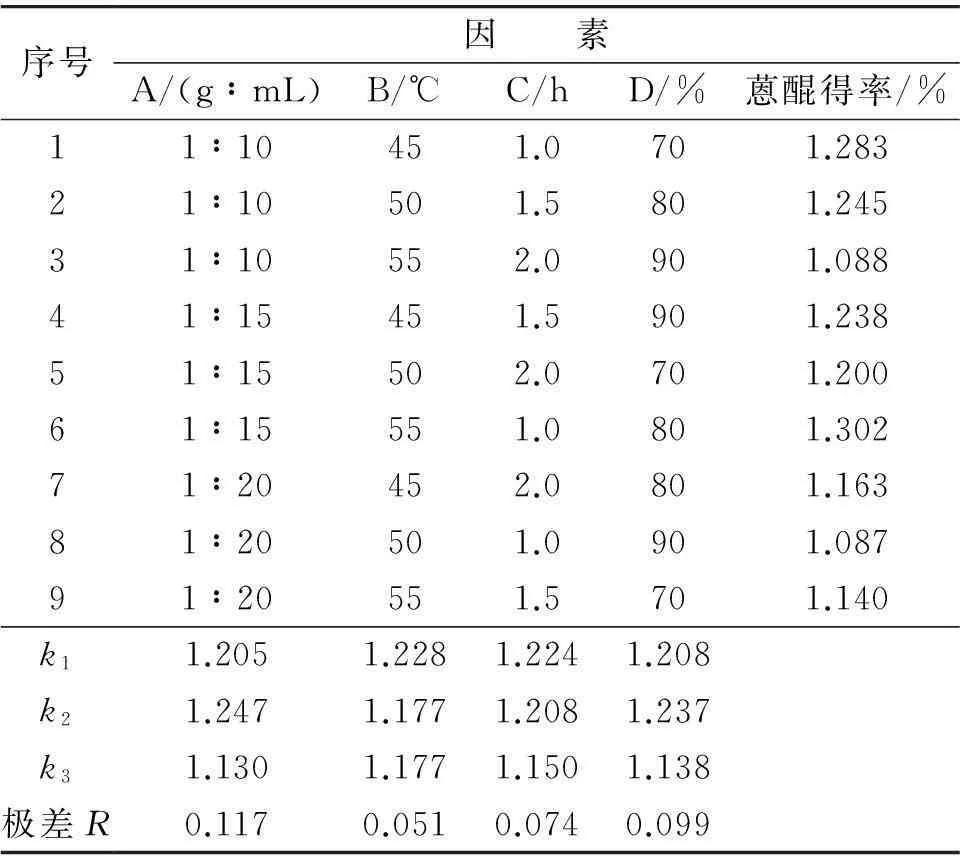
表2 正交实验结果Table 2 Results of orthogonal experiment
2.3 正交验证实验
在正交实验的最佳条件(A2B1C1D2)下进行3次平行实验,考察何首乌中蒽醌类物质的最终得率,实验结果如表3所示.从表3数据可以看出,在最佳实验条件下,通过3组平行实验对正交实验结果进行验证,得到何首乌中蒽醌类物质的平均提取率为1.472 9%.

表3 正交实验结果验证Table 3 The results of orthogonal experimental verification
3结论
采用超声波提取技术提取了何首乌中的蒽醌类物质,并且通过单因素实验和正交实验确定了何首乌中蒽醌类物质的最佳提取工艺条件:甲醇体积分数为80%,料液比为1∶15 (g∶mL),提取温度为45 ℃,提取时间为1.0 h,提取功率为700 W,蒽醌类物质的平均最大提取率为1.472 9%.超声波提取技术是利用声波产生高速、强烈的搅拌作用和空化效应,破坏植物细胞膜结构,便于溶剂渗透到植物细胞中,增加细胞内容物的穿透能力,有助于蒽醌类物质的释放与溶出,因此我们采用了超声波辅助甲醇提取技术.从实验结果可以看出,超声波提取技术大大缩短了提取时间,提高了蒽醌类物质的提取率和原料的利用率,在医药、食品、化妆品等领域将具有广阔的应用前景.
参考文献:
[1] 江苏新医学院.中药大辞典(上册) [M].上海:上海科技出版社,1993:1231.
[2] 杨晓丽,王立为.中药何首乌的药理作用研究进展[J].中医药信息,2004,21(6):12-14.
[3] 廖海民,胡正海.何首乌的生物学及化学成分研究进展[J].中草药,2005,36(2):311-314.
[4] 卫培峰,焦晨莉,陈丹丹.何首乌现代药理研究进展[J].现代中医药,2004,15(1):57-58.
[5] 孙桂波,郭宝江,李续娥,等.何首乌蒽醌苷对小鼠细胞免疫功能的影响[J].中药药理与临床,2006,22(6):30-32.
[6] 李法曾,许崇梅,曲畅游,等.中国蓼族植物系统分类研究综述[J].西北植物学报,2004,24(1):189-192.
[7] 任美萍,钟琳,肖顺汉.中药抗肿瘤机制研究近况[J].四川生理科学杂志,2006,28(4):168-170.
[8] 卫培峰,焦晨莉,陈丹丹.何首乌现代药理研究进展[J].现代中医药,2004,15(1):57-58.
[9] 徐国钧,赵守训.生药学[M].北京:人民卫生出版社,1986:158.
[10] 杨金霞,王学美.中药抗肝癌免疫调节的研究进展[J].中国中药杂志,2007,32(4):281-284.
[11] 邓祥,黄小梅,吴狄.川佛手中总黄酮的超声波提取工艺优化[J].四川文理学院学报,2014,5(24):37-40.
[12] 唐楷,颜杰,黄新.金银花总黄酮的提取工艺优化及其抑菌作用研究[J].中国食品添加剂,2012,4(2):154-157.
[责任编辑:毛立群]
Process optimization of ultrasonic extraction of the total
anthraquinone from polygonum multiflorum
HUANG Xiaomei1,2*,DENG Xiang1,2,WU Di1,2
(1.DepartmentofChemistryandChemicalEngineering,SichuanUniversityofArtsandScience,Dazhou635000,Sichuan,China;
2.KeyLaboratoryoftheResearchonCharacteristicPlantsofUniversitiesinSichuanProvince,Dazhou635000,Sichuan,China)
Abstract:The total anthraquinones were extracted from polygonum multiflorum by ultrasonic method.The effects of five factors on the extraction,including methanol concentration,extracting times,extracting temperature,material/solvent ratio and extracting power were studied by single factor test.The optimal conditions of extraction were determined as follows:methanol volume fraction was 80%,extracting time was 1.0 h,extracting temperature was 45 ℃,material-solvent ratio was 1∶15 (g∶mL) and extracting power was 700 W.Under these operation conditions,the maximum rate of extraction of the total anthraquinones was 1.472 9%.
Keywords:polygonum multiflorum; anthraquinone; ultrasonic; orthogonal experiment
作者简介:黄小梅(1977-),女,副教授,主要研究方向天然产物分析.*通讯联系人,E-mail:dxw8066031@163.com.
基金项目:四川省教育厅重点项目资助(13ZA0101),“特色植物开发研究”四川省高校重点实验室项目资助(sctz201301,sctz201305).
收稿日期:2014-10-27.
中图分类号:TQ914.1
文献标志码:A
文章编号:1008-1011(2015)02-0166-04
