配对盒基因2和CD44基因在子宫内膜癌中的表达及意义
2016-01-05王肃静陆香凤黄炳臣陈慧峰李建湘蒋军松
王肃静陆香凤黄炳臣++陈慧峰李建湘蒋军松
【摘要】目的探讨配对盒基因2(PAX2)和CD44基因在子宫内膜癌组织中的表达及临床意义。
方法采用免疫组化法(SP)检测25例正常子宫内膜组织、51例子宫内膜癌组织中PAX2与CD44的表达情况,并结合临床病理特征进行分析。
结果PAX2在子宫内膜癌阳性表达显著少于正常子宫内膜组织(P<0.01),其表达缺失与子宫内膜腺癌肌层浸润深度、病理组织学分级有关(P<0.05);CD44在子宫内膜癌阳性表达率显著高于正常子宫内膜(P<0.01),CD44在子宫内膜癌中的表达与临床病理特征无显著相关性(P>0.05)。
结论PAX2和CD44蛋白的异常表达与子宫内膜癌的发生相关,有望成为诊断子宫内膜组织早期癌变的有用指标。
【关键词】子宫内膜癌;PAX2;CD44;免疫组化
中图分类号:R737.33文献标识码:ADOI:10.3969/j.issn.10031383.2016.04.006
子宫内膜癌是女性生殖系统恶性肿瘤之一,近年来发病率逐年上升,其发生发展与遗传、区域、环境等诸多因素相关。配对盒基因2(Paired box gene2,PAX2)是PAX基因家族的一员,编码核转录因子,目前研究发现,PAX2基因与人类多种肿瘤的发生、发展及预后密切相关。CD44基因是肿瘤干细胞标志物,具有多种功能的活性黏附分子,促进肿瘤细胞的增殖、分化、转移和凋亡。本研究应用免疫组织化学SP法检测人正常子宫内膜和子宫内膜癌中PAX2和CD44表达情况,并分析其与临床病理特征的相关性。
1资料与方法
1.1一般资料
收集河池市人民医院病理科2014年1月~2015年12月经病理证实的手术切除的子宫内膜癌存档蜡块51例,年龄32~72岁,平均(5051±7.78)岁。根据国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)标准:Ⅰ期36例,Ⅱ期7例,Ⅲ期6例,Ⅳ期2例;病理组织学分级:G1、G2级39例,G3级12例;肌层浸润<1/2者26例,≥1/2者25例;有淋巴结转移8例,无淋巴结转移43例。另选取同期因其他良性疾病手术的正常子宫内膜患者25例作为对照组,年龄26~71岁,平均(49.20±11.92)岁。
1.2病例入选和排除标准
入选标准:经病理科确诊为子宫内膜癌患者。排除标准:术前接受激素治疗或放化疗的子宫内膜癌患者,合并高血压、糖尿病、高血脂及其他器官恶性肿瘤者。
1.3研究方法
1.3.1所用试剂及检测方法
即用型兔抗人PAX2多克隆抗体、即用型鼠抗人CD44单克隆抗体、SP免疫组化试剂盒及DAB显色剂均购自福州迈新试剂生物技术开发公司。采用链霉菌抗生物素蛋白过氧化物酶连结法(SP法)进行染色,所有组织均以4 μm切片进行染色,染色步骤严格按照试剂盒说明进行。用磷酸缓冲液(PBS)代替一抗作阴性对照,用已知阳性切片作阳性对照,PAX2阳性表达定位于细胞核,呈淡黄、棕黄、棕褐色。CD44阳性主要定位于细胞膜。
1.3.2结果评定标准
采用半定量计分方法,根据染色阳性细胞占肿瘤细胞总数百分比和染色强度相加计分。在显微镜高倍视野下,随机选择5个视野,每个视野计数100个肿瘤细胞,共计数500个细胞。根据阳性染色程度计分:无着色为0分,淡黄色1分,棕黄色2分,棕褐色3分;按阳性细胞所占肿瘤细胞百分比评分:无阳性细胞为0分,阳性细胞<25%为1分,阳性细胞26%~50%为2分,阳性细胞51%~75%为3分,阳性细胞>75%为4分。两项评分相加<3为阴性,≥3为阳性。
1.3.3观察项目
对比观察PAX2与CD44在正常子宫内膜组和子宫内膜癌组中的阳性表达率,并分析子宫内膜癌组中PAX2与CD44的表达情况与临床病理及二者的相关性。
1.4统计学方法
数据均采用SPSS 17.0软件进行处理, 计数资料以百分率(%)表示,组间比较采用χ2检验,两者之间相关性分析应用Spearman等级相关分析,检验水准:α=0.05。
2结果
2.1PAX2、CD44在正常子宫内膜组织和子宫内膜癌中的表达
PAX2在正常子宫内膜组织中阳性表达率为80%(20/25),阳性定位于内膜腺上皮细胞核,呈棕黄、棕褐色,同时亦表达于内膜间质细胞和平滑肌细胞的细胞核(图1A);PAX2在子宫内膜组中阳性表达率为43.1%(22/51),癌细胞核呈淡黄、黄色、棕黄、棕褐色表达(图1B);PAX2在子宫内膜癌表达显著少于正常子宫内膜,差异有统计学意义(P<0.01)。CD44在正常子宫内膜组织中无阳性表达(0/25),在子宫内膜癌中阳性表达率为62.7%(32/51),阳性定位于细胞膜(图1C),与正常子宫内膜差异有统计学意义(P<0.01)。见表1。
A:增生期正常子宫内膜,PAX2在子宫内膜腺上皮细胞核强阳性表达,SP法;B:高分化子宫内膜腺癌组织,PAX2在肿瘤性腺上皮细胞弱阳性表达,SP法;C:CD44在高分化子宫内膜癌组织腺体细胞表面阳性表达,SP法。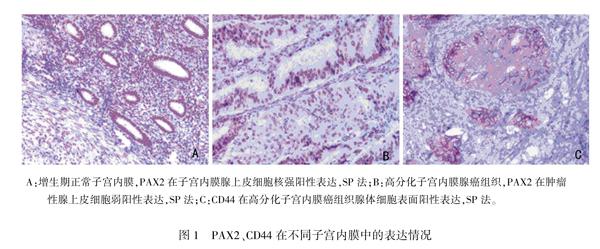
2.2PAX2和CD44的表达与子宫内膜癌临床病理参数的关系
在51例子宫内膜癌组织中PAX2的阳性表达率为43.1%。PAX2的表达与肿瘤的病理组织学分级、肌层浸润深度有关,差异有统计学意义(P<0.05),与淋巴结转移、临床分期、年龄无关(P>0.05);CD44的阳性表达率为62.7%, CD44表达与临床病理参数均无明显相关性(P>0.05)。见表2。
2.3PAX2与CD44在子宫内膜癌中表达的相关性
在CD44阳性表达的子宫内膜癌组织中有13例PAX2阳性表达,而在CD44阴性的癌组织中,有9例PAX2阳性表达,CD44阳性而PAX2阴性的19例,CD44和PAX2均阴性10例。Spearman 等级相关分析,二者表达无相关性(r=0.066,P=0.646)。
3讨论
PAX2基因位于染色体10q24,包含12个外显子,PAX2编码的转录因子含有一个DNA 结合域和一个反式激活域,与其他核蛋白相互作用,PAX2可通过WT1、CJun等信号途径的调控影响细胞增殖、分化,其表达异常参与人类乳腺癌、甲状腺癌、肾癌、膀胱癌、卵巢癌等肿瘤的发生发展[1~2]。Rabban 等[3]通过对宫颈内的腺体和中肾管残留增殖的腺体研究发现,PAX2表达越强,诊断恶性的可能性就越小,提示其表达缺失与子宫颈癌的发生有关。而PAX2在子宫内膜癌中的表达结果不一,袁雪芹等[4]研究发现,PAX2在增殖期、子宫内膜增生症和子宫内膜癌中的表达缺失率逐步增高,刘淑玉等[5]研究结果则相反,认为PAX2在子宫内膜癌中的表达显著高于子宫内膜不典型增生和正常子宫内膜。本研究发现PAX2在子宫内膜癌组织中的表达明显少于其在正常子宫内膜中的表达,与Allison[6]及张彤等人[7]的研究结果一致。进一步观察发现,PAX2在正常子宫内膜功能层、基底层腺上皮细胞核及子宫内膜间质细胞核、平滑肌细胞核均呈阳性表达,推测PAX2在正常的子宫内膜组织阳性表达可能与子宫内膜具有不断的增生修复有关。PAX2在子宫内膜癌中的表达缺失提示其参与子宫内膜癌的发生,其机制可能为子宫内膜是苗勒器官源性组织,PAX2在维持苗勒器官发育成熟过程至关重要,子宫内膜又具有周期性脱落、再生修复的特征,需要PAX2诱导调控,PAX2的表达缺失导致正常子宫内膜生长、分化的调控的异常而导致癌的发生。本研究还发现,PAX2在子宫内膜癌组织中的表达随着浸润肌层深度的加深而表达显著减少,且在低分化癌组中的表达缺失显著高于中高分化腺癌组,提示PAX2表达缺失可能参与子宫内膜癌的发生、分化、侵袭和转移,检测PAX2在子宫内膜癌中的表达,有可能成为子宫内膜癌预后判断的潜在生物学指标。
肿瘤干细胞是肿瘤组织中具有自我更新和多向分化潜能的细胞,与肿瘤自我更新、演进、复发、耐药等密切相关。CD44是一类重要的黏附分子,广泛分布于细胞表面,许多正常细胞表面CD44处于相对静止状态,而许多肿瘤细胞表面CD44处于高度活化状态,是人类多种实体瘤如胃癌、结直肠癌、肺癌、前列腺癌等多种肿瘤干细胞的标志物,能与其主要配体HA结合,介导细胞与细胞、细胞与细胞基质间的相互作用,参与肿瘤细胞生长、分化、迁移等过程[8~9]。研究发现,CD44在头颈部鳞癌、肝母细胞瘤、卵巢癌、乳腺癌等肿瘤的异常表达促进肿瘤的浸润、转移[10~12]。本研究结果显示,CD44在正常子宫内膜不表达,而子宫内膜癌则呈现异常表达,与Wojciechowski等人[13]研究结果相似。提示CD44可能参与子宫内膜癌的发生,由于子宫内膜癌尤其是高分化子宫内膜癌的早期诊断仍然是病理诊断的难点,CD44可能成为临床判断高分化子宫内膜癌的有用分子生物学指标。本研究并未发现CD44在子宫内膜癌中的表达与肿瘤分化、浸润、转移等临床病理特征有显著相关性,是否与本研究样本量较小有关,有待进一步研究。本研究还发现,PAX2和CD44在子宫内膜癌中的表达无显著相关性,提示二者在子宫内膜癌中可能通过不同途径影响子宫内膜癌的发生发展。
综上,联合检测子宫内膜癌中PAX2和CD44的表达,可作为临床早期诊断子宫内膜癌的参考指标,并为临床治疗和预后判断提供依据,其机制有待深入研究。
参考文献
[1]Yang Y,Jeanpierre C,Dressler GR,et al.WT1 and PAX2 podocyte expression in DenysDrash syndrome and isolated diffuse mesangial sclerosis[J].Am J Pathol,1999,154(1):18192.
[2]Zhang HS,Yan B,Li XB,et al.PAX2 protein induces expression of cyclin D1 through activating AP1 protein and promotes proliferation ofcolon cancer cells[J].J Biol Chem,2012,287(53):4416444172.
[3]Rabban JT,McAlhany S,Lerwill MF,et al.PAX2 distinguishes benign mesonephric and mullerian glandular lesions of the cervix from endocervical adenocarcinoma,including minimal deviation adenocarcinoma[J].Am J Surg Pathol,2010,34(2):137146.
[4]袁雪芹,张廷国,荆福祥,等.四硝酸戊赤藓醇5与配对盒基因在子宫内膜癌及子宫内膜上皮内瘤变中的临床表达研究[J].中华医院感染学杂志,2016,26(2):401403.
[5]刘淑玉,李群,梁利梅,等.PAX2在子宫内膜癌中的表达及其与ERα的相关性[J].实用医学杂志,2011,27(2):186188.
[6]Allison KH,Upson K,Reed SD,et al.PAX2 loss by immunohistochemistry occurs early and often in endometrial hyperplasia[J].Int J Gynecol Pathol,2012,31(2):151159.
[7]张彤,沈丹华,陈云新,等.PTEN、PAX2和βcatenin在Ⅰ型子宫内膜癌及其癌前病变中的表达及意义[J].现代妇产科进展,2014,23(2):8588.
[8]Afify A,Purnell P,Nguyen L.Role of CD44s and CD44v6 on human breast cancer cell adhesion,migration,and invasion[J].Exp Mol Pathol,2009,86(2):95100.
[9]Platt VM,Szoka FC Jr.Anticancer therapeutics:targeting macromolecules and nanocarriers to hyaluronan or CD44,a hyaluronan receptor[J].Mol Pharm,2008,5(4):474486.
[10]Leinung M,Ernst B,Dring C,et al.Expression of ALDH1A1 and CD44 in primary head and neck squamous cell carcinoma and their value for carcinogenesis,tumor progression and cancer stem cell identification[J].Oncol Lett, 2015,10(4):22892294.
[11]白晶,李爱军,王丽萍,等.浆液性卵巢癌组织中 CD44和 CD24的表达[J].郑州大学学报:医学版,2013,48(6):729731,732.
[12]王斌,熊健,等.CD44+/CD24细胞在乳腺癌组织中比例与乳腺癌远处转移关系[J].中国肿瘤临床,2015,42(11):555558.
[13]Wojciechowski M,Krawczyk T,migielski J,et al.CD44 expression in curettage and postoperative specimens of endometrial cancer[J].Arch Gynecol Obstet,2015,291(2):383390.
(收稿日期:2016-06-08修回日期:2016-08-31)
(编辑:梁明佩)
王肃静 陆香凤 黄炳臣 陈慧峰 李建湘 蒋军松
【摘要】目的探讨配对盒基因2(PAX2)和CD44基因在子宫内膜癌组织中的表达及临床意义。
方法采用免疫组化法(SP)检测25例正常子宫内膜组织、51例子宫内膜癌组织中PAX2与CD44的表达情况,并结合临床病理特征进行分析。
结果PAX2在子宫内膜癌阳性表达显著少于正常子宫内膜组织(P<0.01),其表达缺失与子宫内膜腺癌肌层浸润深度、病理组织学分级有关(P<0.05);CD44在子宫内膜癌阳性表达率显著高于正常子宫内膜(P<0.01),CD44在子宫内膜癌中的表达与临床病理特征无显著相关性(P>0.05)。
结论PAX2和CD44蛋白的异常表达与子宫内膜癌的发生相关,有望成为诊断子宫内膜组织早期癌变的有用指标。
【关键词】子宫内膜癌;PAX2;CD44;免疫组化
中图分类号:R737.33文献标识码:ADOI:10.3969/j.issn.10031383.2016.04.006
子宫内膜癌是女性生殖系统恶性肿瘤之一,近年来发病率逐年上升,其发生发展与遗传、区域、环境等诸多因素相关。配对盒基因2(Paired box gene2,PAX2)是PAX基因家族的一员,编码核转录因子,目前研究发现,PAX2基因与人类多种肿瘤的发生、发展及预后密切相关。CD44基因是肿瘤干细胞标志物,具有多种功能的活性黏附分子,促进肿瘤细胞的增殖、分化、转移和凋亡。本研究应用免疫组织化学SP法检测人正常子宫内膜和子宫内膜癌中PAX2和CD44表达情况,并分析其与临床病理特征的相关性。
1资料与方法
1.1一般资料
收集河池市人民医院病理科2014年1月~2015年12月经病理证实的手术切除的子宫内膜癌存档蜡块51例,年龄32~72岁,平均(5051±7.78)岁。根据国际妇产科联合会(International Federation of Gynecology and Obstetrics,FIGO)标准:Ⅰ期36例,Ⅱ期7例,Ⅲ期6例,Ⅳ期2例;病理组织学分级:G1、G2级39例,G3级12例;肌层浸润<1/2者26例,≥1/2者25例;有淋巴结转移8例,无淋巴结转移43例。另选取同期因其他良性疾病手术的正常子宫内膜患者25例作为对照组,年龄26~71岁,平均(49.20±11.92)岁。
1.2病例入选和排除标准
入选标准:经病理科确诊为子宫内膜癌患者。排除标准:术前接受激素治疗或放化疗的子宫内膜癌患者,合并高血压、糖尿病、高血脂及其他器官恶性肿瘤者。
1.3研究方法
1.3.1所用试剂及检测方法
即用型兔抗人PAX2多克隆抗体、即用型鼠抗人CD44单克隆抗体、SP免疫组化试剂盒及DAB显色剂均购自福州迈新试剂生物技术开发公司。采用链霉菌抗生物素蛋白过氧化物酶连结法(SP法)进行染色,所有组织均以4 μm切片进行染色,染色步骤严格按照试剂盒说明进行。用磷酸缓冲液(PBS)代替一抗作阴性对照,用已知阳性切片作阳性对照,PAX2阳性表达定位于细胞核,呈淡黄、棕黄、棕褐色。CD44阳性主要定位于细胞膜。
1.3.2结果评定标准
采用半定量计分方法,根据染色阳性细胞占肿瘤细胞总数百分比和染色强度相加计分。在显微镜高倍视野下,随机选择5个视野,每个视野计数100个肿瘤细胞,共计数500个细胞。根据阳性染色程度计分:无着色为0分,淡黄色1分,棕黄色2分,棕褐色3分;按阳性细胞所占肿瘤细胞百分比评分:无阳性细胞为0分,阳性细胞<25%为1分,阳性细胞26%~50%为2分,阳性细胞51%~75%为3分,阳性细胞>75%为4分。两项评分相加<3为阴性,≥3为阳性。
1.3.3观察项目
对比观察PAX2与CD44在正常子宫内膜组和子宫内膜癌组中的阳性表达率,并分析子宫内膜癌组中PAX2与CD44的表达情况与临床病理及二者的相关性。
1.4统计学方法
数据均采用SPSS 17.0软件进行处理, 计数资料以百分率(%)表示,组间比较采用χ2检验,两者之间相关性分析应用Spearman等级相关分析,检验水准:α=0.05。
2结果
2.1PAX2、CD44在正常子宫内膜组织和子宫内膜癌中的表达
PAX2在正常子宫内膜组织中阳性表达率为80%(20/25),阳性定位于内膜腺上皮细胞核,呈棕黄、棕褐色,同时亦表达于内膜间质细胞和平滑肌细胞的细胞核(图1A);PAX2在子宫内膜组中阳性表达率为43.1%(22/51),癌细胞核呈淡黄、黄色、棕黄、棕褐色表达(图1B);PAX2在子宫内膜癌表达显著少于正常子宫内膜,差异有统计学意义(P<0.01)。CD44在正常子宫内膜组织中无阳性表达(0/25),在子宫内膜癌中阳性表达率为62.7%(32/51),阳性定位于细胞膜(图1C),与正常子宫内膜差异有统计学意义(P<0.01)。见表1。
A:增生期正常子宫内膜,PAX2在子宫内膜腺上皮细胞核强阳性表达,SP法;B:高分化子宫内膜腺癌组织,PAX2在肿瘤性腺上皮细胞弱阳性表达,SP法;C:CD44在高分化子宫内膜癌组织腺体细胞表面阳性表达,SP法。
2.2PAX2和CD44的表达与子宫内膜癌临床病理参数的关系
在51例子宫内膜癌组织中PAX2的阳性表达率为43.1%。PAX2的表达与肿瘤的病理组织学分级、肌层浸润深度有关,差异有统计学意义(P<0.05),与淋巴结转移、临床分期、年龄无关(P>0.05);CD44的阳性表达率为62.7%, CD44表达与临床病理参数均无明显相关性(P>0.05)。见表2。
2.3PAX2与CD44在子宫内膜癌中表达的相关性
在CD44阳性表达的子宫内膜癌组织中有13例PAX2阳性表达,而在CD44阴性的癌组织中,有9例PAX2阳性表达,CD44阳性而PAX2阴性的19例,CD44和PAX2均阴性10例。Spearman 等级相关分析,二者表达无相关性(r=0.066,P=0.646)。
3讨论
PAX2基因位于染色体10q24,包含12个外显子,PAX2编码的转录因子含有一个DNA 结合域和一个反式激活域,与其他核蛋白相互作用,PAX2可通过WT1、CJun等信号途径的调控影响细胞增殖、分化,其表达异常参与人类乳腺癌、甲状腺癌、肾癌、膀胱癌、卵巢癌等肿瘤的发生发展[1~2]。Rabban 等[3]通过对宫颈内的腺体和中肾管残留增殖的腺体研究发现,PAX2表达越强,诊断恶性的可能性就越小,提示其表达缺失与子宫颈癌的发生有关。而PAX2在子宫内膜癌中的表达结果不一,袁雪芹等[4]研究发现,PAX2在增殖期、子宫内膜增生症和子宫内膜癌中的表达缺失率逐步增高,刘淑玉等[5]研究结果则相反,认为PAX2在子宫内膜癌中的表达显著高于子宫内膜不典型增生和正常子宫内膜。本研究发现PAX2在子宫内膜癌组织中的表达明显少于其在正常子宫内膜中的表达,与Allison[6]及张彤等人[7]的研究结果一致。进一步观察发现,PAX2在正常子宫内膜功能层、基底层腺上皮细胞核及子宫内膜间质细胞核、平滑肌细胞核均呈阳性表达,推测PAX2在正常的子宫内膜组织阳性表达可能与子宫内膜具有不断的增生修复有关。PAX2在子宫内膜癌中的表达缺失提示其参与子宫内膜癌的发生,其机制可能为子宫内膜是苗勒器官源性组织,PAX2在维持苗勒器官发育成熟过程至关重要,子宫内膜又具有周期性脱落、再生修复的特征,需要PAX2诱导调控,PAX2的表达缺失导致正常子宫内膜生长、分化的调控的异常而导致癌的发生。本研究还发现,PAX2在子宫内膜癌组织中的表达随着浸润肌层深度的加深而表达显著减少,且在低分化癌组中的表达缺失显著高于中高分化腺癌组,提示PAX2表达缺失可能参与子宫内膜癌的发生、分化、侵袭和转移,检测PAX2在子宫内膜癌中的表达,有可能成为子宫内膜癌预后判断的潜在生物学指标。
肿瘤干细胞是肿瘤组织中具有自我更新和多向分化潜能的细胞,与肿瘤自我更新、演进、复发、耐药等密切相关。CD44是一类重要的黏附分子,广泛分布于细胞表面,许多正常细胞表面CD44处于相对静止状态,而许多肿瘤细胞表面CD44处于高度活化状态,是人类多种实体瘤如胃癌、结直肠癌、肺癌、前列腺癌等多种肿瘤干细胞的标志物,能与其主要配体HA结合,介导细胞与细胞、细胞与细胞基质间的相互作用,参与肿瘤细胞生长、分化、迁移等过程[8~9]。研究发现,CD44在头颈部鳞癌、肝母细胞瘤、卵巢癌、乳腺癌等肿瘤的异常表达促进肿瘤的浸润、转移[10~12]。本研究结果显示,CD44在正常子宫内膜不表达,而子宫内膜癌则呈现异常表达,与Wojciechowski等人[13]研究结果相似。提示CD44可能参与子宫内膜癌的发生,由于子宫内膜癌尤其是高分化子宫内膜癌的早期诊断仍然是病理诊断的难点,CD44可能成为临床判断高分化子宫内膜癌的有用分子生物学指标。本研究并未发现CD44在子宫内膜癌中的表达与肿瘤分化、浸润、转移等临床病理特征有显著相关性,是否与本研究样本量较小有关,有待进一步研究。本研究还发现,PAX2和CD44在子宫内膜癌中的表达无显著相关性,提示二者在子宫内膜癌中可能通过不同途径影响子宫内膜癌的发生发展。
综上,联合检测子宫内膜癌中PAX2和CD44的表达,可作为临床早期诊断子宫内膜癌的参考指标,并为临床治疗和预后判断提供依据,其机制有待深入研究。
参考文献
[1]Yang Y,Jeanpierre C,Dressler GR,et al.WT1 and PAX2 podocyte expression in DenysDrash syndrome and isolated diffuse mesangial sclerosis[J].Am J Pathol,1999,154(1):18192.
[2]Zhang HS,Yan B,Li XB,et al.PAX2 protein induces expression of cyclin D1 through activating AP1 protein and promotes proliferation ofcolon cancer cells[J].J Biol Chem,2012,287(53):4416444172.
[3]Rabban JT,McAlhany S,Lerwill MF,et al.PAX2 distinguishes benign mesonephric and mullerian glandular lesions of the cervix from endocervical adenocarcinoma,including minimal deviation adenocarcinoma[J].Am J Surg Pathol,2010,34(2):137146.
[4]袁雪芹,张廷国,荆福祥,等.四硝酸戊赤藓醇5与配对盒基因在子宫内膜癌及子宫内膜上皮内瘤变中的临床表达研究[J].中华医院感染学杂志,2016,26(2):401403.
[5]刘淑玉,李群,梁利梅,等.PAX2在子宫内膜癌中的表达及其与ERα的相关性[J].实用医学杂志,2011,27(2):186188.
[6]Allison KH,Upson K,Reed SD,et al.PAX2 loss by immunohistochemistry occurs early and often in endometrial hyperplasia[J].Int J Gynecol Pathol,2012,31(2):151159.
[7]张彤,沈丹华,陈云新,等.PTEN、PAX2和βcatenin在Ⅰ型子宫内膜癌及其癌前病变中的表达及意义[J].现代妇产科进展,2014,23(2):8588.
[8]Afify A,Purnell P,Nguyen L.Role of CD44s and CD44v6 on human breast cancer cell adhesion,migration,and invasion[J].Exp Mol Pathol,2009,86(2):95100.
[9]Platt VM,Szoka FC Jr.Anticancer therapeutics:targeting macromolecules and nanocarriers to hyaluronan or CD44,a hyaluronan receptor[J].Mol Pharm,2008,5(4):474486.
[10]Leinung M,Ernst B,Dring C,et al.Expression of ALDH1A1 and CD44 in primary head and neck squamous cell carcinoma and their value for carcinogenesis,tumor progression and cancer stem cell identification[J].Oncol Lett, 2015,10(4):22892294.
[11]白晶,李爱军,王丽萍,等.浆液性卵巢癌组织中 CD44和 CD24的表达[J].郑州大学学报:医学版,2013,48(6):729731,732.
[12]王斌,熊健,等.CD44+/CD24细胞在乳腺癌组织中比例与乳腺癌远处转移关系[J].中国肿瘤临床,2015,42(11):555558.
[13]Wojciechowski M,Krawczyk T,migielski J,et al.CD44 expression in curettage and postoperative specimens of endometrial cancer[J].Arch Gynecol Obstet,2015,291(2):383390.
(收稿日期:2016-06-08修回日期:2016-08-31)
(编辑:梁明佩)
