地塞米松通过抑制p38蛋白激酶减轻支气管哮喘引发小鼠急性肺损伤
2015-12-30赵微,尤涛,付金龙
地塞米松通过抑制p38蛋白激酶减轻支气管哮喘引发小鼠急性肺损伤
赵微尤涛1付金龙1
(吉化集团公司总医院体检中心,吉林吉林132021)
摘要〔〕目的探讨支气管哮喘小鼠肺组织p38和p-p38蛋白及白介素(IL)-1β和肿瘤坏死因子(TNF)-α mRNA的表达变化及地塞米松影响的机制。方法将小鼠随机分为对照组、支气管哮喘模型组和地塞米松治疗组。HE染色法观察小鼠肺组织的形态学改变;Western 印迹检测肺组织中p38及p-p38蛋白的表达,RT-PCR方法检测肺组织中TNF-α及IL-1β mRNA的表达。结果与对照组小鼠相比,支气管哮喘组小鼠肺组织发生明显病理学改变,应用地塞米松后病理性改变减轻。与对照组小鼠相比,支气管哮喘时肺组织p-p38/p38的比值明显升高,TNF-α及IL-1β mRNA的表达升高;应用地塞米松后p-p38/p38的比值降低,TNF-α及IL-1β mRNA的表达下降。结论小鼠支气管哮喘时肺组织发生损伤,地塞米松可能通过抑制p38信号传导通路进而抑制TNF-α及IL-1β的表达对抗支气管哮喘引发的肺损伤。
关键词〔〕支气管哮喘;地塞米松;肿瘤坏死因子-α;白细胞介素-1β
中图分类号〔〕R56〔文献标识码〕A〔
1吉化集团公司总医院放疗科
第一作者:赵微(1979-),女,主治医师,主要从事哮喘发病机制的研究。
支气管哮喘是一种常见的慢性炎症性气道疾病,许多炎性细胞和炎性介质参与了其病理生理过程。目前,糖皮质激素是治疗哮喘的第一线药物,但其具体的作用机制尚不是很清楚。本研究拟探讨地塞米松能否通过影响p38丝裂素活化蛋白激酶(MAPK)信号途径降低支气管哮喘引发的肺组织损伤。
1材料与方法
1.1实验试剂及来源地塞米松卵白蛋白(OVA) 和氢氧化铝悬液购溴乙啶(EB)、四甲基乙二胺(TEMED)、N,N-二甲基双丙烯酰胺、十二硫酸钠(SDS)及二硫苏糖醇(DTT)购自美国Sigma公司;过硫酸胺(APS)购自美国Gibico公司;β-actin、p-38及p-p38一抗购自美国Santa Cruz公司,对应的辣根过氧化物酶标记的二抗购自北京鼎国昌盛生物技术有限责任公司。Trizol Reagent(北京鼎国公司);dNTP、M-MLV逆转录酶、oligo(dT)、Taq DNA 合成酶(Promega);DL2000 DNA marker、Prestained marker(大连宝生物)。
1.2实验动物及分组健康6周龄清洁级雌性BALB/C小鼠30只,体重20~25 g,由吉林大学医学动物繁育中心提供。30只小鼠随机分为,对照组(CON)、支气管哮喘模型组(BA)、地塞米松组(Dex)每组10只。
1.3支气管哮喘小鼠模型的制备对照组小鼠正常饮水饮食,支气管哮喘模型组小鼠腹腔注射混合液200 μl/只,OVA 100 μg/只,氢氧化铝凝胶2.25 mg/只,1、7、14 d致敏。从第21天开始,连续7 d雾化吸入5% OVA 20~30 min。观察小鼠,若有烦躁不安、呼吸急促、腹肌抽搐、两便失禁等为阳性反应,判定为支气管哮喘模型复制成功。对照组用生理盐水代替OVA致敏和激发,地塞米松组小鼠哮喘制作(致敏和激发)同哮喘组,但在每次雾化激发前1 h给予腹腔注射地塞米松磷酸钠注射液(2 mg/kg)。
1.4肺组织病理学检测模型制作成功后,各组小鼠乙醚麻醉后处死。摘取一侧肺置入液氮中保存备用,左肺固定于4%多聚甲醛,48 h后常规脱水,石蜡包埋,切片(厚度2~3 μm)。苏木精-伊红(HE)染色,显微镜下观察肺组织损伤情况。
1.5Western印迹法检测肺组织中p38 MAPK及p-p38 MAPK蛋白的表达用RIPA法提取肺组织总蛋白,Bio-Rad法测定蛋白含量,以β-actin 的水平作为内参,取60 μg 蛋白质样品进行SDS-聚丙烯酰胺凝胶(PAGE)电泳,蛋白转至硝酸纤维素膜(PVDF)上;室温封闭1.5 h后,用含0.01 % Tween 20的磷酸盐(PBS)缓冲液(PBST)漂洗3次,每次10 min;加入相应的p38 MAPK及p-p38 MAPK一抗(1∶200稀释),4 ℃孵育过夜,PBST漂洗3次,每次10 min后加入相应的辣根过氧化物酶标记的二抗(1∶1 000稀释),37 ℃摇床温育1.5~2 h,PBST漂洗3次,每次10 min,经二氨基联苯胺(DAB)显色,凝胶图像分析系统分析蛋白的表达。
1.6RT-PCR法检测肺组织中肿瘤坏死因子(TNF)-α及白细胞介素(IL)-1β mRNA的表达参照Trizol试剂盒的方法提取肺组织总RNA。采用逆转录酶和Oligo dT18引物将总RNA反转录为cDNA,进行PCR反应。TNF-α上游引物:5′-AGCCCCCAGTCTGTATCCTT-3′,下游引物:5′-CTCCCTTTGCAGAACTCAGG-3′,待扩增产物长度为213 bp,退火温度为55℃;IL-1β上游引物:5′-GCTTCAGGCAGGCAGTAT-3′,下游引物:5′-CTCCCTTTGCAGAACTCAGG-3′,待扩增产物长度为475 bp,退火温度为54℃;甘油醛-3-磷酸脱氢酶(GAPDH)作为内对照,上游引物:5′-GGGTGATGCTGGTGCTGAGTATGT-3′,下游引物:5′-AAGAATGGGAGTTGCTGTTGAAG TC-3′,待扩增片段617 bp,退火温度58℃。引物由上海生工生物工程技术服务有限公司合成。PCR反应条件为94℃变性45 s,退火45 s(扩增产物不同,退火温度不同),72℃延伸45s,25~30个循环。取PCR产物进行琼脂糖凝胶电泳,采用上海天能科技有限公司GIS凝胶成像系统照相,特异性条带的丰度值用GIS图像分析系统处理。电泳条带密度值以灰度×面积/参照物的比值表示。
1.7统计学方法应用SPSS软件进行,组间比较采用one way ANOVA。
2结果
2.1支气管小鼠肺组织病理学检测对照组小鼠细小支气管及肺泡结构正常,支气管纤毛排列整齐,支气管黏膜上皮完整,未见炎症细胞浸润。哮喘模型鼠可见细支气管上皮变性,支气管管壁增厚、管腔狭窄,支气管腔内大量黏液,气管壁黏膜及黏膜下可见的大量炎症细胞浸润(淋巴细胞、嗜酸细胞及中性粒细胞)。地塞米松组气道炎症较哮喘鼠减轻,气管壁黏膜有轻度炎症细胞浸润。见图1。
2.2支气管哮喘小鼠肺组织中p38及p-p38蛋白的表达不同组别p38蛋白表达基本一致,而与对照组小鼠相比较,支气管哮喘组小鼠肺组织中p-p38蛋白表达明显升高,应用地塞米松后能明显降低小鼠肺组织中p-p38蛋白的表达。见图2。
2.3支气管哮喘小鼠肺组织中TNF-α及IL-1β mRNA的表达与对照组小鼠比较,支气管哮喘模型组小鼠肺组织中TNF-α及IL-1β mRNA的表达升高,应用地塞米松后能明显降低小鼠肺组织中TNF-α及IL-1β mRNA的表达。见图3。
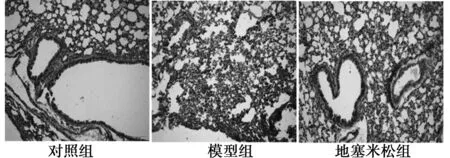
图1 各组肺组织病理学改变
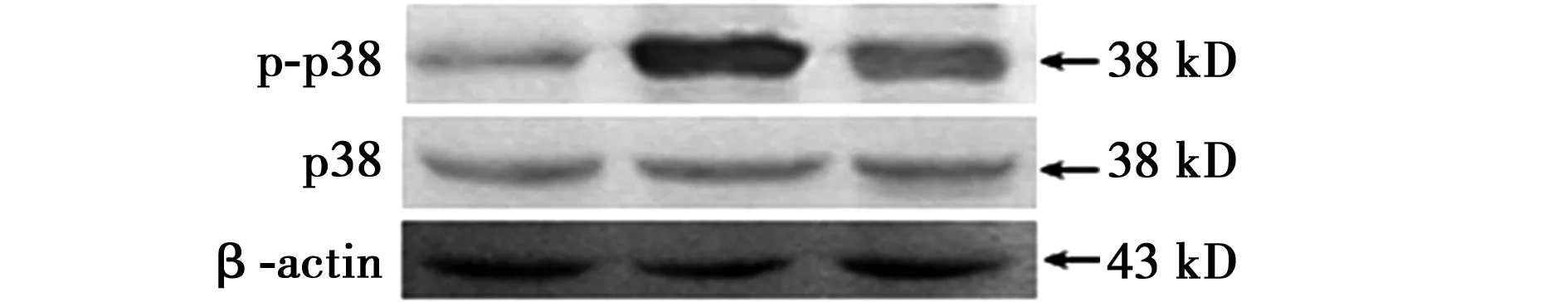
图2 各组小鼠肺组织中p38和p-p38蛋白表达

图3 各组小鼠肺组织中TNF-α和IL-1β mRNA表达
3讨论
支气管哮喘的典型特征是气道高反应性、慢性气道炎症、可逆性气流受限和气道重塑。临床和动物实验研究均发现哮喘发作期气道和肺部有大量的嗜酸性粒细胞、CD4+Th2淋巴细胞浸润,嗜酸性粒细胞、Th2淋巴细胞等炎性细胞引发的气道炎症是导致支气管哮喘临床症状和病理特征的基础〔1,2〕。
新近研究表明p38 MAPK是细胞内重要的信号传递者,参与了对多种炎症细胞因子和多种类型的细胞应激信号的传导,在哮喘的发生和发展过程中有着重要作用〔3,4〕。TNF-α、IL-1β主要由过敏毒素及内毒素诱导由单核细胞及上皮细胞产生,增强血管黏附分子(ICAM)-1的表达,促使中性粒细胞黏附于血管内皮,脱颗粒导致破坏性氧化剂和蛋白酶释放,促进炎症反应的发生发展〔5〕。p38 MAPK被激活后,可进入细胞核或其他部位,主要参与应激条件下细胞的免疫调节、炎症反应及细胞凋亡过程。p38 MAPK在信号转导过程中在细胞核内通过磷酸化作用激活许多转录因子,调节细胞因子,如TNF-α、IL-1、IL-6,IL-8等基因表达〔6,7〕。P38途径对许多炎症介质在基因表达过程中起调控作用;反过来,炎症介质能激活p38 MAPK进而作用于p38 MAPK下游底物,从而在肺内形成一个逐级放大的炎症反应过程。在体外循环肺组织的炎症中,p38 MAPK级联导致许多炎症介质的产生〔8〕。
MAPK超家族的成员如c-Jun NH1-末端激酶(JNK)、细胞外信号调控激酶(ERK)、p38 MAPK都能受缺血再灌注损伤以及炎症反应等刺激所激活,并和相应的转录因子的激活相关,其中p38 MAPK主要对炎症细胞因子和多种类型的细胞应激信号进行转导。p38 MAPK在体内广泛分布,被激活后,可进入细胞核或其他部位,主要参与应激条件下细胞的免疫调节、炎症反应及细胞凋亡过程〔7〕。
本次研究显示,小鼠支气管哮喘时肺组织发生损伤,地塞米松可能通过抑制p38信号传导通路进而抑制炎性细胞因子TNF-α及IL-1β的表达对抗支气管哮喘引发的肺损伤。
4参考文献
1Heijink IH,Van Oosterhout AJ.Targeting T cells for asthma 〔J〕.Curr Opin Pharmacol,2005;5(3):227-231.
2Holgate ST.Pathogenesis of asthma 〔J〕.Clin Exp Allergy,2008;38(6):872-97.
3Lee JC,Kumar S,Grisword DE,etal.Inhibition of p38 MAP kinase as a therapeutic strategy〔J〕.Immunopharmacology,2000;47(2-3):185-201.
4黄翠萍,张珍祥,徐永健.p38裂原活化蛋白激酶信号传递通路和支气管哮喘气道炎症 〔J〕.国外医学·呼吸系统分册,2005;(9):656-8.
5Khan TA,Bianchi C,Arauio EG,etal.Activation of pulmonary mitogen-activated protein kinases during cardiopulmonary bypass 〔J〕.J Surg Res,2003;115(1):56-62.
6Yan W,Zhao K,Jiang Y,etal.Role of P38 MAPK in ICAM-1 expression of vascular endothelial cells induced by lipopolysaccharide 〔J〕.Shock,2002;17(5):433-8.
7Parhar K,Ray A,Steinbrecher U,etal.The P38 mitogen-activated protein kinase regulates interleukin-1 beta-induced IL-8 expression via an effect on the IL-8 promoter in intestinal epithelial cells 〔J〕.Immunology,2003;108(4):502-12.
8Madrid LV,Mayo MW,Reuther JY,etal.Akt stimulates the transactivation potential of the ReIA/P65 subunit of NF-kappa B thourough utilization of the Ikappa B kinase and activation of the mitogen-activated protein kinase p38 〔J〕.J Biol Chem,2001;276(22):18934-40.
〔2014-09-18修回〕
(编辑袁左鸣)
