20(S)人参皂苷Rg3对糖尿病大鼠肾小管上皮细胞TGF-β1表达及凋亡的影响
2015-12-30周彤,张丽红,辛颖等
20(S)人参皂苷Rg3对糖尿病大鼠肾小管上皮细胞TGF-β1表达及凋亡的影响
周彤张丽红1辛颖1王桂侠
(吉林大学第一医院,吉林长春130021)
摘要〔〕目的观察20(S)人参皂苷Rg3对糖尿病大鼠肾小管上皮细胞转化生长因子(TGF)-β1表达及凋亡的影响。方法利用高糖高脂喂养联合腹腔注射链脲佐菌素(STZ)建立糖尿病大鼠模型。实验分为正常对照组、糖尿病组和Rg3治疗组。Rg3治疗组以20 mg/kg体重每日灌胃给予人参皂苷Rg3。监测大鼠体重和血糖,于12 w结束实验时处死大鼠,留取肾脏。用过碘酸雪夫(PAS)染色检测各实验组大鼠肾脏组织,观察其形态学改变;免疫组化法检测各实验组大鼠肾脏组织中TGF-β1的表达;TUNEL染色观察各实验组大鼠肾脏组织凋亡的情况。结果通过PAS染色可以观察到糖尿病组大鼠肾脏组织中肾小球毛细血管袢开放尚可,部分肾小球体积增大、囊腔裂隙变窄,肾小球系膜基质和系膜细胞弥漫性增生。Rg3治疗组大鼠肾脏组织中肾小球形态接近正常。各实验组大鼠肾脏组织中,TGF-β1均主要表达于肾小管上皮细胞,其中糖尿病组TGF-β1的表达增高,与对照组比较差异有统计学意义(P<0.05);Rg3治疗组TGF-β1的表达较糖尿病组明显降低(P<0.05),与正常对照组比较差异无统计学意义(P>0.05)。TUNEL染色见糖尿病组肾小管上皮细胞大量凋亡,显著高于对照组与Rg3治疗组;Rg3治疗组与正常对照组之间凋亡阳性率差异有统计学意义(P<0.05)。相关性分析结果显示,肾小管上皮细胞TGF-β1的表达与细胞凋亡率呈正相关。结论20(S)人参皂苷Rg3显著抑制了糖尿病大鼠肾小管上皮细胞的凋亡,这与其下调肾小管上皮细胞TGF-β1的表达相关,该研究证实了20(S)人参皂苷Rg3对糖尿病大鼠肾脏的保护作用。
关键词〔〕20(S)人参皂苷Rg3;糖尿病;转化生长因子-β1;凋亡
中图分类号〔〕R587〔文献标识码〕A〔
基金项目:吉林省科技厅项目(20130101153JC)
通讯作者:王桂侠(1963-),女,教授,博士生导师,主任医师,主要从事糖尿病及各种内分泌代谢综合征研究。
1吉林大学病理生物学教育部重点实验室
第一作者:周彤(1990-),女,在读硕士,主要从事内分泌代谢疾病研究。
转化生长因子(TGF)-β1是诱导肾小管间质纤维化的重要细胞因子之一〔1,2〕。肾小管间质纤维化是各种不同〔3〕病因所致慢性肾脏疾病进展至终末期肾衰竭的共同病理途径。细胞凋亡参与了许多肾脏疾病的发生和修复过程。在肾脏发病过程中,肾小管上皮细胞凋亡可导致肾小管的萎缩及间质纤维化。研究表明阻止肾小管上皮细胞凋亡能够有效地延缓肾脏纤维化的进程并减轻肾脏功能的损害〔4〕,而TGF-β1可诱导肾小管上皮细胞、足细胞凋亡〔5,6〕。20(S)人参皂苷Rg3(简称Rg3)具有抗肿瘤、抗氧化损伤及提高免疫力等作用〔7〕。最近研究显示Rg3能够降低糖尿病大鼠血糖和血肌酐,抑制肾脏炎症反应〔8〕;减少糖尿病心肌TGF-β1的表达及心肌纤维化〔9〕。但其对糖尿病肾脏的保护作用是否与其抗凋亡作用及调节TGF-β1表达相关尚不清楚。本实验通过观察Rg3对糖尿病大鼠肾脏TGF-β1的表达以及对肾小管上皮细胞凋亡的影响,探讨Rg3对糖尿病大鼠肾脏的保护作用。
1材料和方法
1.1实验动物及试剂30只4周龄雄性Wistar大鼠(190±20)g购于吉林大学基础医学院动物实验中心,动物生产许可证:SCXK-(吉)2013-0001。20(S)人参皂甙-Rg3单体购买于吉林大学药学院(纯度为99%)。链脲佐菌素(STZ)购于Sigma公司。TGF-β1(bs-0103R)购于北京博奥森公司。SP超敏试剂盒(KIT-9710)、内源性生物素阻断试剂盒(BLK-0001)和 DAB显色剂(DAB-0031)均购于福州迈新公司。TUNEL试剂盒(11684817910)购于罗氏公司。
1.2大鼠糖尿病模型的建立30只4周龄雄性Wistar大鼠分笼饲养,温度(22±2)℃,相对湿度55%±2%,大鼠自由饮水、进食。适应环境1 w后,10只用作正常对照(正常给水,正常饮食),其余20只以高脂高糖饲料(基础料66.6%、蔗糖20%、猪油10%、胆固醇0.4%、蛋黄粉3%)喂养4 w,按照35 mg/kg体重腹腔注射STZ(0.1 mol/L柠檬酸缓冲液,pH4.4)1次,继续高脂高糖饲料喂养1 w后,连续3 d尾部采血测定大鼠空腹血糖,若持续高于16.7 mmol/L视为造模成功。经鉴定符合糖尿病标准的大鼠共计18只,用于以下实验。
1.3Rg3对糖尿病大鼠的干预实验共分为3组:(1)正常对照组,10只正常成年大鼠,每天给予0.9%生理盐水1 ml灌胃;(2)糖尿病组,9只上述成模糖尿病大鼠,每天给予0.9%生理盐水1 ml灌胃;(3)Rg3治疗组,9只上述成模糖尿病大鼠,每天给予Rg3灌胃干预,剂量为20 mg/kg。所有大鼠在喂养12 w后,禁食12 h,用3%戊巴比妥钠2 ml腹腔注射麻醉固定,摘取肾脏,固定于10%中性缓冲甲醛中,以备组织学检查。
1.4肾脏组织PAS染色、免疫组织化学染色及凋亡检测取各组已固定的肾脏组织,经常规脱水、透明、石蜡包埋后,连续切片,厚度为2 μm。按照常规方法行PAS染色:石蜡切片脱蜡至水洗,1%过碘酸溶液室温染色5 min,蒸馏水洗后Schiff氏液染色20 min,流水充分冲洗,苏木精复染核,常规脱水及封片。显微镜下观察肾脏的形态学改变,采用免疫组织化学SP法进行TGF-β1表达的检测。染色方法:切片常规脱蜡至水洗,用柠檬酸盐(pH6.0)进行热修复,之后滴加内源性生物素阻断试剂盒中的A、B各20份按SP试剂盒说明书进行。一抗的工作浓度为1∶300,用PBS代替一抗作为阴性对照。TGF-β1免疫组织化学染色以细胞质出现棕黄色颗粒为阳性表达。每张切片随机取5个高倍视野,用IPP6.0软件测定其积分光密度(IOD)值,进行统计学分析。利用原位末端标记法(TUNEL试剂盒)进行凋亡检测,实验步骤严格按说明书进行,用稀释液代替反应液作为阴性对照。TUNEL染色以细胞核呈棕褐色为阳性表达。同样每张切片随机取5个高倍视野,用IPP6.0软件分析凋亡率(即阳性细胞数占总细胞数的百分率)。
1.5统计学分析应用SPSS17.0软件进行方差分析。
2结果
2.1糖尿病模型的建立及实验动物存活情况20只大鼠用高脂高糖饲料喂养4 w,按照35 mg/kg体重单次腹腔注射链脲佐菌素1 w后,符合糖尿病标准的大鼠共计18只,成模型率为90%。该18只糖尿病大鼠中,9只糖尿病组大鼠,在实验的12 w内陆续死亡2只,结束实验时存活7只;9只Rg3治疗组大鼠,在实验12 w内无死亡;10只正常对照组大鼠均健康存活。
2.2肾脏组织PAS染色结果对照组肾脏组织中见肾小球毛细血管袢开放好,无系膜增生和基底膜增厚等异常,糖尿病组见肾小球毛细血管袢开放尚可,部分肾小球体积增大、囊腔裂隙变窄,肾小球系膜基质和系膜细胞弥漫性增生,基底膜未见明显增厚。Rg3治疗组肾小球毛细血管袢开放较好,肾小球体积无明显增大,肾小囊腔无明显狭窄,肾小球系膜基质和系膜细胞轻度节段性增生,基底膜无显著增厚。各组肾脏的肾小管、肾间质和小血管均未见明显异常。见图1。
2.3肾脏组织中TGF-β1的表达如图2所示,各组肾脏组织中均见TGF-β1阳性表达,主要表达于肾小管上皮细胞。糖尿病组TGF-β1表达(8 740.19±4 711.74)明显高于正常对照组(2 740.78±1 305.67);Rg3治疗组(4 315.59±1 227.24)显著低于糖尿病组,高于正常对照组。
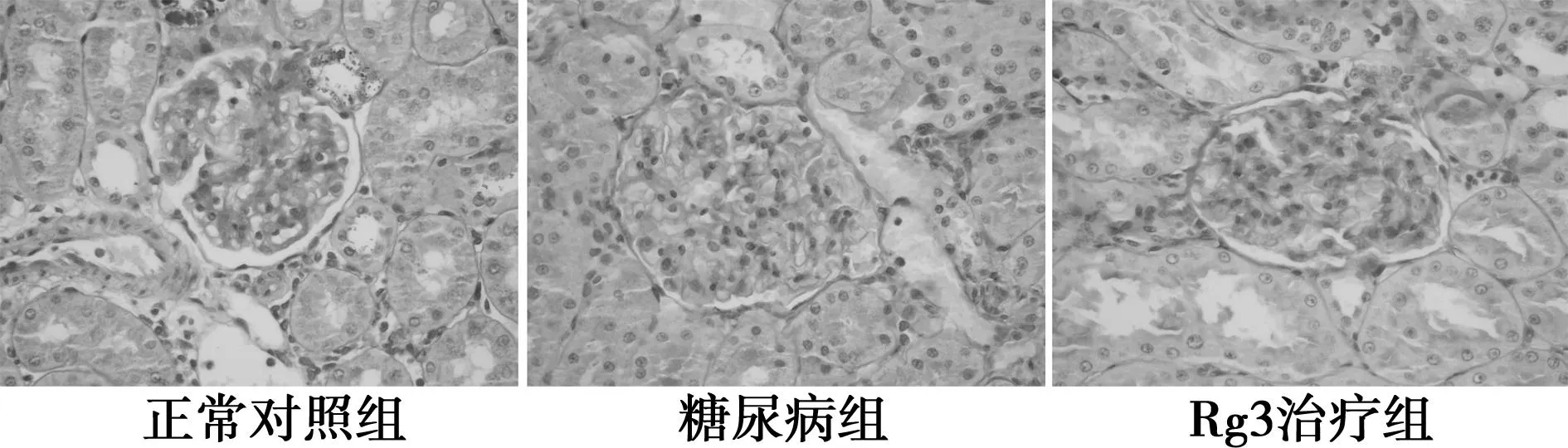
图1 肾脏组织PAS染色(×400)
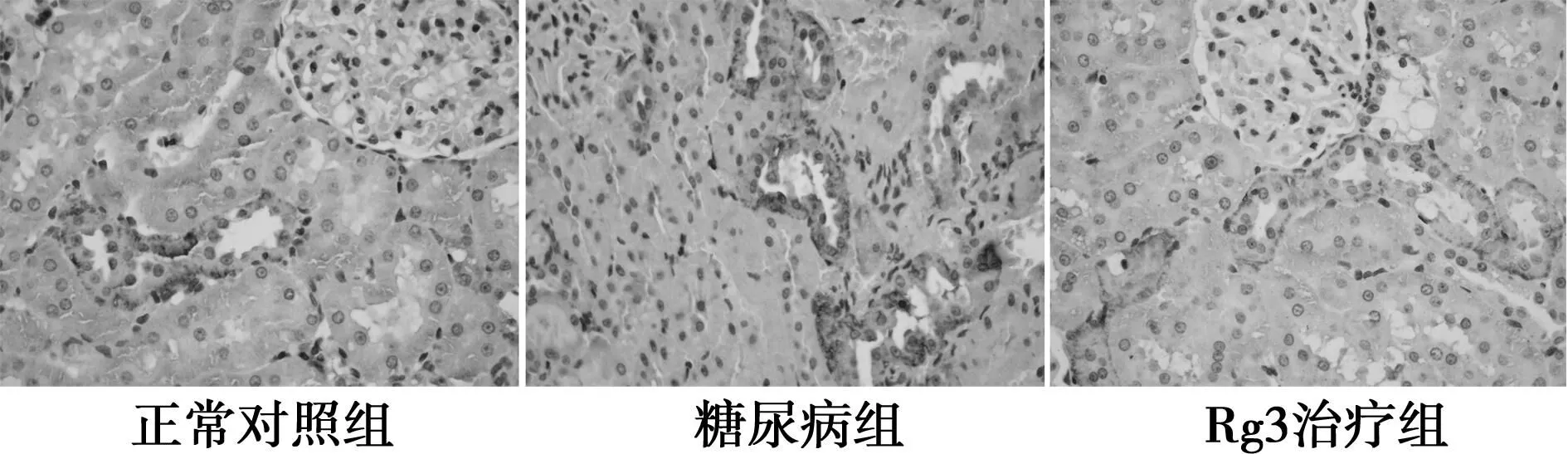
图2 TGF-β1免疫组织化学染色(DAB,×400)
2.4肾脏组织的凋亡情况如图3所示,在各组肾脏组织中,TUNEL染色阳性细胞主要见于肾小管上皮细胞。糖尿病组肾小管上皮细胞凋亡率(68.08±9.24)%显著高于正常对照组(9.86±3.53)%;Rg3治疗组(24.23±4.94)%低于糖尿病组,与正常对照组比较差异有统计学意义(P<0.05)。

图3 肾脏组织凋亡情况(TUNEL染色,×400)
2.5TGF-β1表达与肾脏细胞凋亡发生的相关性将TGF-β1表达与凋亡率行相关性分析,其相关系数r=0.652,P<0.001,线性方程为y(凋亡率)=5.69E-005x+0.043,R2=0.425。说明TGF-β1的表达与肾小管上皮细胞凋亡率呈正相关。
3讨论
TGF-β1是一种多功能细胞因子,在多种细胞和组织中参与控制细胞周期,调节细胞生长发育、细胞分化、基质形成、红细胞生成、血管生长、化学趋化性、免疫功能以及介导细胞凋亡。近年来大量对梗阻性肾病分子机制的探讨均发现TGF-β1 是介导肾脏细胞凋亡和肾纤维化发生最关键的细胞因子,在单侧输尿管结扎模型中给予TGF-β1 抗体能改善肾小管细胞凋亡〔10〕;体外试验和体内试验都已证实TGF-β1 在肾损伤后会导致肾小管上皮细胞和足细胞凋亡〔5,10,11〕,而肾小管上皮细胞凋亡可导致肾小管的萎缩,促进间质纤维化,最终导致慢性肾脏疾病进展至终末期肾衰竭。目前认为TGF-β1 通过Smads通路和MAPK通路介导细胞凋亡〔12〕,因此,下调TGF-β1蛋白,降低肾小管上皮细胞凋亡,对临床防治肾小管萎缩、减轻肾纤维化程度、延缓肾脏功能损害有着积极的意义。
人参皂苷Rg1可通过下调TGF-β1抑制拟衰老小鼠肾脏纤维化〔13〕。而人参皂甙Rg3能够改善糖尿病肾病的病理改变,包括肾小球基底膜增厚、系膜基质增多、肾小球内炎细胞浸润及肾间质的纤维化〔8〕。为达到更好的治疗效果,Rg3的给药剂量和给药时机尚需进一步的研究。
4参考文献
1王晓虎,孙良阁.苯那普利对早期糖尿病肾病患者转化生长因子 β1、尿白蛋白排泄率的影响〔J〕.中华实用诊断与治疗杂志,2009;23(12):1222-3.
2郭艳萍,杨广英,王建君,等.转化生长因子β及VEGF在肝纤维化中的表达〔J〕.中华实用诊断与治疗杂志,2008;22(10):724-5.
3Nangaku M.Chronic hypoxia and tubulointerstitial injury:a final common pathway to end-stage renal failure〔J〕.J Am Soc Nephrol,2006;17(1):17-25.
4Docherty NG,O'Sullivan OE,Healy DA,etal.Evidence that inhibition of tubular cell apoptosis protects against renal damage and development of fibrosis following ureteric obstruction〔J〕.Am J Physiol Renal Physiol,2006;290(1):F4-13.
5李静,柳斌,樊均明.TGF-β1在足细胞生理功能及病理损伤中的作用〔J〕.中国中西医结合肾病杂志,2011;12(12):1120-2.
6张倩,石蒙,檀金川.TGF-β1与糖尿病肾病的关系及中药研究进展〔J〕.中国中西医结合肾病杂志,2014;15(11):1030-1.
7程慧,宋新波,张丽娟.人参皂苷Rg3与Rh2 的研究进展〔J〕.药物评价研究,2010;33(4):307-11.
8王娟,崔春黎,富力,等.人参皂甙Rg3对糖尿病肾病大鼠生化指标及病理的影响〔J〕.现代生物医学进展,2014;14(36):7015-8.
9谷金宁.20(S)-人参皂苷Rg3对糖尿病大鼠心脏的保护作用研究〔D〕.长春:吉林大学博士学位论文,2013.
10Miyajima A,Chen J,Lawrence C,etal.Antibody to transforming growth factor-beta ameliorates tubular apoptosis in unilateral ureteral obstruction〔J〕.Kidney Int,2000;58(6):2301-13.
11Dai C,Yang J,Liu Y.Transforming growth factor-beta1 potentiates renal tubular epithelial cell death by a mechanism independent of Smad signaling〔J〕.J Biol Chem,2003;278(14):12537-45.
12白涛,张杰.TGF-β1介导肾小管上皮细胞凋亡分子机制研究探讨〔J〕.现代泌尿外科杂志,2010;15(3):238-40.
13叶洪,金建生,陈晓春,等.人参皂苷Rg1通过下调TGF-β1及βigh3表达延缓拟衰老小鼠肾脏纤维化〔J〕.中国老年学杂志,2014;34(21):6143-6.
〔2015-04-22修回〕
(编辑徐杰)
