TP-M13自动荧光法的改进及在美国山核桃品种鉴定上的应用
2015-12-30金群英徐燕丽叶华琳彭华正赵彩芳沈建军朱汤军
金群英,徐燕丽,叶华琳,彭华正,赵彩芳,沈建军,朱汤军*
(1. 浙江省竹类研究重点实验室,浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省科技学院,浙江 杭州 310023)
TP-M13自动荧光法的改进及在美国山核桃品种鉴定上的应用
金群英1,徐燕丽2,叶华琳1,彭华正1,赵彩芳1,沈建军1,朱汤军1*
(1. 浙江省竹类研究重点实验室,浙江省林业科学研究院,浙江 杭州 310023;2. 浙江省科技学院,浙江 杭州 310023)
用TP-M13自动荧光法检测了常用10个美国山核桃品种中的8个SSR位点,发现原有直接使用三引物方法扩增的有效性和可靠性较低,而经过改进的间接三引物法则有较大的实用价值,在此基础上进一步研究后认为混合三引物法在适当控制混合引物的对数和提高特异性后,在提高间接三引物法的扩增效率方面是可行的。
自动荧光检测;TP-M13;美国山核桃;SSR
简单序列重复(Simple sequence repeat,缩写为SSR),又称微卫星(microsatellite),是以1 ~ 6个碱基为基本单元的串联重复核酸序列,普遍存在和随机分布于所有已知真核生物和部分的原核生物基因组编码区和非编码区中[1]。在最初研究人类和果蝇等的基因组序列中发现,SSR在生物群体中具有高度多态性,可以通过常规的PCR扩增来进行检测[2~3]。随着大量物种基因组测序工作的推进,更进一步揭示了SSR是丰富的遗传标记来源,再加上SSR标记具有容易检测及共显性等特点,使得其逐渐成为目前应用最为广泛的生物基因型鉴定手段之一。SSR标记虽然易于PCR扩增,但常规的检测手段尚存在不少问题,如主要利用放射性标记或银染技术,难以准确读取SSR扩增片段大小[2~3]。利用DNA自动测序仪并配合专门的计算机软件,能够解决SSR扩增片段大小的判读问题。其原理是对SSR引物的 5'端或内部某个碱基进行荧光标记(FAM,HEX,ROX,TET等),然后应用自动荧光测序系统,分析PCR产物的确切长度,这样能够得到比银染更为理想的检测结果[4~5]。这种方法在进行最初的SSR引物筛选时,由于所需要检测的SSR引物数量较大,会面临合成荧光引物成本高的问题。为解决这个问题,将M13序列作为通用的接头,引入SSR的荧光测序鉴定中,可以大大降低SSR引物的筛选成本,这一方法被称为TP-M13(Tailed Primer-M13)自动荧光检测法[6~7]。近年来,该法已在杨梅、梨、花生、玉米、苹果和高粱等植物的品种鉴定上得到应用[8~14],然而,这一方法由于涉及到超多(超过标准PCR中的两个引物)和超长引物(一般引物是18 ~ 30个碱基)的扩增,带来了PCR反应中的复杂性,因此其是否在更多的物种中具有通用性,尚有待进一步验证。
美国山核桃(Carya illinoensis)是胡桃科(Juglandaceae)山核桃属(Carya)中最有经济价值的树种[15]。美国山核桃是典型的异交植物,现有生产实践发现,美国山核桃的品种配置是影响其产量主要因素之一。美国是美国山核桃的原产地之一,也是中心产区,多年来,其已选育命名的栽培品种约1 000个。我国引种美国山核桃已有100多年历史,多年的生产实践已证明我国广大亚热带地区是美国山核桃的适生区。但是,现有我国美国山核桃产区面临的主要问题是产量低下和不稳定,造成这一现象的原因有多个方面,其中之一就是现有引进的品种尚缺乏明确的亲缘关系分析,再加上一些杂交后代定名的混乱,导致难以进行有效的亲本选择和合理配置。
本文在国外已报导美国山核桃SSR分子标记常规方法的基础上,探讨更为准确的TP-M13自动荧光检测法在现有美国山核桃品种鉴定上的可行性,并对实验方案进行了优化,该改进型TP-M13方法不仅对于深入开展美国山核桃品种选育、子代亲本鉴定有重要参考价值,对利用TP-M13法开展其他植物品种的鉴定也有着重要的指导意义。
1 材料与方法
1.1 试验材料
样品于五月上旬采自桐庐县分水镇美国山核桃品种园。采集其嫩叶,置-20℃冰箱中备用。所涉及的品种如表1所示,其中30-1,2,3表示同一样本株系的不同取样部位,用于重复性验证。

表1 山核桃品种及其样品编号Table 1 Pecan cultivars and sample label of this experiment
1.2 试验方法
1.2.1 DNA提取 材料DNA提取分CTAB法和柱式法两种,CTAB法参考文献中的方法[16],柱式法采用新型快速植物基因组DNA提取试剂盒(BioTeke,北京百泰克生物技术有限公司)。若未说明处,均采用CTAB法进行提取。最后用1.0%的琼脂糖凝胶电泳定性检测所提DNA,用NanoDrop2000超微量分光光度计定量检测浓度,最后将DNA浓度稀释标定到20 ng/uL,置于-20℃冰箱备用。
1.2.2 引物设计及合成 从已报导的19对SSR引物中筛选出重复扩增性较好的8对引物[17],引物由上海生物工程技术服务有限公司合成。本实验对M13F序列(5'-CACGACGTTGTAAAACGAC-3')选择连接在SSR引物中的哪一条进行了优化,其依据是连接后保证引物是否有较适的GC含量和Tm值来决定的,引物设计软件为Oligo7,除了如表2所示引物名称和序列外,在单独合成M13F引物时在其5'端加6-FAM荧光基团,使扩增产物带上荧光。
1.2.3 PCR扩增反应条件 PCR实验所用试剂为BioTeke PCR MasterMix(BioTeke,北京),整个反应体系除引物和模板外,均按照试剂手册要求操作。所有PCR反应在Genepro Thermal Cycle(Bioer,Hangzhou)PCR仪上进行,程序均为:95℃,300 s;94℃,15 s,52℃,45 s,72℃,45 s,共35轮循环;72℃,300s。为进行荧光检测方法的比较,本文采用了三种TP-M13自动荧光检测法,分别是直接三引物法,间接三引物法以及混合三引物法,另外用标准的SSR荧光检测法进行比较,即所谓的直接二引物法。具体说明如下:
直接二引物法是标准的SSR扩增,只采用一轮PCR程序,反应体系20ul,模板为稀释好的DNA模板1ul,采用两条特异引物(10 umol/L)分别0.5ul进行扩增,其中一条特异引物带有荧光基团方便后续的荧光检测,本文只在Cin4和Ga39两个位点进行了直接二引物法的扩增,其目的是对本文的TP-M13方法进行比较。
直接三引物法是指只采用一轮标准的PCR程序,反应体系其它均与直接二引物法相同,只是扩增时加入三条引物,一条是特异引物(10 umol/L)0.5 uL,第二条是加了接头的特异引物(5 umol/L)0.5 uL,第三条引物是带荧光的通用引物 M13F(10 umol/L)0.5 uL。
间接三引物法是指进行两轮标准的 PCR程序,第一轮反应条件与直接二引物法完全相同,只是引物是普通不带荧光的特异引物。其扩增产物经1/100稀释后取 1 uL作为第二轮反应的模板,第二轮反应基本与直接三引物法相同,只是第二条引物为加了接头的特异引物(1 umol/L)0.5 uL。
混合三引物法,是间接三引物法的调整,即在第一轮反应时引入多对 SSR引物,每对 SSR引物的浓度是原来的1/引物对数,其扩增产物同样1/100稀释后取1 uL作为这些多对引物的第二轮反应模板,其它的与间接三引物法相同。1.2.4 产物检测和数据分析 将 PCR产物混合检测标样后,在ABI 3730XL测序仪上完成电泳扫描,数据采集,去掉低值数据,分析结果、补充测序、完成分析。用GeneScan4.0 软件对收集到的数据进行处理分析,提供产物片段大小、数量多少的信息数据,对计算机采集到的数据按照四舍五入法进行圆整。对于加接头扩增的SSR片段,最后要减去19bp的接头长度,最后结果导入Microsoft Excel中。
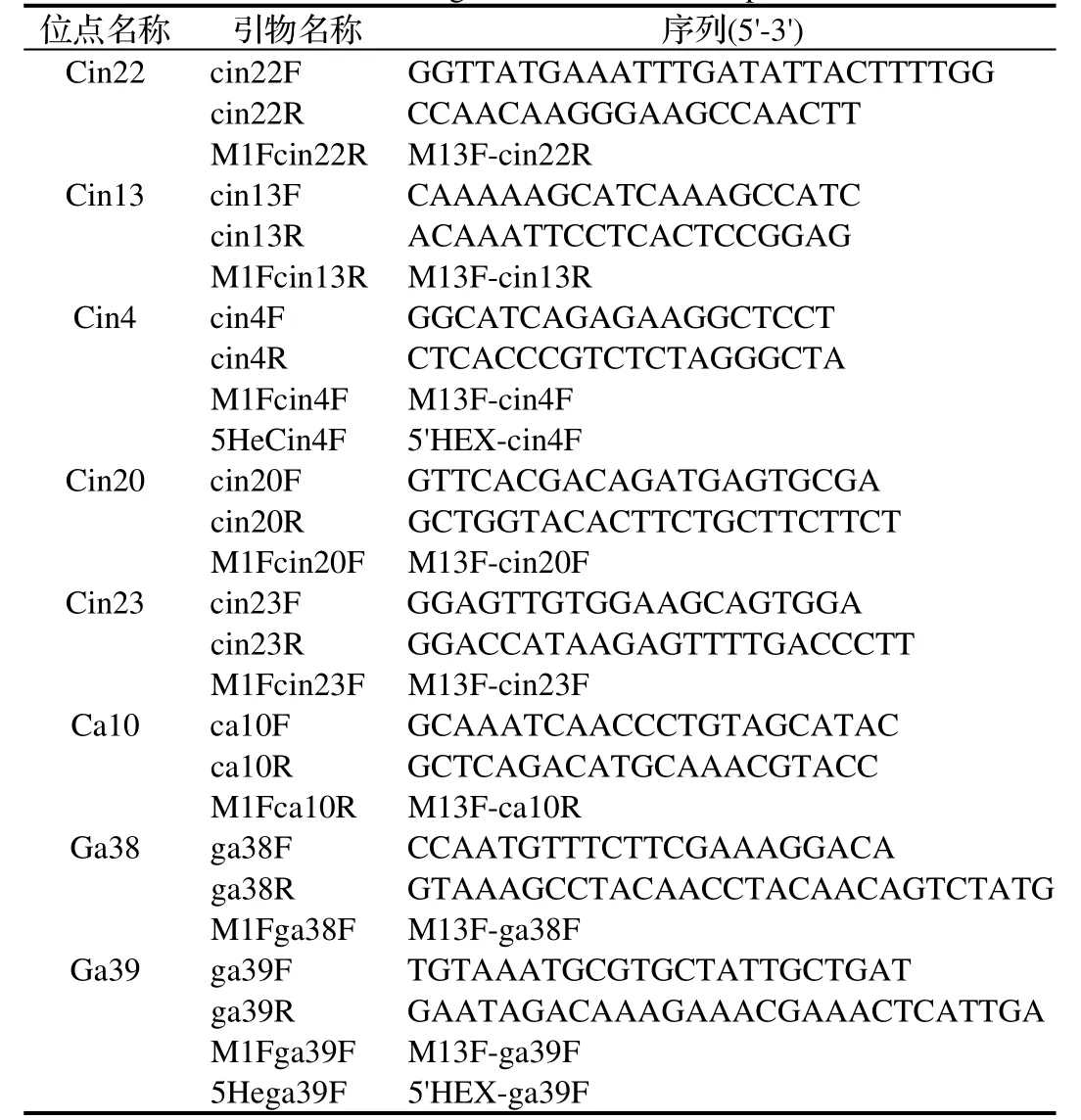
表2 8个SSR位点及相关引物序列Table 2 The eight SSR loci and their primers
2 结果与分析
2.1 SSR 自动荧光检测的不同方法比较
选取SSR位点Cin4和Ga39两个位点进行直接二引物法、直接三引物法和间接三引物法的比较。
从表3中可以看出,间接三引物法是效果最好的,甚至在某些品种的检测上,好于作为标准对照的直接二引物法,造成这一现象的原因可能是因为间接三引物法是二次扩增,这等于增加了该方法的检测敏感性。而在TP-M13方法中广为采用的直接三引物法是效果最差的,主要存在着难以扩增的问题,这可能与其中的长引物浓度较低有关。显然,直接采用文献中TP-M13方法(即这里的所谓直接三引物法)在美国山核桃中存在较大的问题,而我们对TP-M13方法的改进是可行的。在此基础上,进一步比较了间接三引物法与直接三引物法在其它六个SSR位点上的结果。
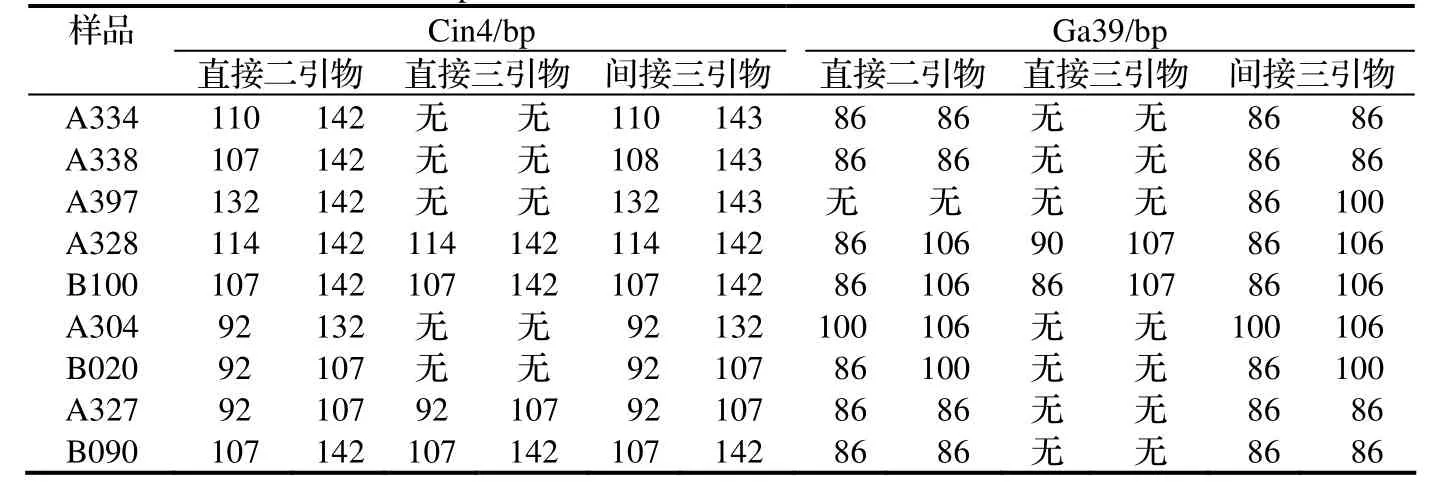
表3 两个SSR位点不同荧光检测法的结果比较Table 3 Comparison of different detection methods in two SSR loci
从表4可以看出,直接三引物扩增的有效率普遍较低,即使有扩增,扩增的多态性往往受到了抑制,如Cin23位点的样品A327和B090,直接三引物法只有84bp条带,而间接三引物法却有84bp和102bp两个条带。同时还发现,直接三引物和间接三引物有时在扩增片段上具有明显的不一致,这在Cin22位点上最为明显,这可能是直接三引物法容易导致位点的错误结合所致。另外,扩增产物大小有时还存在着细微的差异,如Cin13位点不同样品有时出现136bp条带,有时又出现137bp条带,这一结果可能与荧光检测法存在的误差有关。
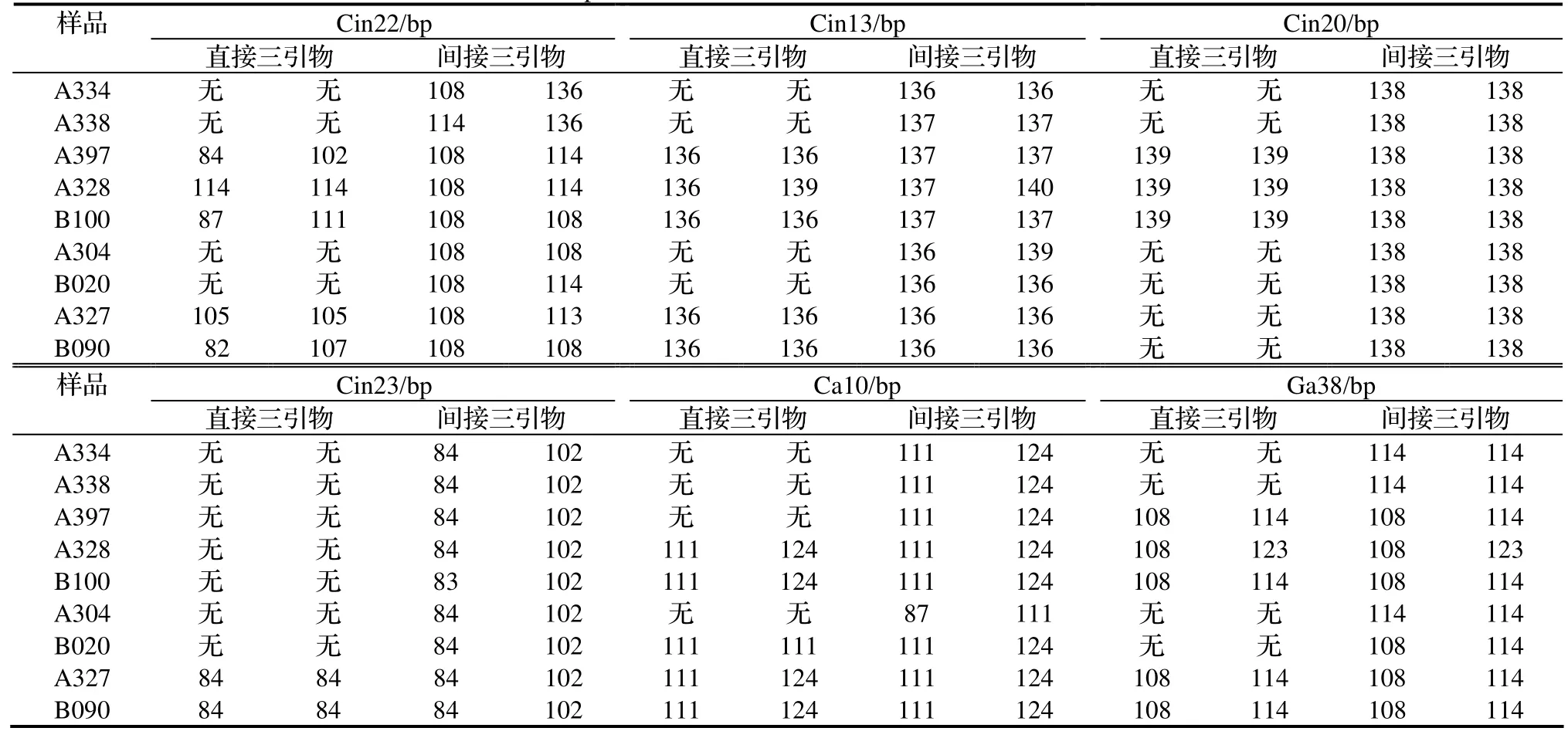
表4 两种TP-M13检测法在其它六个SSR位点上的检测比较Table 4 Comparison between two TP-M13 methods in six SSR loci
2.2 间接三引物法的改进
间接三引物法涉及两轮的PCR扩增,其第一轮PCR是普通的SSR扩增过程,由于这些SSR引物是特异的,我们就进一步探讨将这些引物进行混合扩增的可能性,这样可以在大量筛选时大大减少PCR的反应数。首先我们对8对SSR引物进行了混合,其扩增效果如表5。从表中结果来看,8引物混合存在不少问题,首先由于引物的浓度降低或者是某些引物的相互干扰,导致扩增的敏感性有较大的降低。例如,除Cin13和Ga39外,其他六个位点均有不能扩增的样品。在将表3,表4和表5结果进行比较时发现,混合三引物法扩增的样品中出现了一些多态性消失现象,如Cin22位点的A328,Cin4位点的A304,Cin23位点的A334,Ca10位点的A304以及Ga39的A397等,也有出现其它杂带,如Cin20位点中91bp条带的出现。同时还进一步发现,对于相同样品的相同位点,有时有一个碱基左右误差,如Cin13在表4中有137bp条带,而在表5中只有136bp的条带,这是荧光检测法本身存在的误差,还是检测方法的差异造成的,需要进一步验证。
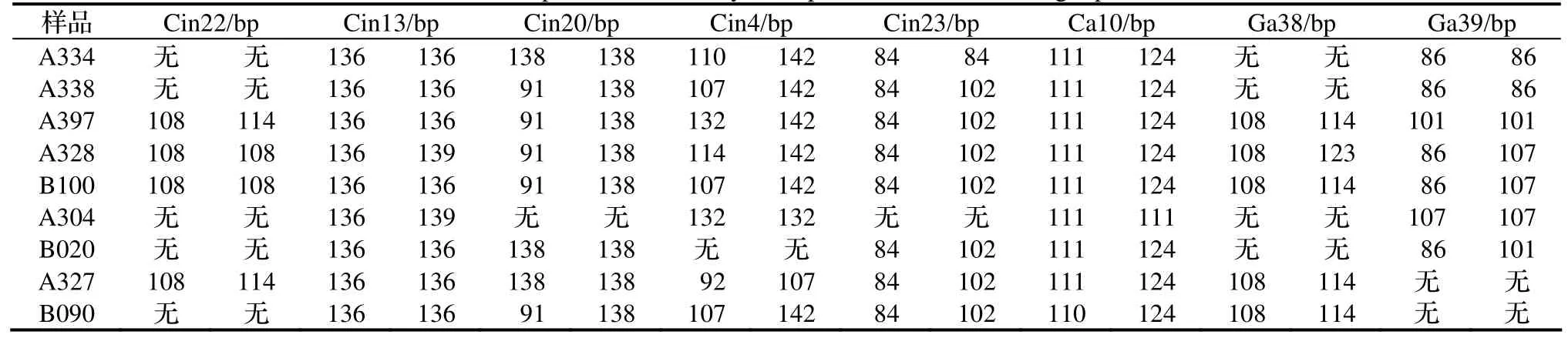
表5 8引物混合三引物法SSR扩增效果Table 5 Amplification result by three primer method mixed eight primers
为解决这些问题,用同一品种的样品进行了重复性试验,由于考虑到8引物混合可扩增性略差,设置了6引物和4引物的混合三引物法,同时以前述具有较好效果的间接三引物法作为对照。表6表明,对于同一品种的不同植株,即便是不同提取方法,间接三引物法均显示了较好的重复性,但显然由于荧光检测法本身的局限性,有时会存在1bp的误差,如Cin20位点,存在139bp和138bp两种结果,这就印证了前面关于荧光检测法中误差的推测。6引物混合的三引物法也有较好的效果(表7),但是该方法对DNA提取方法有一定敏感性,如本文中以柱式纯化后的样品在可扩增性和多态性显示方面更为稳定,如Ga39位点107bp片段的显示。而4引物混合的三引物法(表 8)结果就基本上与间接三引物法一致了,也降低了对提取方法的敏感性,因此具有较好的实用价值。

表6 6引物的间接三引物法SSR扩增效果Table 6 Amplification result by indirect three primer method
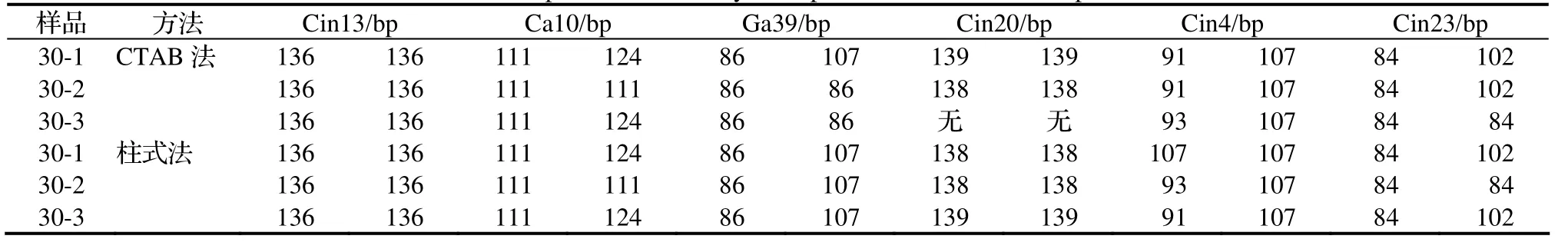
表7 6引物混合三引物法SSR扩增效果Table 7 Amplification result by three primer method mixed six primers
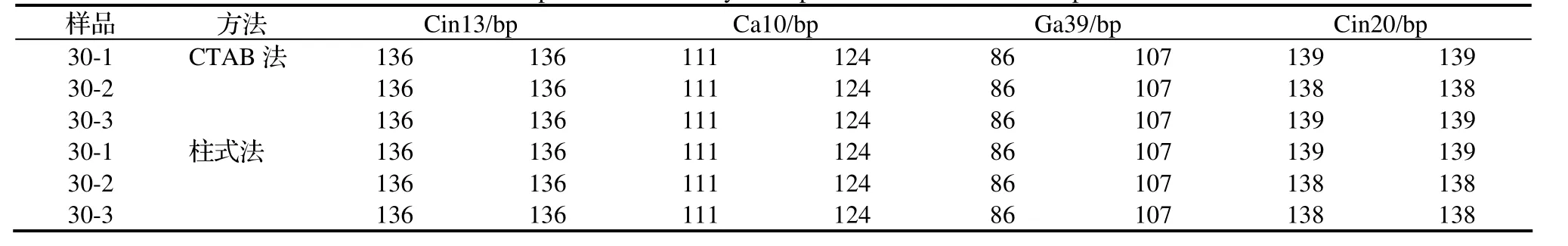
表8 4引物混合三引物法SSR扩增效果Table 8 Amplification result by three primer method mixed four primers
3 讨论
荧光法检测SSR引物具有比常规的银染法更高的精度,但是由于荧光引物的合成比较昂贵,限制了其大量使用,本实验中也只合成了两条带荧光基团的引物,作为实验对照。TP-M13自动荧光检测法是一种低成本开展荧光法SSR检测的方法,它只对通用引物加荧光基团,避免了合成大量带荧光基团SSR引物的高成本,但是由此带来的扩增的干扰问题。有研究者利用TP-M13法检测高粱的基因型后指出,并不是各个物种都适合TP-M13的检测方法,这可能与被检测物种的基因组大小和复杂性有关[14]。美国山核桃是2倍体植物(2n=2x=32),基因组大小约1344Mb[18],比水稻和高粱等作物大得多,因此直接开展TP-M13的检测确实会存在一些问题。本文通过两次PCR扩增,巧妙地解决了这一扩增带来的杂带问题,并且还提高了其敏感性。值得指出的是,间接三引物法的首轮PCR至关重要,因为我们也尝试过第一轮让一长引物(带M13F接头特异引物)与另一特异引物进行扩增,第二轮再用特异引物和带荧光的通用引物进一步扩增,最终产物经常会出现弥散状,甚至很难得到扩增产物,因此第一轮保证精确和有效的扩增是间接三引物法成功的关键。另外,本文还尝试通过混合几对SSR引物来减少所需PCR扩增的数量,虽然8对引物的混合问题比较多,但4和6对引物混合的结果还是可以的,多对引物的混合是否可行,实际上也跟这些SSR引物的特异性有关,在了解其基因组背景的情况下,可以设计多对引物混合也是完全可行的。上述的这些方法改进,对于其它物种特别是许多林木品种的检测具有重要意义,因为许多木本植物基因组都比较大,SSR位点筛选的工作量也很大,用直接三引物的TP-M13检测法很容易出现问题,如果采用间接三引物或混合三引物法,虽然PCR的数量有所增加,但其可靠性将大大增加。当然,荧光法检测法也存在着一定误差,对于这个问题,如果结合一定重复性或者根据图谱的分析,可以进行适当补偿和修正,例如,通过分析可以推断表3中,Cin4位点的142bp和143bp实为同一条带的读数误差。
从标记的分布可以推断和排除一些亲本之间的关系,比如本文的金华这一国内品种,可以推断其亲本不可能是A338和A304,即分别对应品种Forkert和Moore,因为A338在Cin22位点上没有108bp位点,而A304 在Cin4位点缺少107或142bp,在Ga39位点缺少86bp位点。如果增加更多的标记和更多的品种,那么我们可以据此为这些品种的亲缘关系找到相应的分子证据,从而方便品种的选育。
[1]Li Y C, Korol A B, Fahima T, et al. Microsatellites: genomic distribution, putative functions and mutational mechanisms: a review[J]. Mol Ecol, 2002, 11(12):2 453-2 465.
[2]Litt M, Luty J A. A hypervariable microsatellite revealed by in vitro amplification of a dinucleotide repeat within the cardiac muscle actin gene[J]. Am J Hum Genet, 1989, 44(3):397-401.
[3]Tautz D. Hypervariability of simple sequences as a general source for polymorphic DNA markers[J]. Nucl Acids Res, 1989, 17(16):64 63-6 471.
[4]Kresovich S, Szewc-Mcfadden A K, et al. Abundance and characterization of simple-sequence repeats (SSRs) isolated from asize-fractionated genomic library of Brassica napus L. (rapeseed)[J]. Theor Appl Genet, 1995, 91(2):206-211.
[5]郝晨阳,王兰芬,贾继增,等. SSR荧光标记和银染技术的比较分析[J]. 作物学报, 2005, 31(2):144-149.
[6]Oetting W S, Lee H K, Flanders D J, et al. Linkage analysis with multiplexed short tandem repeat polymorphisms using infrared fluorescence and M13 tailed primers[J]. Genomics, 1995, 30(3):450-458.
[7]Schuelke M. An economic method for the fluorescent labeling of PCR fragments[J]. Nat Biotechnol, 2000, 18(2):233-234.
[8]Jia H M, Shen Y T, Jiao Y, et al. Development of 107 SSR markers from whole genome shotgun sequences of Chinese bayberry (Myrica rubra) and their application in seedling identification[J]. J Zhejiang Univ Sci B, 2014, 15(11):997-1005.
[9]Yue X Y, Liu G Q, Zong Y, et al. Development of genic SSR markers from transcriptome sequencing of pear buds[J]. J Zhejiang Univ Sci B,2014, 15(4):303-312.
[10]高源,王昆,田路明,等. TP-M13-SSR技术及其在苹果种质资源遗传多样性研究中的应用[J]. 植物遗传资源学报,2011,12(2):228 -233.
[11]Liu Zhi-Zhai, Guo Rong-hua, Zhao jiu-ran, et al. Genetic Diversity of Two Important Groups of Maize Landraces with Same Name in China Revealed by M13 Tailed-Primer SSRs[J]. Agric Sci Chin, 2009, 8(1):15-23.
[12]Barkley N A, Dean R E, Pittman R N, et al. Genetic diversity of cultivated and wild-type peanuts evaluated with M13-tailed SSR markers andsequencing[J]. Genet Res, 2007, 89(2):93-106.
[13]刘志斋,王天宇,黎裕. TP—M13-SSR技术及其在玉米遗传多样性研究中的应用[J]. 玉米科学,2007,15(6):10-15.
[14]李会勇,王天宇,黎裕,等. TP-M13自动荧光检测法在高梁SSR基因型鉴定中的应用[J]. 植物遗传资源学报,2005,6(1):68-70.
[15]张日清,李江,吕芳德,等. 我国引种美国山核桃历程及资源现状研究[J]. 经济林研究,2003,21(4):107-109.
[16]彭华正. 竹子分生组织发育特点以及相关基因的克隆和功能研究[D]. 杭州:浙江大学,2005.
[17]Grauke L J, Iqbal M J, Reddy A S, et al. Developing Microsatellite DNA Markers in Pecan[J]. J. Am. Soc. Hor. Sci, 2003, 128(3):374-380.
[18]Grauke L J, Price H J, Johnston J S. Genome Size of Pecan as Determined by Flow Cytometry[J]. HortScience, 2001, 36(4):814.
Modified TP-M13 Automated Fluorescent-labelled SSR Method and Its Application in Identification of Pecan Cultivars
JIN Qun-ying1,XU Yan-li2,YE Hua-lin1,PENG Hua-zheng1,ZHAO Cai-fang1,SHEN Jian-jun1,ZHU Tang-jun1*
(1. Zhejiang Provincial Key Lab of Bamboo Resea
r
ch, Zhejiang Forestry Academy, Hangzhou 310023, China;2. Zhejiang University of Science and Technology, Hangzhou 310023, China)
Although TP-M13 automated fluorescent-labelled system has reduced the cost of fluorescent detection of SSR genotyping by introducing a universal fluorescent labelled primer, the complexity of PCR reaction brought by three primers limits its application on more species. TP-M13 method using three primers directly was implemented to detect eight SSR loci of regular 10 pecan (Carya illinoensis ) cultivars, which revealed the low availability and liability. A modified TP-M13 detection method called indirect three primer method was proved to be effective and valuable in solving this problem. Furthermore, the mixing of SSR primers based on this indirect three primer method could further improve the PCR efficiency.
automated fluorescent-labelled system; TP-M13; Carya illinoensis; SSR
S792.13
A
1001-3776(2015)05-0041-06
2015-01-10;
2015-07-30
国家林业局948项目(2011-4-31);浙江省自然科学基金(Y3110499)
金群英(1970-),女,浙江义乌人,副研究员,从事林木分子生物学;*通讯作者。
