鞘内注射右美托咪定对骨癌痛大鼠脊髓小胶质细胞活化及Toll样受体的影响
2015-12-30孟根其其格,罗建军,张毅
鞘内注射右美托咪定对骨癌痛大鼠脊髓小胶质细胞活化及Toll样受体的影响
孟根其其格罗建军张毅1
(北京市东城区第一人民医院麻醉科,北京100075)
摘要〔〕目的探讨鞘内注射右美托咪定(DEX)对骨癌痛大鼠脊髓小胶质细胞活化的影响。方法通过向健康雄性SD大鼠(200~250 g)胫骨骨髓腔内注射Walker256乳腺癌细胞液制备骨癌痛(BCP)模型后进行鞘内置管,将45只成功诱导BCP大鼠模型随机分组(n=15):高剂量DEX(DEX-H)组、低剂量DEX(DEX-L)组及生理盐水(NS)组,DEX-H与DEX-L组分别于鞘内注入6 μg·kg-1·d-1或3 μg·kg-1·d-1(注射体积均为10 μl),同时选取15只同周龄大鼠作对照(C),其余两组鞘内注入等体积生理盐水。于鞘内注射前后对4组进行行为学检测来分析DEX对BCP大鼠机械缩足阈值(MWT)和缩足热潜伏期(WTL)的影响,采用荧光免疫组化法检测各组鞘内注射7 d后的脊髓小胶质细胞特异表达补体C3受体(OX-42)的荧光积分光密度(IOD),酶联免疫吸附法检测脊髓肿瘤坏死因子(TNF)-α和白介素(IL)-1β水平,免疫印迹检测脊髓Toll样受体(TLR)4及TLR2蛋白水平。结果与C组相比,NS组鞘内注射0~7d的NMT和WTL降低,脊髓小胶质细胞OX-42的IOD、脊髓TNF-α和IL-1β水平及Toll样受体表达均升高(P<0.05);给予DEX鞘内注射可改善BCP大鼠的以上异常指标(P<0.05),但与C组均有统计学差异(P<0.05);且DEX-H组的以上指标均优于DEX-L组(P<0.05)。结论鞘内注射DEX对BCP大鼠有较好的镇痛作用并抑制了脊髓小胶质细胞活化,可能与其缓解炎症反应及降低Toll样受体表达有关。
关键词〔〕右美托咪定;骨癌痛;镇痛;脊髓小胶质细胞活化
中图分类号〔〕R73〔文献标识码〕A〔
1新疆医科大学附属中医医院手术麻醉科
第一作者:孟根其其格(1979-),女,主治医师,主要从事老年麻醉、骨科麻醉研究。
骨转移癌会引起中重度骨痛,严重影响生活质量,同时也会导致患者体能状态下降及焦虑或抑郁发生〔1〕。目前,疼痛治疗的重点已转移至神经胶质细胞,且已证实神经胶质细胞参与病理性疼痛的发生发展〔2〕。疼痛时,处于静息状态的小胶质细胞被活化,因此抑制神经小胶质细胞活化成为疼痛治疗的有效措施〔3〕。右美托咪啶(DEX)为一种α2肾上腺素能受体激动剂,具有高选择性、高效的优点,可起到镇静催眠、镇痛及抑制交感神经活动的作用,且不良反应低,在临床应用较广〔4,5〕。笔者推测DEX对骨癌痛亦有较好的镇痛作用。鉴于鞘内注射是临床治疗疼痛的常用手段,故本研究给予骨癌痛大鼠模型鞘内注射DEX,观察对小胶质细胞活化的影响。
1材料与方法
1.1试剂与主要仪器DEX由于江苏新晨制药有限公司提供;Walker256乳腺癌细胞购自上海生物医学工程研究院;二喹啉甲酸(BCA)蛋白分析试剂盒购自碧云天生物科技公司;Triton X-100、苯甲基黄酰氟及Tris-HCl及购自美国Sigma公司;白介素(IL)-1β和肿瘤坏死因子(TNF)α检测试剂盒购自南京建成生物工程研究所;羊抗特异表达补体C3受体(OX-42)抗体购自美国Abcam公司,兔抗Toll样受体(TLR)4及TLR2抗体均购自美国Santa Cruz公司;红色标记的二抗购自上海亨代劳生物有限公司。仪器:Multiskan Ascent酶标仪购自Thermo公司;5424R小型台式冷冻离心机、移液枪均购自德国Eppendorf公司;全自动热辐射刺激仪购自中国科学院生物医学工程研究所;Mini Protean 3 Cell小型垂直电泳槽购自美国Bio-Rad公司。
1.2动物与分组通过向健康雄性SD大鼠(200~250 g)胫骨骨髓腔内注射Walker256乳腺癌细胞液制备骨癌痛(BCP)模型后进行鞘内置管,将45只成功诱导BCP大鼠模型随机分组(n=15):高剂量DEX(DEX-H)组、低剂量DEX(DEX-L)组及生理盐水(NS)组,DEX-H与DEX-L组分别于鞘内注入6、3 μg·kg-1·d-1(注射体积均为10 μl),同时选取15只同周龄大鼠作对照(C),其余两组鞘内注入等体积生理盐水。
1.3BCP模型制备及鞘内置管根据文献〔6〕制备BCP模型:给予BCP大鼠腹腔注射戊巴比妥钠(40 mg/kg),待大鼠充分麻醉后,取仰卧位后对左后肢进行消毒备皮,采用手术刀切开皮肤,分离肌肉筋膜充分暴露胫骨,于胫骨结节下外0.5~1 cm的胫骨平台位置,采用微量注射器抽取Walker256乳腺癌细胞液,向骨髓腔注射10 μl细胞液,用骨蜡封住针孔并缝合。待BCP制备后5 d根据Sluka等〔7〕的方法进行鞘内置管:切开枕部皮肤后,22G无菌注射器枕头刺破寰枕膜,待脑脊液流出后置入PE-10导管,固定好导管后缝合皮肤。术后肌注青霉素预防感染。
1.4行为学评价分别于鞘内注射前、鞘内注射不同时间点(1、3、5、7 d)后进行行为学检测,分析DEX鞘内注射对机械缩足阈值(MWT)和缩足热潜伏期(WTL)的影响,来评价其镇痛效果。MWT:采用不同折力(1.0、1.4、2.0、4.0、6.0、8.0、10.0、15.0 g)Von Frey纤维刺激足底中部,每次刺激6~8 s,每次刺激间隔1 min,当大鼠出现快速缩足或舔足,则定义为阳性反应,重复5次,3次以上阳性反应的最小刺激力度计为MWT。WTL:采用全自动热辐射刺激仪照射足底,每次照射不超过25s,每次重复3次,间隔5 min,3次出现抬腿反应的时间平均值计为WTL。MWT和WTL的数值越小,就表明痛觉越敏感。
1.5荧光免疫组化采用脊髓小胶质细胞特异性标记物OX-42的荧光积分光密度(IOD)值来评价其活化情况。过量麻醉致死后,迅速取出大鼠的L4~6脊髓段,经多聚甲醛固定、蔗糖脱水后,制备厚20 μm的冠状冰冻切片,每隔5张保留1张片子,每隔脊髓样本选取5张用于免疫组化,经H2O2室温孵育及山羊血清封闭后,滴加OX-42的一抗(1∶100),4℃孵育过夜后,滴加红色标记的二抗,将片子置于荧光显微镜下观察,采用Image Pro Plus 6.0图像分析软件测定荧光积分光密度(IOD)。
1.6酶联免疫吸附法将新鲜脊髓标本取出后,于冰上进行裂解,以5 000 r/min离心5 min后保留上清,采用对应试剂盒检测脊髓提取液中的TNF-α、IL-1β含量,以上操作均严格遵守试剂盒说明书。
1.7免疫印迹BCA法检测脊髓提取液中的蛋白浓度,每个样本取等量蛋白,与上样缓冲液混匀、煮沸,上样后行10% SDS-PAGE凝胶电泳,半干转法将电泳条带转移至硝酸纤维素膜,脱脂奶粉封闭后,根据膜面积加入TLR-2(1∶100)、TLR-4(1∶200)一抗,4℃孵育过夜,次日加入二抗(1∶5 000)室温孵育1 h,以GAPDH为内参(1∶3 000),ECL化学发光法显影,采用Image Pro Plus 6.0软件分析各条带光密度,结果表示为目的条带与内参的光密度比值。
1.8统计学分析采用SPSS16.0软件,组间比较采用t检验及单因素分析。
2结果
2.1鞘内注射DEX对MWT的影响与C组比较,NS组鞘内注射0~7 d的NMT水平降低,差异有统计学意义(P<0.05);给予DEX鞘内注射可升高BCP大鼠模型的MWT(P<0.05),但与C组的差异仍有统计学意义(P<0.05);DEX-H组鞘内注射1~7 d的NMT水平均高于DEX-L组(P<0.05)。见图1A。
2.2鞘内注射DEX对WTL的影响与C组比较,NS组鞘内注射0~7 d的WTL水平降低,差异有统计学意义(P<0.05);给予DEX鞘内注射可升高BCP大鼠模型的WTL(P<0.05),但与C组的差异仍有统计学意义(P<0.05);DEX-H组鞘内注射1~7 d的WTL水平均高于DEX-L组(P<0.05)。见图1B。
2.3鞘内注射DEX对脊髓小胶质细胞活化的影响NS组鞘内注射7d的小胶质细胞OX-42的IOD为662.8±53.7,高于C组的246.7±21.5,差异有统计学意义(P<0.05);给予DEX鞘内注射可降低BCP大鼠模型的小胶质细胞OX-42的IOD水平,但与C组的差异仍有统计学意义(P<0.05);DEX-H组鞘内注射7d的IOD水平为345.9±25.8,低于DEX-L组的492.3±44.2,差异有统计学意义(P<0.05)。见图2。
2.4 鞘内注射DEX对脊髓细胞炎症因子水平的影响与C组比较,NS组鞘内注射7 d后的脊髓TNF-α和IL-1β水平均升高,差异有统计学意义(P<0.05);给予DEX鞘内注射可降低BCP大鼠模型的脊髓TNF-α和IL-1β水平(P<0.05),但与C组的差异仍有统计学意义(P<0.05);DEX-H组鞘内注射7 d后的脊髓TNF-α和IL-1β水平均低于DEX-L组(P<0.05)。见表1。
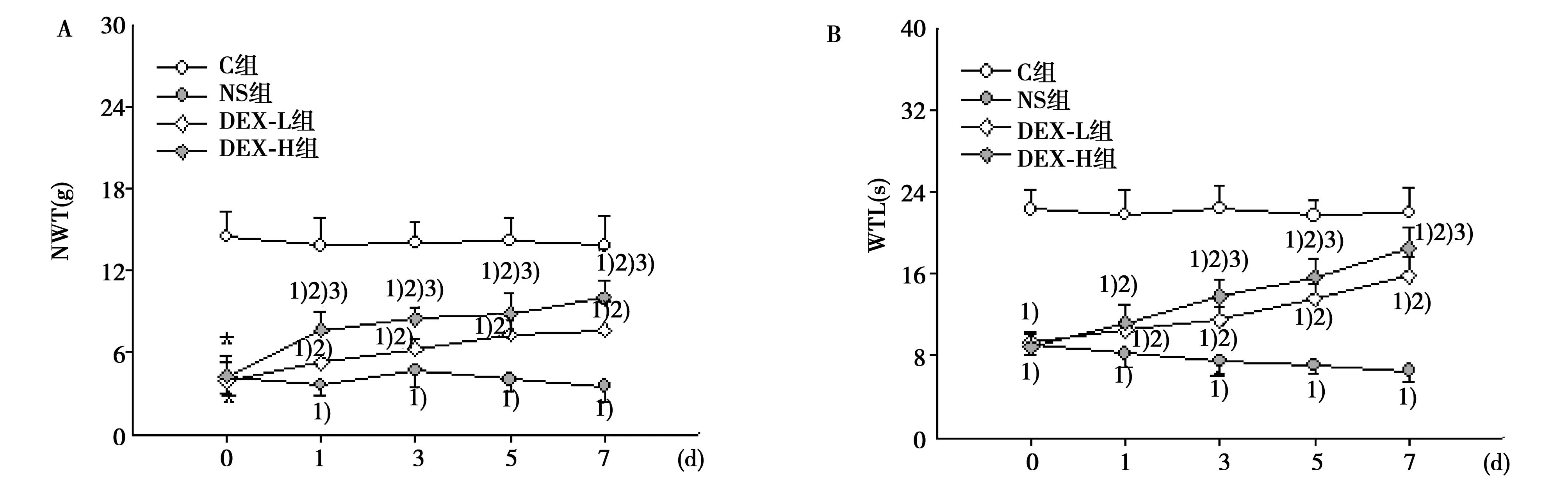
A:MWT;B:WTL;与C组比较:1)P<0.05;与NS组比较:2)P<0.05;与DEX-L组比较:3)P<0.05 图1 鞘内注射DEX对MWT和WTL的影响
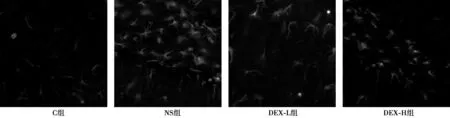
图2 鞘内注射DEX对脊髓小胶质细胞OX-42的IOD影响(×400)
2.5鞘内注射DEX对脊髓Toll样受体表达的影响与C组比较,NS组鞘内注射7d后的脊髓TLR-2和TLR-4蛋白水平升高(P<0.05);给予DEX鞘内注射可降低BCP大鼠模型的脊髓TLR-2和TLR-4水平(P<0.05),但与C组的差异仍有统计学意义(P<0.05);DEX-H组鞘内注射7 d后的脊髓TLR-2和TLR-4水平均低于DEX-L组(P<0.05)。见图3,表2。
表1 鞘内注射DEX对脊髓细胞炎症因子水平的
与C组比较:1)P<0.05;与NS组比较:2)P<0.05;与DEX-L组比较:3)P<0.05;下表同
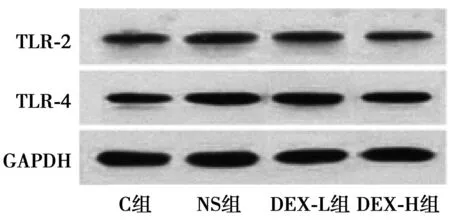
图3 鞘内注射DEX对脊髓Toll样受体表达的影响

组别TLR2TLR4C组0.18±0.050.22±0.03NS组0.57±0.031)0.74±0.051)DEX-L组0.39±0.061)2)0.45±0.041)2)DEX-H组0.25±0.021)2)3)0.36±0.041)2)3)
3讨论
骨癌痛是一种中重度病理性疼痛,严重影响患者生活质量。为研究鞘内注射DEX对骨癌痛有无改善作用,本研究采用公认的动物模型,即通过采用Walker256乳腺癌细胞向胫骨上段骨髓腔内注射来制备BCP模型。大鼠在骨髓腔内接种乳腺癌细胞后会引起骨破坏,主要表现为骨皮质和骨小梁损伤,尤其在接种12 d后会胫骨骨髓腔会出现大规模肿瘤细胞浸润〔8〕。本研究根据相关文献报告于BCP模型制备10 d后进行鞘内注射治疗,同时为研究DEX对癌痛的治疗效果,本研究采用两个剂量研究鞘内注射DEX对骨癌痛大鼠脊髓小胶质细胞活化的影响。
本研究发现:BCP模型建立后,大鼠的疼痛阈值降低,主要表现为MWT和WTL水平均升高,提示BCP模型建议成功,且在为期7 d的治疗中,NS组的MWT和WTL水平均维持在一个稳定水平,提示该种模型的疼痛状态较为稳定,不会通过机体的代偿而缓解或恢复,可更好地研究DEX的镇痛效果。给予DEX鞘内注射后发现,治疗1 d后MWT和WTL水平即升高,差异有统计学意义,以上表明DEX对BCP疼痛有改善效果,且改善效果可持续7 d。
目前,小胶质细胞已成为疼痛干预的重点,约占神经胶质细胞的5%~10%,在正常情况下为静息状态,但外界刺激可引起小胶质细胞激活,如参与术后持续性疼痛形成及神经病理性疼痛有关〔9,10〕。小胶质细胞,由脊髓单核细胞分化而来,当其活化时,其主要表面抗原物质OX-42会大量表达〔11〕,故本研究采用荧光免疫组化法检测OX-42的IOD评价小胶质细胞的激活情况。本研究发现:NS组的IOD值高于C组,提示BCP大鼠的小胶质细胞处于活化状态,与癌细胞浸润引起的疼痛有关,而DEX鞘内注射后IOD降低,提示DEX可抑制小胶质细胞活化,为其镇痛的主要原因。疼痛可引起炎症反应,尤其当小胶质细胞处于活化状态时〔12〕,本研究中BCP大鼠的脊髓常见炎症因子TNF-α和IL-1β水平升高,而给予DEX鞘内注射后,以上炎症因子水平降低,表明DEX可缓解炎症反应。Toll样受体介导了炎症反应〔13〕,而本研究发现BCP大鼠的TLR-2和TLR-4水平均升高,更加证实了癌痛大鼠出现了炎症反应,而给予DEX后两者水平下调,与其改善炎症反应的结论一致。
参考文献4
1Cheng M,Liu L,Yang HS,etal.Circulating tumor cells are associated with bone metastasis of lung cancer〔J〕.Asian Pac J Cancer Prev,2014;15(15):6369-74.
2Vallejo R,Tilley DM,Vogel L,etal.The role of glia and the immune system in the development and maintenance of neuropathic pain〔J〕.Pain Pract,2010;10(3):167-84.
3Jun IG,Kim SH,Yoon YI,etal.Intrathecal lamotrigine attenuates antinociceptive morphine tolerance and suppresses spinal glial cell activation in morphine-tolerant rats〔J〕.J Korean Med Sci,2013;28(2):300-7.
4刘征宇,温蔚,雷恩骏,等.小剂量右美托咪啶应用于高龄患者全身麻醉的效果〔J〕.中国老年学杂志,2011;31(24):4935-6.
5李春萍,杜奕鹏,宋雪松,等.右美托咪定对老年患者术后舒芬太尼自控静脉镇痛效果的影响〔J〕.中国老年学杂志,2011;31(16):3043-4.
6李晓青,孙玉明,黄章翔,等.Walker 256乳腺癌细胞构建大鼠胫骨骨癌痛模型〔J〕.中国肿瘤生物治疗杂志,2008;15(1):41-5.
7Sluka KA,Audette KM.Activation of protein kinase C in the spinal cord produces mechanical hyperalgesia by activating glutamate receptors,but does not mediate chronic muscle-induced hyperalgesia〔J〕.Mol Pain,2006;2:13.
8陈勇,杜晓红,应俊,等.鞘内注射Staurosporine对骨癌痛大鼠脊髓小胶质细胞活化的影响〔J〕.临床麻醉学杂志,2013;29(12):1214-7.
9Zhuo M,Wu G,Wu LJ.Neuronal and microglial mechanisms of neuropathic pain〔J〕.Mol Brain,2011;30(4):31.
10应彦璐,许学兵,佘守章,等.背根神经节小胶质细胞活化在大鼠术后持续性痛形成中的作用〔J〕.中华麻醉学杂志,2013;33(2):156-8.
11卢波,肖纯,孙建良,等.神经病理性疼痛中脊髓小胶质细胞活化的分子机制〔J〕.国际麻醉学与复苏杂志,2013;34(6):548-51.
12王新,李明军,张坤,等.脑出血与小胶质细胞介导的炎症相关性〔J〕.中国老年学杂志,2013;33(13):3268-70.
13方静,杜丽,付辉,等.炎症反应中的microRNAs及其在TLR信号通路中的调控作用〔J〕.第二军医大学学报,2013;34(7):782-6.
〔2014-07-20修回〕
(编辑滕欣航)
