电化学法对苦荞茶中芦丁含量的测定
2015-12-29胡海洋陈红艳
胡海洋,陈红艳*
电化学法对苦荞茶中芦丁含量的测定
胡海洋,陈红艳*
(北京林业大学理学院,北京 100083)
采用循环伏安法和差分脉冲伏安法研究芦丁在活化电极上的电化学行为。分别用0.5 mol/L硫酸溶液对玻碳电极进行酸法循环伏安处理和酸法恒电位极化处理,用1 mol/L NaOH溶液对玻碳电极进行碱法循环伏安处理和碱法恒电位极化处理使电极活化。对比4 种不同的玻碳电极活化方法,结果发现经过1 mol/L NaOH溶液恒电位极化法处理的玻碳电极活化效果好;使用该活化电极考察芦丁的电化学行为,发现在pH值为2的布列顿-罗宾逊缓冲液中,芦丁在活化玻碳电极上的电化学响应较好,产生一对主要的准可逆的氧化还原峰,氧化还原过程涉及2电子及2质子。使用差分脉冲伏安法测得氧化峰电流在0.6~10 μmol/L的范围内与芦丁浓度呈良好的线性关系,最低检出限为0.08 μmol/L,依此建立芦丁含量的测定方法。该方法简便、灵敏、重复性较好,应用此法能够成功分析苦荞茶中芦丁的含量。
芦丁;活化玻碳电极;电化学;差分脉冲伏安法;苦荞茶
苦荞茶是由苦荞麦的种子加工而成的一种保健饮品,因其具有抗氧化、降血糖、降血脂等功效而深受广大消费者的青睐[1]。苦荞茶的众多功效很大程度上与其富含黄酮类化合物有关。苦荞茶中的黄酮类物质主要为芦丁,占总黄酮的70%~90%。因此苦荞茶中芦丁含量的高低是评价苦荞茶质量好坏的重要标准之一。芦丁是广泛存在于天然植物中的一种黄酮类化合物,具有降低毛细血管脆性、改善微循环等多种药理作用[2-4]。
目前常见的芦丁含量检测方法有高效液相色谱法[5-9]、分光光度法[10-11]和毛细管电泳法等[12-13]。高效液相色谱和毛细管电泳设备价格高且操作比较复杂,分光光度法容易受到干扰且灵敏度不高。电化学方法用于物质的检测具有操作简便、快速和成本低廉的优点[14-17],可以为苦荞茶中芦丁含量的测定提供一种新的途径。在电化学研究中玻碳电极是常用的电极材料,有研究使用修饰后的玻碳电极对芦丁等物质进行了成功检测[18-23],但修饰电极的方法往往比较繁杂,不便于检测方法的普及。有文献[24-25]报道对裸玻碳电极进行活化处理也可以使其电化学性能提高。
本研究旨在采用不同的活化方式对玻碳电极进行处理,以期获得电信号响应强、稳定性好的活化电极,并运用活化后的玻碳电极对芦丁的电化学行为进行研究。探讨合适的实验条件,以建立一种测定芦丁含量的电化学方法,使其能成功用于苦荞茶中的芦丁含量的检测,并为苦荞茶产品的质量检测和开发利用提供重要的参考依据。
1 材料与方法
1.1 材料与试剂
苦荞茶(非造粒型苦荞茶,产地安徽) 芜湖四月茶侬茶业有限公司。
芦丁、槲皮素标准品 国药集团化学试剂有限公司;无水乙醇、磷酸、硼酸、醋酸、氢氧化钠、硫酸北京化工厂;实验所用试剂均为分析纯,水为二次蒸馏水。
1.2 仪器与设备
CHI660E电化学工作站 上海辰华仪器公司;KQ3200DB型数控超声波清洗器 昆山市超声仪器有限公司;数字式酸度计 北京赛多利斯仪器公司;Specord50Plus紫外-可见分光光度计 德国耶拿仪器公司。
1.3 方法
1.3.1 电解液的配制
使用无水乙醇为溶剂配制浓度为1×10-3mol/L的芦丁储备液,置于4 ℃冰箱保存。配制1 mol/L NaOH溶液、0.5 mol/L硫酸溶液及不同pH值的布列顿-罗宾逊(Britton-Robinson,B-R)缓冲液,待用。
1.3.2 玻碳电极的活化处理
先使用0.2~0.5 μm和0.02~0.05 μm规格的氧化铝粉依次对玻碳电极进行打磨抛光处理。电极表面抛光成镜面样光亮后,依次使用硝酸、乙醇和二次蒸馏水对电极超声清洗2 min,冲洗干净待用。随后分别用酸法循环伏安(cyclic voltammetry,CV)法处理、酸法恒电位极化处理、碱法CV法处理和碱法恒电位极化法处理4 种方法对玻碳电极进行活化[26]。
酸法CV法处理:将电极放置于含有0.5 mol/L硫酸溶液的电解池中,在-0.3~2.0 V的电位区间以0.1 V/s的速率进行循环扫描,直到电极的电化学响应曲线达到稳定。酸法恒电位处理:将电极放置于含有0.5 mol/L硫酸溶液的电解池中,在2.0 V电位条件下极化一定时间,随后在-1.0 V电位条件下极化1 min,最后在-0.5~0.8 V的区间内以0.1 V/s的速率扫描3 个循环,至电极的电化学响应曲线达到稳定。
碱法CV法处理:将电极放置于含有1 mol/L NaOH溶液的电解池中,在-0.5~1.2 V的电位区间以0.1 V/s的扫描速率进行循环扫描,直到电极的电化学响应曲线稳定。碱法恒电位极化处理:将电极放置于含有1 mol/L NaOH溶液的电解池中,在1.2 V电位条件下极化一定时间,随后在-0.5 V电位条件下极化1 min,最后在-0.5~0.8 V的区间内以0.1 V/s的扫描速率扫描3 个循环,至电极的电化学响应曲线达到稳定。
1.3.3 电化学测试
电化学测试均在三电极体系下完成,工作电极为活化玻碳电极,参比电极是Ag/AgCl(3 mol/L KCl)电极,辅助电极是铂丝电极,测试在普通电解池中进行。CV法测试和差分脉冲伏安(different pulse voltammetry,DPV)法测试均在常规电解池中进行。每次测试前溶液均通氮除氧10 min,测试过程中在溶液上方通氮保护,所有实验均在室温条件下进行。
CV法测量的参数设置:扫描电位区间0.2~0.8 V,扫描速率0.1 V/s。考察使用不同方式处理的活化玻碳电极对CV的影响后,选用最适合的活化玻碳电极进行后续测试。DPV法测量的参数设置:扫描电位区间0.2~0.8 V,电位增量0.004 V,振幅0.05 V,脉冲宽度0.05 s,脉冲幅度1 s。考察电解液pH值、富集时间、干扰物质对DPV的影响。
工作电极表面重复方法:每次测试后取出电极,先在0.1 mol/L NaOH溶液中以0.1 V/s的速率在0~0.8 V的范围内循环扫描3 圈,然后在B-R缓冲溶液中以0.1 V/s的速率在0~0.8 V的范围内循环扫描至稳定。
2 结果与分析
2.1 芦丁在不同活化方式的玻碳电极上的CV响应
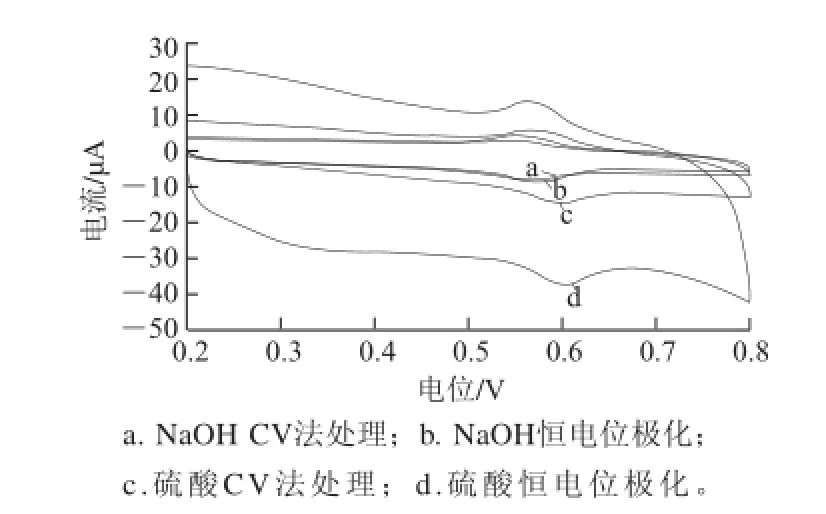
图 1 1×10-5mol/L芦丁在不同处理方法活化的玻碳电极上的CCVV表现(pH 2的B-R缓冲液体系中)Fig.1 CVs of 1 × 10-5mol/L rutin on different activated glassy carbon electrodes (In B-R buffer, pH 2)
分别用酸法CV法、酸法恒电位极化法、碱法CV法和碱法恒电位极化法处理对玻碳电极进行活化,不同方法活化后的电极在浓度为1×10-5mol/L的芦丁溶液(底液pH值为2的B-R缓冲液)中扫描所得的CV曲线如图1所示。经活化后电极表面电信号响应均有增强,使用2 种酸法活化的电极(曲线c和曲线d)电流比2 种碱法活化的电极(曲线a和曲线b)电流大,无论酸活化或者碱活化方式中恒电位极化活化方法均分别比CV活化方法的电流大。酸法活化的电极虽然响应电流值更高,但背景电流大,电极表面重复性不好。结合峰电流的大小,峰的稳定性等综合因素考虑,使用经1 mol/L NaOH溶液恒电位极化处理方法活化的玻碳电极进行后续测试。
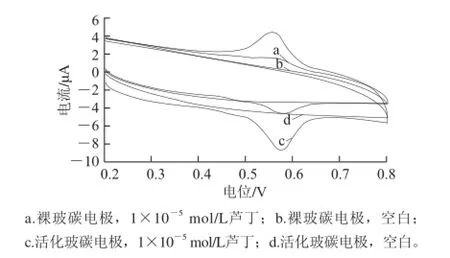
图 2 电极在芦丁溶液和空白溶液的CV对比(pH 2的B-R缓冲液体系中)Fig.2 CVs of bare and activated electrodes in different solutions (In B-R buffer, pH 2)
图2 为恒电位极化处理方法活化的电极与裸玻碳电极在空白溶液和芦丁溶液中的CV表现对比,在空白底液中裸玻碳电极和活化电极都没有响应,在芦丁溶液中,活化电极比裸玻碳电极的电流响应明显增强。由图2可看出,在pH值为2的B-R缓冲液中芦丁在活化电极上产生一对主要的氧化还原峰。氧化峰电位为575 mV,还原峰电位为554 mV。峰电位差为21 mV,氧化还原峰电流比为1.31 μA,可见在该体系中芦丁的氧化还原表现为准可逆。同时也可以推断在测试体系中芦丁的氧化还原过程是涉及2电子、2质子的准可逆反应,可推测氧化还原峰电流是由芦丁B环上的3’、4’位置的羟基反应所产生,如图3所示。
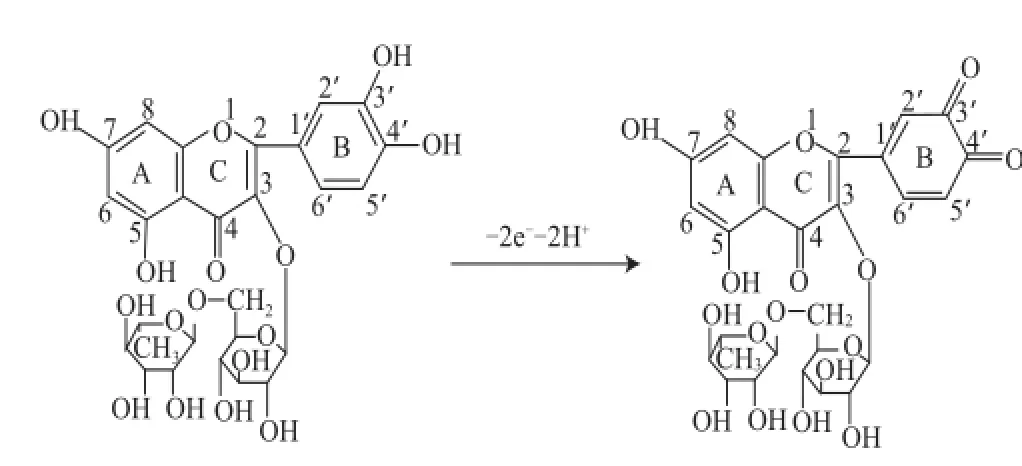
图 3 芦丁B环上羟基的氧化过程示意图Fig.3 Oxidation mechanism of hydroxyl groups on rutin B ring
2.2 扫描速率对CV的影响
由图4可知,氧化峰电流大小与扫描速率(0.02~0.1 V/s)呈良好的正相关线性关系I=-0.039 3v-0.339,R2=0.993 1,说明芦丁在活化电极表面主要受到吸附现象的控制。为进一步证实吸附现象存在,将在芦丁标准液中进行过CV扫描后的电极取出,用二次蒸馏水冲洗表面之后直接置于空白B-R缓冲液中进行同样扫描,出现了氧化峰和还原峰,但峰电流变小,说明电极对芦丁存在吸附作用。
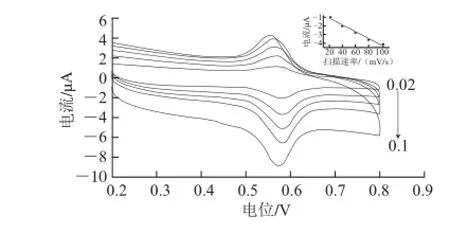
图 4 10-5mol/L 芦丁在不同扫描速率条件下CV表现Fig.4 CVs of 1 × 10-5mol/Lrutin at different scanning speeds
2.3 缓冲液pH值对DPV测量芦丁的影响
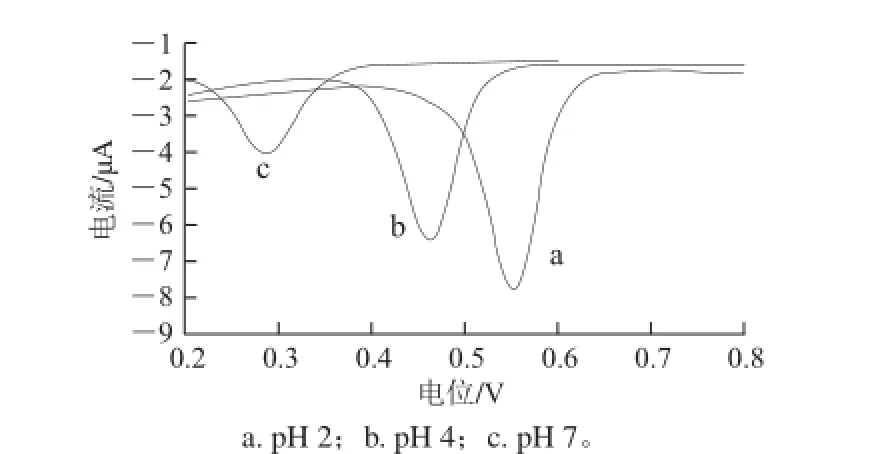
图 5 1×10-5 mol/L芦丁在不同pH值的B-R缓冲液中的CV表现Fig.5 CVs of 1 × 10-5mol/L rutin in B-R buffer solutions with different pH values
使用经1 mol/L NaOH溶液恒电位极化处理方法活化的玻碳电极对浓度为1×10-5mol/L的芦丁在不同pH值的B-R缓冲溶液中进行DPV法测试。由图5可知,在B-R缓冲液中芦丁的电化学氧化峰的峰形较好,随pH值的增加,氧化峰电位负移,峰电流减小。峰电位大小与pH值大小呈负相关的线性关系,相关公式为Epa=-0.053 2pH+0.700 1(r=0.999 7)。方程的斜率与能斯特方程的等质子电子传递理论值59接近,表明芦丁在实验体系中的氧化反应为等电子等质子参与。综合考虑在后续实验中选择pH值为2的B-R缓冲液作为底液。
老何:“哈哈哈!我败给你了,我觉得你应该去当谐星,不应该来当编辑。难怪你平时说话如此风趣,是我们编辑部的‘岳云鹏’,原来是童子功,恕在下有眼不识泰山,承让承让!”
2.4 富集时间对DPV测量的影响
考察开路情况下富集时间对使用DPV法测得的氧化峰电流的影响,发现随着富集时间延长,峰电流增强,这可能与电极和被测物质存在吸附作用有关。富集时间越久,电极表面聚集的芦丁含量越高,但富集到一定程度,峰电流不再增加。可能是因为电极表面吸附物质达到饱和。综合测试时间以及稳定性等因素考虑,实验中采用的富集时间为60 s。
2.5 干扰因素对DPV测量的影响
在实验体系中对1×10-5mol/L的芦丁溶液中添加一些常见的金属离子(如100 倍的K+、Ca2+、Na+、Mg2+、C1—等)和有机分子(如100 倍的葡萄糖等)考察其对芦丁峰电流的影响。实验结果表明:这些成分对峰电流的影响一般偏差不超过5%,另外作为同类的槲皮素若低于芦丁含量的20%,则不影响芦丁的氧化峰电流的检测。
2.6 稳定性与重复性
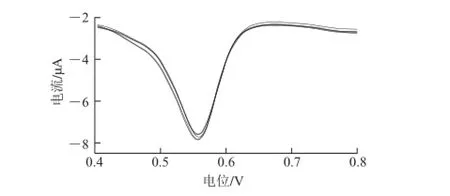
图 6 活化玻碳电极在1×10-5mol/L芦丁中连续测定6 次的DPV曲线Fig.6 DPVs of 1 × 10-5mol/L rutin on activated glassy carbon electrode (n = 6)
在实验条件下应用DPV法对浓度为1×10-5mol/L的芦丁溶液连续测定6 次,考察活化电极测量的重复性。结果如图6所示,测得相对标准偏差(relative standard deviations,RSD)为2.45%,证明该法重复性较好。测试后将电极于室温条件下保存在B-R空白溶液中,分别在1 周和2 周后再次测定,RSD均不超过5%,证明电极稳定性较好。
2.7 线性范围与检出限
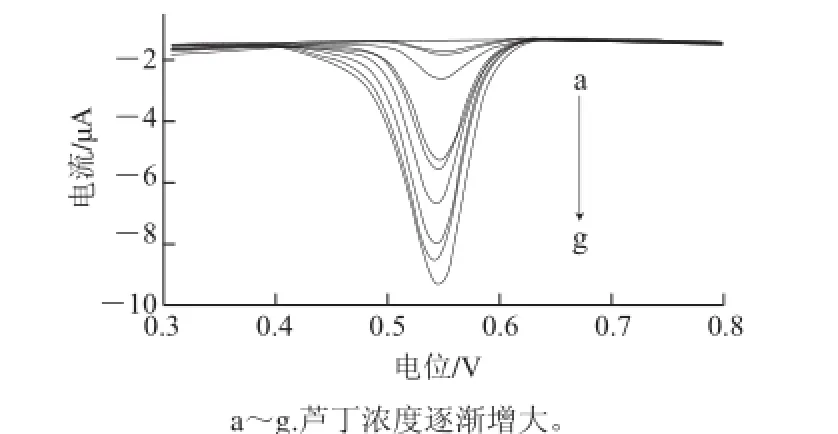
图 7 活化电极在不同浓度芦丁中的DPPVV图Fig.7 DPVs of activated glassy carbon electrode at different concentrations of rutin
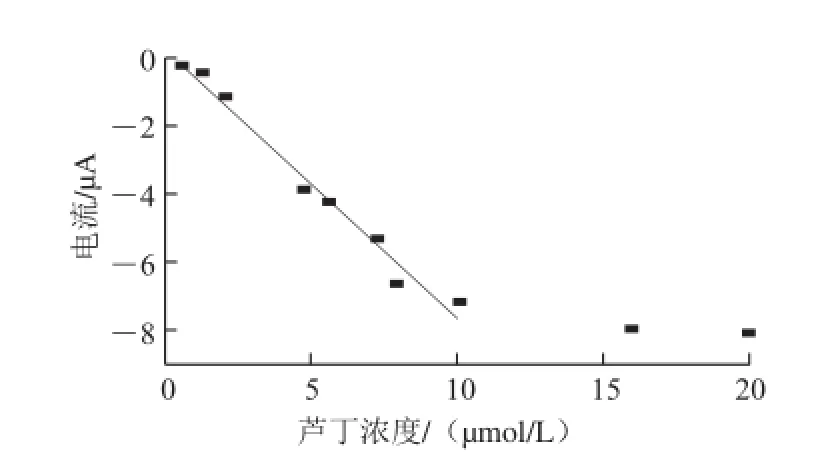
图 8 芦丁氧化峰电流和浓度的关系曲线Fig.8 Relationship curve of rutin oxidation peak current and concentration
测定一系列不同浓度的芦丁标准液的DPV曲线如图7所示,氧化峰电流随着芦丁浓度的增大而增加。图8为在实验体系中,在活化玻碳电极上芦丁的浓度(0.6~20 μmol/L)与氧化峰电流的关系曲线,峰电流的大小在0.6~10 μmol/L范围内与芦丁的浓度呈良好的线性关系,线性回归方程为Ipa=-0.794c+0.296(Ipa为氧化峰电流/μA;c为芦丁浓度/(μmol/L),r=0.985),最低检出限为0.08 μmol/L(RSN=3)。比较各种测定芦丁含量的方法的线性范围和检出限,结果列入表1,可见应用本方法检测芦丁含量具有线性范围宽,检出限较低的优点。

表 1 测定芦丁的不同方法比较Table 1 Comparison of different methods used to determine rutin
2.8 苦荞茶中芦丁含量的测定结果
取市售的四月茶侬牌苦荞茶(标称芦丁含量为每100 g中苦荞茶中含有2 g),研磨成粉,过20 目筛。准确称量1 g于容器中,加入20 g无水乙醇超声提取45 min,抽滤后用无水乙醇将提取液于容量瓶中定容至50 mL,摇匀,成待测样品溶液。取适量待测样品稀释,进行紫外测试,样品特征吸收带与芦丁标准品溶液基本一致,证明待测样品中的黄酮类化合物主要成分为芦丁。取0.5 mL待测样品溶液于100 mL容量瓶中,使用B-R缓冲液定容稀释,此刻理论浓度为3.28 μmol/L。按照1.3.3节进行DPV法测试,结果表明该苦荞茶中芦丁测定含量与标明含量较吻合,测定结果与标示值较符合。另取适量上述已知含量的芦丁样品溶液,加入一定量的芦丁标准溶液进行加标回收实验(n=3),结果列入表2,回收率在98.3%~101.0%,表明此方法用于实际样品中芦丁含量的测定具有较高的准确性。

表 2 苦荞茶中芦丁含量的测定结果Table 2 Measurement results of rutin in buckwheat teaTable 2 Measurement results of rutin in buckwheat tea
3 结 论
采用不同方法活化的玻碳电极对芦丁的电化学行为进行测定,结果发现经1 mol/L NaOH溶液恒电位极化处理方法活化的玻碳电极作为工作电极对芦丁的电化学行为响应较好,研究发现芦丁的氧化还原过程是涉及2电子和2质子的准可逆反应,并且观察到芦丁在工作电极表面存在吸附现象。同时对缓冲液的pH值、富集时间以及干扰因素等对芦丁的电化学行为的影响进行了探讨,使用DPV法建立了测量芦丁含量的工作曲线。在pH值为2的B-R缓冲液中,当富集时间60 s时,在0.6~10 μmol/L范围内峰电流的大小与芦丁的浓度呈良好的线性关系,线性回归方程为Ipa=-0.794c+0.296(Ipa为氧化峰电流/μA;c为芦丁浓度/(μmol/L),r=0.985),最低检出限为0.08 μmol/L(RSN=3),运用此法成功测定了苦荞茶中的芦丁含量。该方法测定芦丁含量具有灵敏度高,操作方便的优点,且电极处理简单、稳定性和重复性好,具有一定的应用价值。
[1] 张强, 李艳琴. 苦荞功能成分及其开发利用[J]. 山西师范大学学报, 2009, 23(4): 85-87.
[2] 臧志和, 曹丽萍, 钟铃. 芦丁药理作用及制剂的研究进展[J]. 医药导报, 2007, 26(7): 758-760.
[3] 吴涛, 杨建雄, 李宝茹, 等. 芦丁抗疲劳作用的实验研究[J]. 临床医学, 2013, 33(3): 90-92.
[4] 杨丹, 郝再彬, 胡淑田, 等. 光照对芦丁稳定性及抑菌活性的影响[J].应用与环境生物学报, 2011, 17(2): 223-226.
[5] 张琪, 刘慧灵, 朱瑞. 苦荞麦中总黄酮和芦丁的含量测定方法的研究[J]. 食品科学, 2003, 24(7): 113-116.
[6] 黄艳菲, 彭镰心, 丁玲. 荞麦和商品苦荞茶中芦丁含量的测定[J]. 现代食品科技, 2012, 28(9): 1219-1222.
[7] VACHIRAPATAMA N, CHAMNANKID B, KACHONPADUNGKITTI Y. Determination of rutin in buckwheat tea and Fagopyrum tataricum seeds by high performance liquid chromatography and capillary electrophoresis[J]. Journal of Food and Drug Analysis, 2011, 19(4): 463-469.
[8] 黄兴富, 黎其万, 刘宏程, 等. 高效液相色谱法同时测定苦荞中芦丁、槲皮素和山奈酚的含量[J]. 中成药, 2011, 33(2): 345-347.
[9] ZU Yuangang, LI Chunying, FU Yujie, et al. Simultaneous determination of catechin, rutin, quercetin, kaempferol and isorhamnetin in the extract of sea buckthorn (Hippophae rhamnoides L.) leaves by RP-HPLC with DAD[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(3): 714-719.
[10] 王艳, 相秉仁. 小波变换分光光度法同时测定复方芦丁片中芦丁和维生素C[J]. 理化检验: 化学分册, 2007, 43(10): 863-865.
[11] 尚永辉, 李华, 孙家娟, 等. 偏最小二乘-分光光度法同时测定芦丁与槲皮素的方法研究[J]. 分析测试学报, 2011, 30(4): 457-460.
[12] 侯建霞, 汪云, 程宏英, 等. 毛细管电泳检测苦荞芽中的黄酮类化合物[J]. 食品与生物技术学报, 2007, 26(2): 13-15.
[13] 邓光辉, 王士伟, 王辉, 等. 毛细管电泳安培法测定田基黄中的芦丁与槲皮素[J]. 分析试验室, 2014, 33(4): 424-427.
[14] 陈丛瑾, 黄克瀛, 李姣娟, 等. 电化学分析方法在黄酮含量测定中的应用[J]. 分析仪器, 2007, 3(3): 56-59.
[15] KOROTKOVA E I, KARBAINOV Y A, SHEVCHUK A V. Study of antioxidant properties by voltammetry[J]. Journal of Electroanalytical Chemistry, 2002, 518: 56-60.
[16] 徐欣荣, 何建波, 程萍. 黄酮醇抗氧化剂构效关系的电化学研究[J].食品科学, 2010, 31(7): 6-9.
[17] 何建波, 徐红梅, 朱燕舞, 等. 电化学方法研究天然抗氧化剂[J]. 化学与生物工程, 2004, 22(5): 10-12.
[18] SANTOS D P, BERGAMINI M F. Preconcentration of rutin at a poly glutamic acid modified electrode and its determination by squarewave voltammetry[J]. Analytical Letters, 2007, 40(16/17/18): 3430-3442.
[19] YIN Huanshun, ZHOU Yunlei, CUI Lin, et al. Sensitive voltammetric determination of rutin in pharmaceuticals, huaman serum, and traditional Chinese medicines using a glassy carbon electrode coated with graphene nanosheets, chitosan, and a poly (amido amine) dendrimer[J]. Microchim Acta, 2011, 1173(1): 337-345.
[20] 赵永昕, 李莉, 王坤, 等. 石墨烯-壳聚糖修饰玻碳电极应用于环境水中五氯酚的测定[J]. 应用化学, 2012, 29(10): 1206-1210.
[21] 刘登友, 罗启枚, 王辉宪, 等. 基于碳纳米管修饰石墨电极测定槲皮素[J]. 化学传感器, 2010, 30(1): 60-64.
[22] 张亚, 杜芳艳, 严彪, 等. 芦丁在纳米金修饰玻碳电极上的电化学行为及其测定[J]. 分析试验室, 2012, 31(1): 68-69.
[23] BANKS C E, CROSSLEY A, SALTER C, et al. Carbon nanotubes contain metal impurities which are responsible for the“Electrocatalysis” seen at some nanotube-modified electrodes[J]. Angewandte Chemie International Edition, 2006, 45: 2533-2537.
[24] 高融, 张丽君, 张占恩. 电化学活化玻碳电极吸附伏安法测定维生素K[J]. 分析试验室, 2009, 28(3): 36-38.
[25] 车鑫, 廖钫, 谭宝玉, 等. 邻苯二酚在活化玻碳电极上的电化学行为[J].化学研究与应用, 2009, 21(4): 537-541.
[26] 胡坤. 电化学活化玻碳电极及其在电分析中的应用[D]. 厦门: 厦门大学, 2007: 5-24.
Electrochemical Method for the Determination of Rutin in Buckwheat Tea
HU Haiyang, CHEN Hongyan*
(School of Science, Beijing Forestry University, Beijing 100083, China)
The electrochemical behavior of rutin at activated electrode was examined using cyclic voltammetry (CV) and differential pulse voltammetry (DPV). Glassy carbon electrode (GCE) was treated with CV and potentiostatic polarization by 0.5 mol/L H2SO4solution and 1 mol/L NaOH solution, respectively. Comparing the four types of activated glassy carbon electrodes, it was found that potentiostatic polarization with 1 mol/L NaOH solution was a better method for GCE activation. Then, the electrochemical behavior of rutin was investigated. It turned out that the electrochemical response of rutin at activated GCE in the B-R buffer solution (pH 2) was sensitive, and exhibited a pair of main quasi reversible redox peaks, involving two electrons and two protons. The peak current of DPV for rutin was increased at higher concentration, and good linearity was observed over the range of 0.6–10 μmol/L with a limit of detection of 0.08 μmol/L. This method was simple and sensitive with good repeatability and was successfully applied to the determination of rutin content in buckwheat tea.
rutin; activated glassy carbon electrode; electrochemical; differential pulse voltammetry; buckwheat tea
O657.1
A
1002-6630(2015)08-0115-05
10.7506/spkx1002-6630-201508020
2014-08-21
国家自然科学基金面上项目(31070490)
胡海洋(1990—),男,硕士研究生,研究方向为生物大分子结构与性能。E-mail:hhy199006@163.com
*通信作者:陈红艳(1971—),女,副教授,博士,研究方向为物质结构和性能。E-mail:chybo1999@163.com
