转人工miRNA抗玉米粗缩病毒载体玉米的培育及其抗病能力
2015-12-29宣宁赵传志彭振英陈高边斐廉明政刘国霞王兴军毕玉平
宣宁,赵传志,彭振英,陈高,边斐,廉明政,刘国霞,王兴军,毕玉平,2
转人工miRNA抗玉米粗缩病毒载体玉米的培育及其抗病能力
宣宁1,赵传志1,彭振英1,陈高1,边斐1,廉明政1,刘国霞1,王兴军1,毕玉平1,2
1 山东省农业科学院生物技术研究中心,山东 济南 250100 2 山东省农业科学院研究生教育中心,山东 济南 250100

宣宁, 赵传志, 彭振英, 等. 转人工miRNA抗玉米粗缩病毒载体玉米的培育及其抗病能力. 生物工程学报, 2015, 31(9): 1375–1386.Xuan N, Zhao CZ, Peng ZY, et al.Development of transgenic maize with anti-rough dwarf virus artificial miRNA vector and their disease resistance. Chin J Biotech, 2015, 31(9): 1375–1386.
玉米是重要的粮食作物,水稻黑条矮缩病毒 (RBSDV) 是玉米粗缩病的病原,由其引起的玉米粗缩病给玉米生产造成重大损失。利用人工miRNA构建抗病毒植物的技术已经在多种植物中被证明有效,但是在玉米中的尝试未见报道。实验根据玉米zea-miR159a的前体序列和RBSDV基因组中编码功能蛋白的基因和基因沉默抑制子的序列信息设计引物,构建了用于沉默RBSDV编码基因和基因沉默抑制子的amiRNA (Artificial miRNA) 基因。构建pCAMBIA3301-121-amiRNA植物表达载体,利用农杆菌介导法转化玉米自交系综31 (Z31)。对转基因玉米进行分子检测,选择miRNA表达量高的纯合体株系进行自然发病实验,按0−4的分级标准调查玉米粗缩病的严重度。结果表明,转抗粗缩病毒人工miRNA载体玉米纯合体株系的抗病表现好于野生型玉米,其中针对基因组6的S6-miR159转基因玉米抗病情况较好。研究表明利用人工miRNA技术构建抗病毒病玉米新品种是可行的。
amiRNA,玉米粗缩病毒,转基因玉米
玉米是重要的粮食作物,是食品和饲料加工的重要原料。玉米病毒病害的发生和流行严重危害玉米生产,特别是玉米粗缩病,给玉米生产造成了很大的损失。
玉米粗缩病是由玉米粗缩病毒 (Maize rough dwarf virus,MRDV) 引起的,于1954年传入我国[1]。研究证实,MRDV与引起水稻黑条矮缩病的病原-水稻黑条矮缩病毒 (Rice black-streaked dwarf virus,RBSDV) 是同一种病毒[2-4],该病毒除了侵染玉米和水稻,还能够侵染高粱、大麦、小麦等其他禾本科粮食作物和杂草。RBSDV基因组由10条双链RNA组成,按其在聚丙烯酰胺上迁移距离由小到大的顺序依次命名为:S1–S10[5]。其中,RBSDV的S1–S6分别编码病毒的一个重要蛋白,其中S1可能编码RNA依赖的RNA聚合酶;S2长约3 813 nt,编码一个有1 226个氨基酸组成的蛋白,推测可能是核心结构蛋白;S6长2 645 nt,虽然功能未知,但利用计算机软件对其二级结构的预测和数据库比较分析表明,其编码蛋白存在高度保守的亲水性结构域及多个跨膜区域,可能具有结合RNA及ATPase活性,表明RBSDV的S6基因可能具有编码植物基因沉默抑制子的功能;S8全序列约为1 936 bp,只含有1个ORF,编码蛋白的分子量约为68 kDa,可能是病毒的核心衣壳蛋白[6-7]。
MicroRNA (miRNA) 是真核生物中广泛存在的一类具有调节功能的小分子RNA,这些小RNA能够识别特定的靶mRNA,通过降解或抑制翻译负调控靶基因的表达。人工miRNA (Artifical miRNA,amiRNA) 技术是利用内源miRNA前体骨架 (Pre-miRNA),通过替换pre-miRNA序列中的成熟片段 (miRNA/miRNA*),产生具有新功能的miRNA[8]。利用MicroRNA的方法构建抗病毒植物已经被证明是有效的,其在抗病育种方面的潜力逐渐被人们认识。Schwab等利用拟南芥pre-miRNA172和pre-miRNA319作骨架,将miRNA/miRNA*区替换成与目标mRNA互补的片段,形成了amiRNA,在拟南芥中超表达后引起表型的明显改变[9],证明amiRNA可以有效沉默单个和多个靶基因;Warthmann等利用水稻osa-MIR528作骨架构建了人工miRNA,成功对水稻靶基因高效干涉[10]。Niu等通过修饰拟南芥miR159的前体获得了能够分别针对P69和HC-Pro的amiR- P69159和amiR-HC-Pro159,表达amiR-P69159和amiR-HC-Pro159的转基因拟南芥能够分别特异抵抗TYMV和TuMV病毒感染[11]。Qu等设计了针对黄瓜花叶病毒 (CMV) 的沉默抑制子2b的amiRNA并在烟草中表达,获得抗病毒的转基因烟草植株,并且转基因烟草的抗性水平和miRNA的表达水平成正相关[12]。这些结果均表明amiRNA 技术在植物中是可以广泛应用的。
本文基于玉米粗缩病病毒序列,选择其关键蛋白和基因沉默抑制子的保守序列构建amiRNA载体,转化玉米优良自交系,分析转基因植物后代的amiRNA表达水平及自然发病情况,推测利用amiRNA构建抗病毒病玉米新品种的可行性。
1 材料与方法
1.1 amiRNA载体的构建
选择在玉米里表达量较高的miR159的pre-miRNA作为骨架,在WMD3 (Web MicroRNA Designer,http://wmd31weigelworld1org/cgi2bin/ webapp1cgi) 系统中设计amiRNA的成熟体序列 (表1)。使用WMD3的“Designer”工具,首先输入RBSDV的基因组序列,找出能够沉默RBSDV的候选amiRNA成熟体序列,再选择玉米的基因组数据库,输入候选amiRNA成熟体序列,在线提交,通过和玉米基因组数据库比对,确保amiRNA成熟体不会沉默玉米的內源基因,并根据amiRNA 的相关参数(如m值等) 选择amiRNA。设计正反向PCR引物并在引物端分别添加Ⅰ和HⅠ酶切位点 (表2),通过PCR,得到带有酶切位点的特异miRNA序列,通过酶切连接装载到植物表达载体pCAMBIA3301-121上,成为amiRNA表达载体。
1.2 农杆菌介导的遗传转化
将构建好的amiRNA表达载体转入农杆菌菌株EHA105。在玉米自交系Z31自交授粉10−12 d后,剥取玉米幼胚,以农杆菌介导的方法进行转化。23 ℃共培养3 d,转入28 ℃培养室恢复培养。恢复培养后,第1轮采用5 mg/L终浓度的除草剂PPT进行筛选,以后3轮以终浓度为10 mg/L的PPT进行筛选。每2周为1轮筛选,前后共筛选4轮。将筛选获得的抗性愈伤组织转入诱导胚状体的培养基上进行诱导,3周后可以出现胚状体。再转入分化培养基上进行分化,培养条件为28 ℃,每日3 000 Lx光强,光照16 h,很快就会有再生小苗出现。再生的小植株长到3片叶时,可将幼苗移植到玻璃瓶中,并在室内培养。待小苗长出新叶及根后,将幼苗从玻璃瓶中取出,自来水冲净培养基,移栽于混有营养土和蛭石 (1∶3) 的小花盆中。当玉米又长出2−3片新叶时,可将其移入温室中进行正常生长。

表1 AmiRNA载体功能序列
Sense sequences were expressed in italics underlined, antisense sequences were expressed in italics underlined double.

表2 AmiRNA引物序列
The sequences in underlined means restriction enzyme sites.
1.3 PCR检测
幼苗取叶片用CTAB提取法提取DNA,miRNA载体质粒和野生型玉米分别作为阳性和阴性对照用Bar primer (表3) 进行PCR扩增鉴定。PCR检测结果在1%琼脂糖凝胶上观察。

表3 引物序列
1.4 Basta涂抹检测
将Basta原药 (Phosphinothricin,PPT含量18%) 稀释为3‰溶液。用毛笔涂抹或喷洒在玉米叶片上,2−3 d后观察,出现黄褐色枯斑的植株表示对Basta敏感,仍保持原来绿色的为抗性株。
1.5 Real-time PCR检测
纯合体的苗子取样按照Trizol试剂 (Invitrogen,USA) 说明书的方法提取总RNA。总RNA (5 μg) 用RQI DNA酶 (Promega) 处理去除DNA残留。第一链cDNA用反转录试剂盒 (Promega) 合成。实时定量荧光PCR (RT-qPCR) 使用ABI 7300棱镜HT序列检测系统 (Applied biosystems) 进行实验。玉米α-Tubulin基因 (检索号AY103544.2) 作为内参 (Tubulin primer,表3) 来标准化模板cDNA。根据玉米内源miRNA159的茎环序列设计引物 (miRNA159 primer,表3)。每个PCR重复3次。PCR体系为20 μL,含有1×SYBR绿色荧光染料混合物 (TaKaRa)、200 nmol/L引物、1 μL 1∶10稀释的模板cDNA。PCR程序如下:预变性95 ℃ 5 min,40个循环,每个循环包括95 ℃ 5 s,60 ℃ 20 s,72 ℃ 31 s,熔解曲线95 ℃15 s,60 ℃15 s,95 ℃15 s。实验数据由ABI7300软件 (Applied biosystems) 分析。miRNA相对表达量用2-△△Ct方法[13]计算,野生型玉米中表达量作为1,误差线表示(=3)。
1.6 转基因植株的表型鉴定
每个amiRNA载体选择4个独立的amiRNA 表达量高的转基因玉米T2代纯合体株系进行粗缩病毒自然发病实验。每个单独的株系种植100株。实验在山东济南饮马泉实验基地边缘土地进行,转基因玉米田间种植在转基因隔离区进行,周围密集种植6行野生型玉米作为保护行。该试验地一年两熟,夏玉米和冬小麦轮作,试验田周围杂草丛生,保证了越冬和越夏的毒源。播期在5月中旬。株行距30 cm×60 cm。转基因玉米与野生型玉米隔行种植。田间水肥、中耕管理和病虫害防治同大田。玉米生长后期,按0−4级的如下分级标准[14]调查玉米粗缩病的严重度,挂牌标记调查株的病级。
玉米粗缩病严重度分级标准:0级:健株;1级:株高为健株株高的4/5左右,仅上部几个叶片叶背面有白色蜡泪状突起;2级:株高为健株株高的2/3左右,整株显症;3级:株高为健株株高的1/2左右,整株显症;4级:株高为健株株高的1/3以下,整株显症或提早枯死。
2 结果与分析
2.1 玉米粗缩病毒序列收集和关键基因鉴定
2010年收集山东省济南、济宁和德州的玉米粗缩病植株,提取病毒RNA,利用随机引物反转录成cDNA。根据NCBI中公布的RBSDV基因组的序列设计引物,扩增获得了这些地区RBSDV的S1、S2、S6和S8基因的序列,测序结果确认了引起这些地区玉米粗缩病的病原菌为RBSDV。将S1、S2、S6和S8的序列信息提交到在线软件WMD3,设计了能够沉默S1、S2、S6和S8基因的amiRNA成熟体序列及其星号序列。
根据玉米zea-miR159a的前体序列,我们设计了包含amiRNA成熟体序列的正向引物和包含人工miRNA成熟体星号序列的反向引物。通过PCR扩增获得了amiRNA前体序列。
2.2 转基因植株的获得与PCR检测
将amiRNA前体序列构建到植物表达载体中,并转入农杆菌EHA105,通过农杆菌介导方法转入玉米幼胚,经过共培养-恢复-4轮筛选-恢复-诱导-分化-生根-成苗等阶段后得到玉米拟转化株 (图1)。
T0代幼苗取叶片提DNA进行PCR检测,提取DNA后,通过Bar基因扩增确定是否有目的基因的插入。阳性植株是能扩增出与筛选基因Bar同样大小的条带 (370 bp),而未转化植株没有扩增出相应的片段。部分植株的PCR结果如图2所示。
每个载体我们转化了大约3 000−5 000个玉米幼胚,经过4 轮筛选S1收到了11个转基因株系,S2收到了10个转基因株系,S6收到了26个转基因株系,S8收到了15个转基因株系。
2.3 Basta涂抹检测
T1代转基因玉米长至5−7叶期时进行Basta涂抹检测,选择Basta抗性株与非抗性株 (图3)3∶1分离的株系繁殖T2代种子。
T2代转基因玉米长至5−7叶期时同样进行Basta涂抹检测,若同一株系的苗子全部对Basta有抗性,即保持原来绿色的即为纯合株系。选择纯合株系进行后续的分子检测和表型鉴定。

图1 农杆菌介导的玉米转化
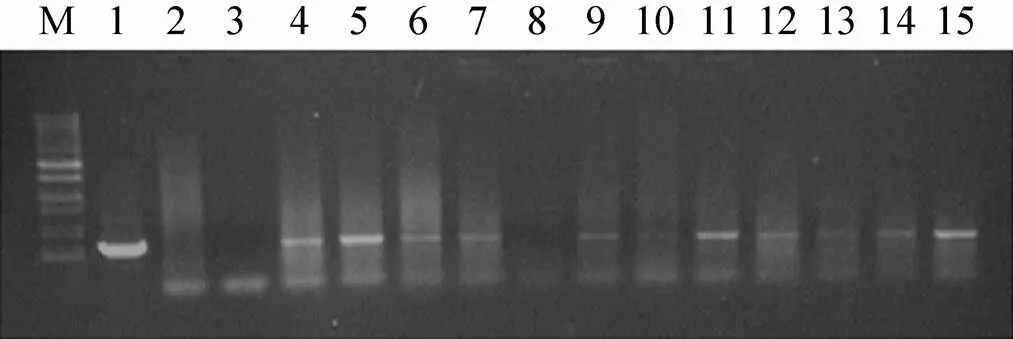
图2 T0代转基因苗PCR分子检测

图3 涂抹Basta表型示意图
2.4 转基因植株amiRNA表达量检测结果
Basta筛选鉴定纯合体的苗子混合取样提取RNA,反转录成cDNA,由于miRNA前体的表达模式与成熟miRNA的表达模式一致[20],根据构建载体使用的玉米内源miRNA159的茎环序列设计引物,用Real-time PCR的方法鉴定pre-miRNA表达量,借此反映成熟miRNA的表达量,结果表明转基因玉米中外源amiRNA有所表达,但表达程度不一致 (图4)。部分转基因玉米amiRNA表达量下降,可能由于转基因沉默现象所致。
2.5 转miRNA载体玉米的表型鉴定
玉米粗缩病发病规律为苗龄越小,发病越重。芽鞘期至2叶1心期感病多为绝产株。8叶期以后感病的植株病情显著减轻。11叶以后基本无症状,极少数显症株也均为1级轻病株。
根据山东省往年玉米粗缩病发病情况,选择5月14号播种,野生型玉米与人工miRNA载体转基因玉米隔行播种,7月下旬观察人工miRNA载体转基因玉米与野生型玉米生长情况,按照按0−4级的分级标准调查玉米粗缩病的严重度,挂牌标记调查株的病级。调查结果显示 (图5–6),野生型玉米无健株,100%发病,且4级重度感染株比例较高,占37.5%,转基因玉米抗病表现好于野生型玉米,几乎没有4级重度感染株。其中S6-miR159载体转基因玉米健株 (0级) 和轻微感病株 (1级) 比例达到41.5%,为4个载体转基因玉米中最高,抗病情况最好。转基因玉米植株也存在一定比例的2级和3级感病株,可能是转基因玉米单株之间存在miRNA表达量差异,miRNA表达量较少,干扰能力弱导致。
3 讨论
长期以来,玉米粗缩病的防治措施主要以农业防治,例如调整播期、清除杂草、及时拔除田间病株等措施,和关键期的药剂处理为主,然而,这些措施不但限制了农业生产,并且化学农药种类的增多与滥用又使食用农产品农药残留与环境污染问题日趋严重。由于缺少优良的抗病自交系,利用传统的杂交育种培养抗玉米粗缩病品种面临着巨大的挑战。相比传统杂交育种,利用基因工程技术手段培育抗病品种是彻底解决玉米粗缩病的根本途径。

图4 部分T2代转基因苗miRNA表达量检测
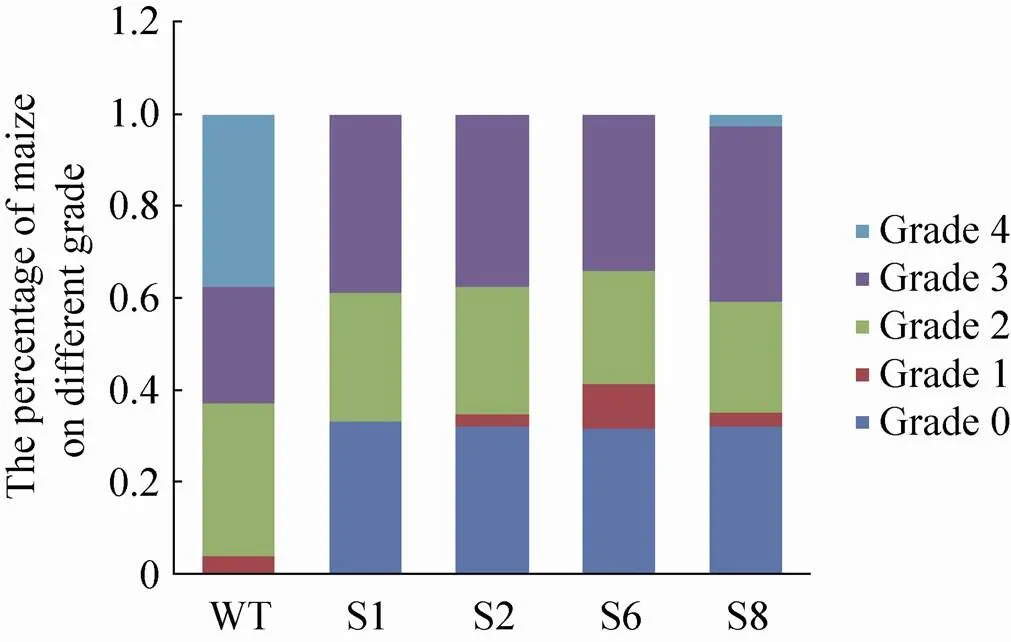
图5 转基因玉米抗粗缩病病株级别统计

图6 转基因玉米抗粗缩病表型鉴定
随着病毒基因组研究的深入,病毒基因工程成为了培养抗病品种的工具,目前利用基因工程改良作物抗病性的手段主要有3种:1) 将植物病毒的衣壳蛋白基因 (Coat protein,CP)、复制酶基因、核酶基因等构建到植物表达载体中,通过表达病毒衣壳蛋白、复制酶基因和核酶基因等而使转基因植株产生对多种病毒的抗性;2) 利用RNA干扰 (RNA interference,RNAi)的原理,设计病毒基因的反向重复序列,构建植物表达载体转化得到对病毒免疫的转基因植株[15];3) 通过修饰植物microRNA的前体,构建针对目标病毒的功能基因或者基因沉默抑制子基因的编码序列的人工miRNA表达载体,转化植物并获得具有抗病毒能力的转基因植株。目前,前2种策略研究比较深入,但这2种方法也各有其弊端:病毒RNA介导的转基因植物的抗病性和外源基因插入的拷贝数有密切的联系,转基因后代的安全性、抗病稳定性、抗性水平和遗传性也备受质疑;利用PTGS (RNAi) 介导的植物抗性具有抗病性强、抗性持久、生物安全性高等特点。但是许多病毒能够编码抑制蛋白,抑制宿主的RNA干扰机制,此外还会产生一系列序列信息不明确的siRNAs,这种不确定性大大降低了RNA沉默的精确度。另一方面,可能产生次级的siRNAs,造成非目标基因的沉默,使结果变得复杂[16-20]。这3种方法的原理都是通过病毒基因的沉默,达到植物的范畴。但是,人工miRNA方法的原理是miRNA介导的基因沉默途径,由于引入植物体的外源基因片段只有21 bp左右,引起植物内源基因沉默的几率大大降低,而且这21 bp的序列是已知的,通过全基因组比对可以对21 bp的成熟体序列作出较为准确的预测。第1种和第2种方法的原理都是RNAi介导的基因沉默途径,互补的双链RNA在植物体内被加工成一系列22 nt左右的RNA片段,这一系列22 nt的双链RNA片段和植物内源基因互补配对的几率增加,更容易造成植物内源基因的沉默。
本研究获得的人工miRNA抗粗缩病转基因玉米株系,对玉米粗缩病毒有显著抗性,其中S6-miR159载体抗性较显著。因此人工miRNA载体转化玉米,可以对粗缩病毒起到较好的干扰作用。
本文中人工miRNA载体的构建,采用玉米自身的miRNA前体作为骨架,和传统的通过引入外源基因改良作物品质有很大不同,一定程度上可以减少引入外源基因造成的不确定表型,也可以避免转基因的争议。相比PTGS (RNAi) 介导的基因沉默,人工miRNA在培养抗病毒植物上具有其独特的应用优势:1) RNAi介导的基因沉默依赖DCL4途径,而病毒编码的抑制蛋白 (基因沉默抑制子) 可以抑制这种沉默,能够抑制RNAi机制的发生。人工miRNA通过DCL1途径,可以避开一些病毒抑制蛋白的拮抗作用;2) RNAi介导的基因沉默在植物中转录长片段病毒基因组,这些病毒基因组序列可能与植物基因组重组,存在一些生物安全方面的隐患,而人工miRNA只引入21个碱基的外源序列,降低了此类风险的发生;3) 田间病毒多是混合侵染,病毒株系多、变异快,RNAi等方法只能有效抵御部分株系,无法培育一种持久广谱的抗病毒品种,amiRNA可以允许错配的存在,因而针对病毒保守区设计amiRNA,使之有效抑制大多数病毒株系,并且当病毒发生突变后仍然能够保持抗病毒能力;4) RNAi介导的基因沉默会产生一系列序列信息不明确的siRNAs,往往造成意外“脱靶”和非目标基因的沉默等现象,amiRNA只产生1条miRNA成熟体 (Mature miRNA),与靶基因的结合更加精确、可控和高效。
[1] Chen XZ, Yang MC, Liu XY, et al. Studies on the occurrence of maize rough dwarf virus disease and integrated program control. Acta Agric Boreali-Sin, 1986, 1(2): 90–97 (in Chinese).陈巽祯, 杨满昌, 刘信义, 等. 玉米粗缩病发病规律及综合防治研究. 华北农学报, 1986, 1(2): 90–97.
[2] Wang ZH. Molecular characterization and infection system of rice black streaked dwarf virus isolated from Maize[D]. Beijing: China Agriculture University, 2004 (in Chinese).王朝辉. 水稻黑条矮缩病毒玉米分离物的分子特性及其侵染体系[D]. 北京: 中国农业大学, 2004.
[3] Fang SG, Yu JL, Feng JD, et al. Identification of rice black streaked dwarf fijivirus in maize with rough dwarf disease in China. J Agr Biotechnol, 2000, 8(1): 121–125 (in Chinese). 方守国, 于嘉林, 冯继东, 等. 我国玉米粗缩病株上发现的水稻黑条矮缩病毒. 农业生物技术学报, 2000, 8(1): 121–125.
[4] Zhang HM, Lei JL, Chen JP, et al. A dwarf disease on rice, wheat and maize from Zhejiang and hebei is caused by rice balck streaked dwarf virus. Virol Sin, 2001, 16(3): 246–251 (in Chinese).张恒木, 雷娟利, 陈剑平, 等. 浙江和河北发生的一种水稻、小麦、玉米矮缩病是水稻黑条矮缩病毒引起的. 中国病毒学, 2001, 16(3): 246–251.
[5] Qin GZ, Wang F. Research progress of maize rough dwarf disease. Shandong Agri Sci, 2006(3): 17–21 (in Chinese). 秦国正, 王飞. 玉米粗缩病的研究进展. 山东农业科学, 2006(3): 17–21.
[6] Zhang HM. Molecular biology of rice blackstreaked dwarf fijivirus[D]. Hangzhou: Zhejiang University, 2001 (in Chinese). 张恒木. 水稻黑条矮缩病毒的分子生物学[D]. 杭州: 浙江大学, 2001.
[7] Zhang LD, Wang ZH, Wang XB, et al. The function identification of two kinds of plant virus encoded protein gene silencing repressor. Chin Sci Bull, 2005, 50(3): 219–224 (in Chinese). 张凌娣, 王朝辉, 王献兵, 等. 两种植物病毒编码蛋白的基因沉默抑制子功能鉴定. 科学通报, 2005, 50(3): 219–224.
[8] Alvarez JP, Pekker I, Goldshmidt A, et al. Endogenous and synthetic microRNAs stimulate simultaneous, efficient, and localized regulation of multiple targets in diverse species. Plant Cell, 2006, 18(5): 1134–1151.
[9] Schwab R, Ossowski S, Riester M, et al. Highly specific gene silencing by artificial microRNAs in. Plant Cell, 2006, 18(5): 1121–1133.
[10] Warthmann N, Chen H, Ossowski S, et al. Highly specific gene silencing by artificial miRNAs in rice. PLoS ONE, 2008, 3(3): e1829.
[11] Niu QW, Lin SS, Reyes JL, et al. Expression of artificial microRNAs in transgenicconfers virus resistance. Nat Biotechnol, 2006, 24(11): 1358–1359.
[12] Qu J, Ye J, Fang R. Artificial miRNA-mediated virus resistance in plants. J Virol, 2007, 81(12): 6690–6699.
[13] Schmittgen TD, Jiang J, Liu Q, et al. A high-throughput method to monitor the expression of microRNA precursors. Nucleic Acids Res, 2004, 32(4): e43.
[14] Miao HQ, Tian LZ, Lu YG, et al. Simple maize rough dwarf disease severity classification standard. Plant Protect, 2005, 31(6): 87–89 (in Chinese).苗洪芹, 田兰芝, 路银贵, 等. 简便易行的玉米粗缩病严重度分级标准. 植物保护, 2005, 31(6): 87–89.
[15] Huang BY, Ji WQ, Guo AG, et al. Post-transcriptional gene silencing (PTGS) and its application to crop genetic improvement. China Biotechnol, 2005, 5(5): 1–5 (in Chinese).黄冰艳, 吉万全, 郭蔼光, 等. 转录后基因沉默(PTGS) 及其在作物遗传改良中的应用. 中国生物工程杂志, 2005, 5(5): 1–5.
[16] Wang MB, Abbott DC, Waterhouse PM. A single copy of virus derived transgene encoding hairpin RNA give immunity to barley yellow dwarf virus. Mol Plant Pathol, 2000, 1(6): 347–356.
[17] Bai QR, Zhu JH, Liu XL, et al. Production of transgenic tobacco plants resistant to two viruses via RNA-mediated virus resistance. Acta Phytopathol Sin, 2005, 35(2): 148–154 (in Chinese). 白庆荣, 朱俊华, 刘晓玲, 等. 利用RNA介导的抗病性获得抗2种病毒的的转基因烟草. 植物病理学报, 2005, 35(2): 148–154.
[18] Liu XH, Zhang HW, Liu X, et al. Isolation of the capsid protein gene of maize dwarf mosaic virus and its transformation in maize. Chin J Biotech, 2005, 21(1): 144–148 (in Chinese). 刘小红, 张红伟, 刘昕, 等. MDMV CP基因的克隆及其转基因玉米的研究. 生物工程学报, 2005, 21(1): 144–148.
[19] Zhou XM, Jia WL, Zhao YY. Regeneration of transgenic maize plants with MDMV CP gene. Bull Bota Res, 2006, 26(4): 461–464 (in Chinese).周小梅, 贾炜珑, 赵云云. 转MDMV CP基因玉米植株的再生. 植物研究, 2006, 26(4): 461–464.
[20] Bai YF. SCMV-resistant transgenic maize obtained by using different strategies[D]. Beijing: China Agriculture University, 2004 (in Chinese).白云凤. 利用不同策略获得抗SCMV转基因玉米的研究[D]. 北京: 中国农业大学, 2004.
(本文责编 陈宏宇)
Development of transgenic maize with anti-rough dwarf virus artificial miRNA vector and their disease resistance
Ning Xuan1, Chuanzhi Zhao1, Zhenying Peng1, Gao Chen1, Fei Bian1, Mingzheng Lian1, Guoxia Liu1, Xingjun Wang1, and Yuping Bi1,2
1,,250100,,2,,250100,,
Maize is one of the most important food crops. Rice black-streaked dwarf virus is a maize rough dwarf disease pathogen. The occurrence and transmission of maize rough dwarf disease brings great damage to maize production. The technology of using artificial miRNA to build antiviral plant has been proven effective in a variety of plants. However, such trials in maize have not been reported. We designed primers based on the sequence of maize zea-miR159a precursor and sequence of function protein genes and silencing RBSDV coding genes in RBSDV genome. We constructed amiRNA (artificial miRNA) gene for silencing RBSDV coding gene and gene silencing suppressor. We constructed pCAMBIA3301-121-amiRNA plant expression vector for transforming maize inbred lines Z31 by using agrobacterium mediated method. After molecular analysis of transgenic maize, homozygous lines with high miRNA expression were selected by molecular detection for a subsequent natural infection experiment. We studied the severity of maize rough dwarf disease according to a grading standard (grade 0 to 4). The experiment results showed that the disease resistance of transgenic homozygous maize with the anti-rough dwarf virus amiRNA vector was better than that of wild type. Among the transgenic maize, S6-miR159 transgenic maize had high disease resistance. It is feasible to create new maize variety by the use of artificial miRNA.
amiRNA, maize rough dwarf disease, transgenic maize
10.13345/j.cjb.140637
December 24, 2014; Accepted:May 6, 2015
International Science & Technology Cooperation Program of China (No. 2012DFA30450), Foundation for Young Excellent Scientists in Shandong Province (No. BS2012SW019).
Yuping Bi. Tel: +86-531-83178227; E-mail: yupingbi@vip.sina.com
国家国际科技合作专项项目(No. 2012DFA30450),山东省优秀中青年科学家科研奖励基金(No. BS2012SW019) 资助。
2015-06-26
http://www.cnki.net/kcms/detail/11.1998.Q.20150626.1512.002.html
