辣椒素通过调节PLC-γ1信号通路对胆管癌细胞功能的影响
2015-12-29江恺
辣椒素通过调节PLC-γ1信号通路对胆管癌细胞功能的影响
江恺
(浙江省人民医院普外科,浙江杭州310014)
摘要〔〕目的探讨辣椒素(CAP)对人胆管癌(CCA)细胞系RBE增殖及凋亡的影响。方法体外培养的RBE细胞采用0、50、100、150、200 μmol/L的CAP及200 μmol/L的CAP处理0、24、48、72 h,用MTT方法和流式细胞仪检测RBE细胞增殖和凋亡能力的变化,采用Western印迹方法检测RBE细胞中磷脂酶C(PLC)-γ1信号通路的磷酸化活化情况。采用PLC-γ1信号通路抑制剂U71322阻断RBE细胞中PLC-γ1信号通路后,再以CAP处理RBE细胞,MTT方法和流式细胞仪检测RBE细胞增殖和凋亡能力的变化情况。结果与0 μmol/L CAP处理组相比,50、100、150、200 μmol/L的CAP可显著抑制RBE细胞的增殖能力(P<0.01),并增加RBE细胞的凋亡水平(P<0.01),且这种作用具有剂量依赖性。Western印迹结果显示,CAP显著活化RBE细胞中的PLC-γ1信号通路,且随着CAP处理浓度的升高,PLC-γ1信号通路活化水平逐渐升高。U71322阻断RBE细胞中的PLC-γ1信号通路后,CAP抑制RBE细胞的增殖能力显著降低(P<0.01)。结论通过活化PLC-γ1信号通路,CAP可抑制RBE细胞的增殖能力,并促进RBE细胞凋亡。
关键词〔〕辣椒素;磷脂酶C-P1信号通路;胆管癌
中图分类号〔〕R73〔
第一作者:江恺(1986-),男,硕士,住院医师,主要从事肝胆胰外科疾病研究。
胆管癌(CCA)具有恶性程度高、预后差等特点,死亡原因多为肿瘤复发或转移〔1〕。已知CCA的危险因素包括原发性硬化性胆管炎(PSC)、肝硬化、慢性乙型和丙型肝炎病毒感染、糖尿病、肥胖、吸烟和饮酒等〔2,3〕。CCA通常在发现时已处于癌症的晚期,仅能采用光动力治疗(PDT)、全身化疗和(或)放射治疗,即便如此患者的治愈率却未得到明显提高。辣椒素(CAP)是从红辣椒的果实中萃取物获得的红辣椒活性成分,不仅能减少炎症及疼痛,还对多种胃肠道肿瘤细胞具有抗增殖的作用〔4〕。然而,CAP在肿瘤形成中的作用目前还存在很大争议;也有文献报道,CAP具有促进癌细胞增殖生长的作用〔5〕。本研究通过体外实验观察CAP对CCA肿瘤细胞系增殖和凋亡的影响。
1材料与方法
1.1细胞培养与处理人CCA细胞系RBE用含10%胎牛血清(BSA)的RPMI-1640培养基培养于37℃、5%CO2的培养箱中。细胞长至80%融合进行传代培养,至细胞进入对数生长期开始功能实验。活化实验中采用0、50、100、150、200 μmol/L的CAP及200 μmol/L的CAP处理0、24、48、72 h。
1.2细胞总蛋白提取上述CAP处理细胞以冰磷酸盐缓冲液(PBS)洗涤2次,400 r/min离心,5 min;于细胞沉淀中加入蛋白酶磷酸酶抑制剂和适量的CytoBuster 蛋白提取试剂,高速涡旋细胞裂解混合物25 s,室温放置15 min;4℃,12 000 r/min离心15 min;吸取上清部分即细胞总蛋白,除留部分样品检测蛋白浓度外,其余分装10 μl/管,-80℃冻存。
1.3二喹啉甲酸(BCA)法测定蛋白浓度按试剂盒说明书进行标准品BSA稀释;按体积比50∶1混合BCA 试剂盒中的试剂A和试剂B,获取工作液;ELISA板中每孔加入200 μl工作液,随后加入25 μl倍比稀释的标准品或待测样品,每种样品设置3复孔。37℃孵育30 min;振荡器短暂混匀后在波长562 nm处测定OD值;根据标准品的光密度值和浓度梯度绘制标准曲线,根据标准曲线及待测样品的OD值推算各蛋白样品浓度。
1.4Western印迹等量的提取蛋白经5%浓缩胶和8%的分离胶分离后,半干转印至硝酸纤维素膜上,以含5% BSA的Tris盐酸缓冲液(TBST)室温封闭2 h,加入一抗4℃过夜孵育。第二天用0.1% TBST洗膜3次,每次5 min,加入相应的辣根过氧化物酸(HRP)标记的二抗,室温孵育1 h。0.1% TBST洗膜3次,硝酸纤维素膜以Supersignal West Femto/Pico HRP敏感化学发光底物对条带进行显色。β-actin作为内参对照。所有实验至少重复3次。
1.5噻唑蓝(MTT)增殖检测上述CAP处理的细胞接种于96孔培养板中,每孔中加入20 μl的MTT溶液,作用4 h后吸出上清,加入150 μl的DMSO溶液,低速振荡10 min后,波长490 nm处测定OD值。阻断磷脂酶C(PLC)-γ1信号通路实验中,在加入完全培养基及CAP前,先以U73122(5 μmol/L)预处理细胞1 h。细胞增殖率=(实验孔平均值/对照孔平均值)×100%。
1.6凋亡率检测收集上述CAP处理的细胞,1 000 r/min离心,5 min,1% BSA PBS洗涤1次。用100 μl Binding缓冲液将细胞重悬,加入2 μl Annexin V染料和0.1 μl碘化丙啶(PI)染料,避光15 min,流式细胞仪检测。阻断PLC-γ1信号通路实验中,在加入完全培养基及CAP前,先以U73122(5 μmol/L)预处理细胞1 h。
1.7统计学分析应用SPSS15.0软件进行t检验。
2结果
2.1CAP对RBE细胞增殖和凋亡能力的影响CAP可显著抑制RBE细胞的增殖能力,并促进RBE细胞的凋亡;随着CAP浓度的升高和处理时间的延长,RBE细胞的增殖能力逐渐降低(P<0.01),而凋亡水平则逐渐升高(P<0.01。见表1。
2.2CAP对RBE细胞中PLC-γ1信号通路活化的影响随着CAP浓度的升高和处理时间的延长,RBE细胞中PLC-γ1信号通路活化水平逐渐升高。见图1。
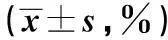
表1 CAP对RBE细胞增殖和凋亡能力的影响
与前一组比较:1)P<0.01

A:不同浓度CAP处理RBE细胞后;B:200 μmol/L CAP处理RBE细胞不同时间 图1 Western印迹检测CAP对RBE细胞中 PLC-γ1蛋白磷酸化(P-PLC-γ1)水平的影响
2.3U73122可阻断RBE细胞中PLC-γ1信号通路活化以U73122(5 μmol/L)预处理细胞1 h,可显著阻断RBE细胞中PLC-γ1信号通路的活化。见图2。
2.4PLC-γ1信号通路在CAP调控RBE细胞增殖和凋亡中的作用与CAP处理组相比,阻断RBE细胞中PLC-γ1信号通路后,RBE细胞的增殖能力显著升高(P<0.01),凋亡水平则显著降低(P<0.01)。见表2。
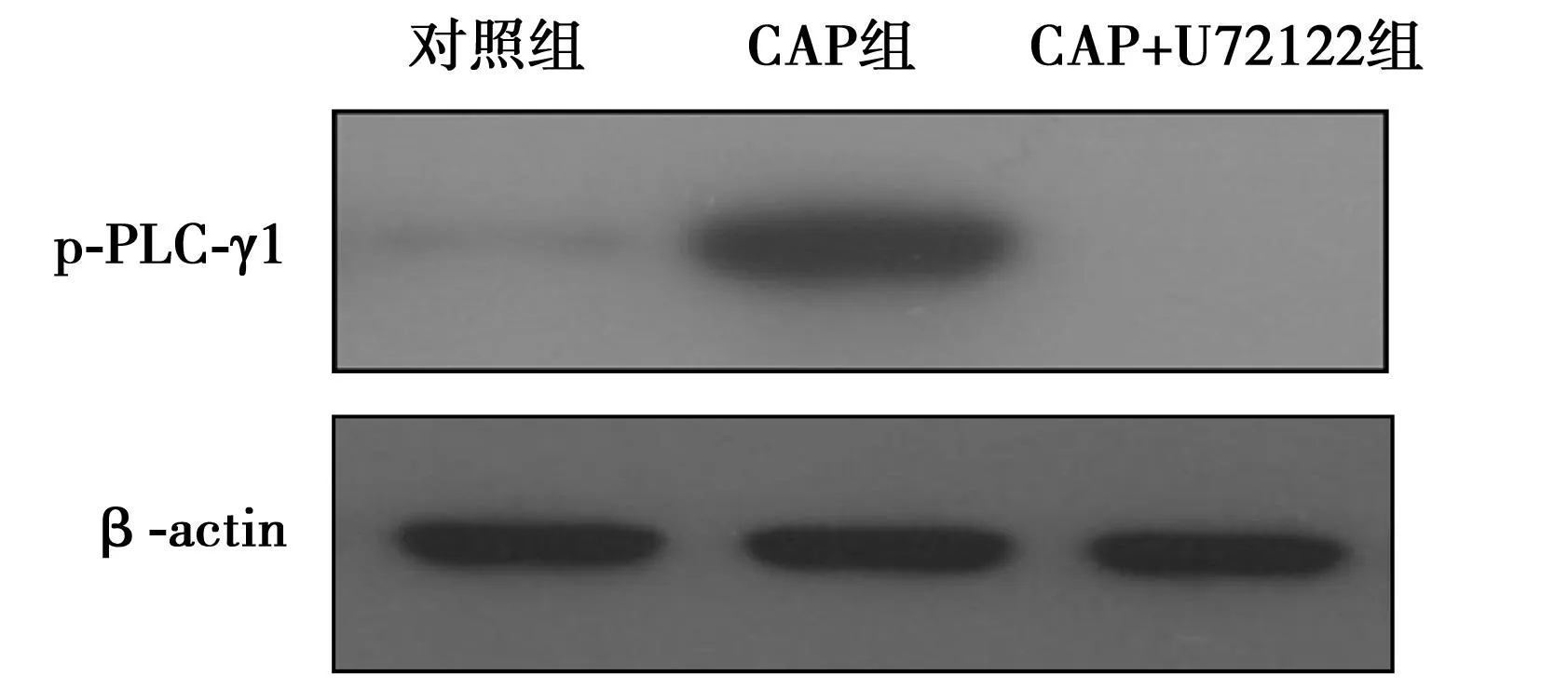
图2 PLC-γ1信号通路阻断效果检测

组别增殖率凋亡率对照组93.56±93.564.94±1.99CAP组14.56±14.561)40.45±7.461)CAP+U73122组92.45±18.241)5.34±2.011)
与前一组比较:1)P<0.01
3讨论
本研究结果显示,CAP可显著抑制人CCA细胞系RBE的增殖能力,并促进RBE细胞凋亡。与文献〔6,7〕报道的CAP对多种胃肠道肿瘤细胞具有抗增殖的作用,以及CAP可抑制宫颈癌Hela细胞的增殖能力相一致。然而,也有文献〔8〕报道,CAP具有促进癌细胞增殖生长的作用。这些文献报道结果的不一致可能是因为体外实验条件的不同,已知胰岛素在低浓度时具有存进肿瘤细胞增殖的作用,而高浓度时可抑制肿瘤细胞增殖。因此,不同实验中采用的CAP浓度不同可能会导致结果的不同。此外,也可能是不同的肿瘤细胞对CAP的反应性不同所致。已知CAP可通过调控细胞内的Ca2+流动而对细胞的增殖和凋亡发挥调控作用〔9〕。PLC-γ1信号通路在调控细胞内的Ca2+流动中具有重要的作用。激活的PLC-γ1可通过分解磷脂酰肌醇 4,5-二磷酸(PIP2)而产生甘油二酯(DAG)和 1,4,5-三磷酸肌醇(IP3),IP3与细胞内钙库中的IP3受体结合即可引起细胞内的Ca2+流动〔10〕。本文结果显示,在阻断PLC-γ1信号通路后,CAP抑制RBE细胞的增殖能力以及促进RBE细胞的凋亡能力均被显著阻断。
综述所述,本研究结果提示CAP可通过激活RBE细胞中的PLC-γ1信号通路,引起细胞内的Ca2+流动,进而抑制RBE细胞的增殖能力,并促进RBE细胞的凋亡水平,从而在CCA的发生发展中发挥一定的治疗作用。已知Ca2+流动在维持细胞的增殖活化中也具有重要作用,CAP通过调控Ca2+流动而抑制RBE细胞的增殖能力,并促进RBE细胞的凋亡水平这一作用可能与破坏了RBE细胞内的Ca2+稳态有关,然而确切的机制还有待进一步的研究。
4参考文献
1Khuntikeo N,Pugkhem A,Titapun A,etal.Surgical management of perihilar cholangiocarcinoma:a Khon Kaen experience〔J〕.J Hepatobiliary Pancreat Sci,2014;2(8)1:521-4.
2Claessen MM,Vleggaar FP,Tytgat KM,etal.High lifetime risk of cancer in primary sclerosing cholangitis〔J〕.J Hepatol,2009;50(1):158-64.
3Tyson GL,El-Serag HB.Risk factors for cholangiocarcinoma〔J〕.Hepatology,2011;54(1):173-84.
4Pramanik KC,Boreddy SR,Srivastava SK.Role of mitochondrial electron transport chain complexes in capsaicin mediated oxidative stress leading to apoptosis in pancreatic cancer cells〔J〕.PLoS One,2011;6(5):e20151.
5Bode AM,Dong Z.The two faces of capsaicin〔J〕.Cancer Res,2011;71(8):2809-14.
6Brown KC,Witte TR,Hardman WE,etal.Capsaicin displays anti-proliferative activity against human small cell lung cancer in cell culture and nude mice models via the E2F pathway〔J〕.PLoS One,2010;5:e10243.
7谭隽,胡玉兰,杨中华.辣椒素对宫颈癌Hela细胞增殖影响的研究〔J〕.广西医科大学学报,2010;27(2):213-5.
8Surh YJ,Lee SS.Capsaicin in hot chili pepper:carcinogen,co-carcinogen or anticarcinogen〔J〕?Food Chem Toxicol,1996;34(3):313-6.
9Minke B.TRP channels and Ca2+signaling〔J〕.Cell Calcium,2006;40(3):261-75.
10Huang Y,Wange RL.T cell receptor signaling:beyond complex complexes〔J〕.J Biol Chem,2004;279(28):28827-30.
〔2015-01-21修回〕
(编辑袁左鸣)
