HPLC法测定人血浆中紫杉醇的浓度
2015-12-29余俊先
张 杨,余俊先
(首都医科大学附属北京友谊医院药剂科,北京 100050)
·实验研究·
HPLC法测定人血浆中紫杉醇的浓度
张 杨,余俊先
(首都医科大学附属北京友谊医院药剂科,北京 100050)
目的:建立测定血浆中紫杉醇含量的分析方法。方法:采用高效液相色谱法,色谱柱为Phenomenex C18反相色谱柱(250 mm×4.6 mm,5 μm ),炔诺酮为内标,流动相为甲醇∶乙腈∶水 = 40∶30∶30,流速1.0 mL·min-1,检测波长为227 nm,柱温40 ℃。结果:主峰与杂质峰完全分离,紫杉醇和内标物炔诺酮的保留时间分别为11.4 min和7.8 min。紫杉醇在0.1 ~ 100.0 μg·mL-1的浓度范围内线性关系良好(r = 0.999 9);其低、中、高浓度(0.1、5.0、100.0 μg·mL-1)日内精密度的RSD值在2.06% ~5.72%,日间精密度的RSD值在2.44% ~ 6.12%,方法回收率在90.76% ~ 97.36%,萃取回收率在92.11% ~ 98.13%。血浆样品在– 20 ℃下放置稳定性和冻融稳定性良好。结论:本方法快速、准确、重现性好,符合生物样品的测定要求,适合作为体内紫杉醇含量的检测方法。
紫杉醇;高效液相色谱法;血浆;炔诺酮
紫杉醇(paclitaxel,PTX)是从太平洋红豆杉科红豆杉属Taxus brevifolia的树皮中提取得到的一种抗癌药物,主要是诱导和促进微管蛋白聚合、装配,稳定微管,从而抑制肿瘤细胞生长[1]。20世纪20年代末期,美国FDA批准紫杉醇为抗晚期癌症的新药,商品名为泰素(Taxol),现该药已广泛应用于治疗晚期及转移性卵巢癌、乳腺癌、非小细胞肺癌、前列腺癌、肺癌和头颈部肿瘤等[2]。目前,紫杉醇的测定方法主要有分光光度法、荧光法以及液相色谱法等[3],本研究建立的紫杉醇血浆样品提取方法简便、快速、稳定,以炔诺酮为内标,使其高效液相色谱(HPLC)分析方法具有良好的重现性和灵敏性,适用于血浆中紫杉醇浓度的检测。
1 材料
1.1 仪器
高效液相色谱仪LC-10A(日本岛津公司);Phenomenex C18反相色谱柱(250 mm×4.6 mm,5 μm);WH-861型涡旋振荡器(江苏太仓市科教器材厂);1-15K冷冻台式离心机(美国Sigma-Aldrich公司);HH-2型数显恒温水浴锅(常州国华电器有限公司)。
1.2 试剂
紫杉醇标准品(陕西森弗生物技术有限公司,纯度99%,批号20130721);紫杉醇注射液(紫素,北京协和药厂,批号141202);炔诺酮(美国Sigma-Aldrich公司,纯度> 98%,批号58H1258);甲醇、乙腈、四氢呋喃、叔丁基甲基醚均为色谱纯(加拿大Promptar公司),其它试剂均为商品化材料。空白血浆由首都医科大学附属北京友谊医院检验科提供。
2 方法
2.1 色谱条件
色谱柱:Phenomenex C18反相色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇 : 乙腈 : 水= 40∶30∶30;流速:1.0 mL·min-1;检测波长:227 nm;柱温:40 ℃;进样量:20 μL。
2.2 储备液的配制
准确称取紫杉醇标准品适量于容量瓶中,用70%乙腈溶解制备成浓度为1.0 mg·mL-1的储备液,需要时用70%乙腈稀释成一定浓度的标准工作液。另准确称取内标物炔诺酮适量于容量瓶中,用流动相溶解制备成浓度为2.5 μg·mL-1的储备液。
2.3 血浆样品预处理
吸取100 μL待测血浆样本于10 mL离心管中,依次加入炔诺酮储备液(内标,IS)和70%乙腈各100 μL,旋涡混匀。然后加入2.5 mL叔丁基甲基醚,旋涡混合5 min,于4000 r·min-1离心10 min。吸取上清液2 mL于玻璃试管中,在50 ℃水浴中通氮气吹干。然后加入100 μL 流动相,旋涡混合5 min,使样品充分复溶。
2.4 方法特异性
吸取空白血浆100 μL,加入紫杉醇标准溶液(5.0 μg·mL-1)和炔诺酮储备液各100 μL。另取上述空白血浆100 μL,加入200 μL 70%乙腈溶液,作为空白对照组。分别按照“2.3”项下方法处理样品,吸取处理后的样品20 μL注入液相色谱仪,记录色谱图,考察系统适用性。
2.5 线性范围考察
以70%乙腈为溶剂,配制浓度分别为0.1、0.5、1.0、2.0、5.0、10.0、50.0、100.0 μg·mL-1的紫杉醇系列标准溶液。吸取空白血浆100 μL,分别加入上述系列标准溶液和炔诺酮储备液各100 μL,按照“2.3”项下方法处理样品,吸取处理后的样品20 μL注入色谱仪,记录峰面积,以紫杉醇和炔诺酮的峰面积之比(APTX/AIS)-血药浓度(C)进行线性回归。
2.6 精密度考察
分别取0.1、5.0、100.0 μg·mL-1的紫杉醇标准溶液各100 μL和炔诺酮储备液100 μL,加入到100 μL空白血浆中,作为相应的低、中、高浓度组,按照“2.3”项下方法处理样品并进样分析,计算紫杉醇和炔诺酮的峰面积之比(APTX/AIS)。每一浓度平行做5个样品,连续测定5 d,考察本方法的日内及日间精密度。
2.7 回收率考察
2.7.1方法回收率考察 分别取0.1、5.0、100.0 μg·mL-1的紫杉醇标准溶液各100 μL和炔诺酮储备液100 μL,加入到100 μL空白血浆中,作为相应的低、中、高浓度组,按照“2.3”项下方法处理样品并进样分析,计算紫杉醇和炔诺酮的峰面积之比(APTX/AIS)。每一浓度平行做5个样品,分别代入标准曲线计算本方法的回收率。
2.7.2萃取回收率考察 分别取0.1、5.0、100.0 μg·mL-1的紫杉醇标准溶液各100 μL和炔诺酮储备液100 μL,加入到100 μL空白血浆中,作为相应的低、中、高浓度组,按照“2.3”项下方法处理样品并进样分析,记录峰面积。另取0.1、5.0、100.0 μg·mL-1的紫杉醇标准溶液各20 μL直接注入液相色谱仪,记录峰面积。每一浓度平行做5个样品,计算萃取回收率。
2.8 稳定性考察
分别取0.1、5.0、100.0 μg·mL-1的紫杉醇标准溶液各100 μL和炔诺酮储备液100 μL,加入到100 μL空白血浆中,作为相应的低、中、高浓度组,按照“2.3”项下方法处理样品,每一浓度平行做5个样品,将处理好的样品在– 20 ℃冰箱中放置。分别于第0、1、7、15、30天各吸取20 μL注入色谱仪,记录峰面积,考察样品放置稳定性。另取低、中、高浓度组的血浆样品于– 20 ℃反复冻融3次,按照“2.3”项下方法处理样品并进样分析,记录峰面积,考察样品冻融稳定性。
2.9 临床研究
经首都医科大学附属北京友谊医院伦理委员会批准,将本方法用于4例乳腺癌患者紫杉醇血药浓度的测定。4例患者的平均年龄(42.3±6.5)岁,肝、肾功能正常,3周内未接受化疗和放疗。紫杉醇给药剂量为175 mg·m-2(溶于5%葡萄糖注射液,恒速静脉滴注3 h),于滴注开始后0.5 h、1 h、2 h、滴注结束时以及滴注结束后1 h、2 h、3 h、4 h经上肢静脉取血1.0 mL,置于肝素化离心管中,4000 r·min-1离心10 min以分离血浆,血浆样品按照“2.3”项下方法处理并进样分析,测定血浆药物浓度。
3 结果
3.1 方法特异性
如图1所示,在本实验条件下,主峰与杂质峰完全分离,紫杉醇和内标物炔诺酮分离良好,不受血浆色谱峰的干扰,紫杉醇和炔诺酮的保留时间分别为11.4 min和7.8 min。紫杉醇理论塔板数为3352,拖尾因子为0.963,分离度为6.772,均符合规定,提示本方法测定紫杉醇的含量具有良好的特异性。
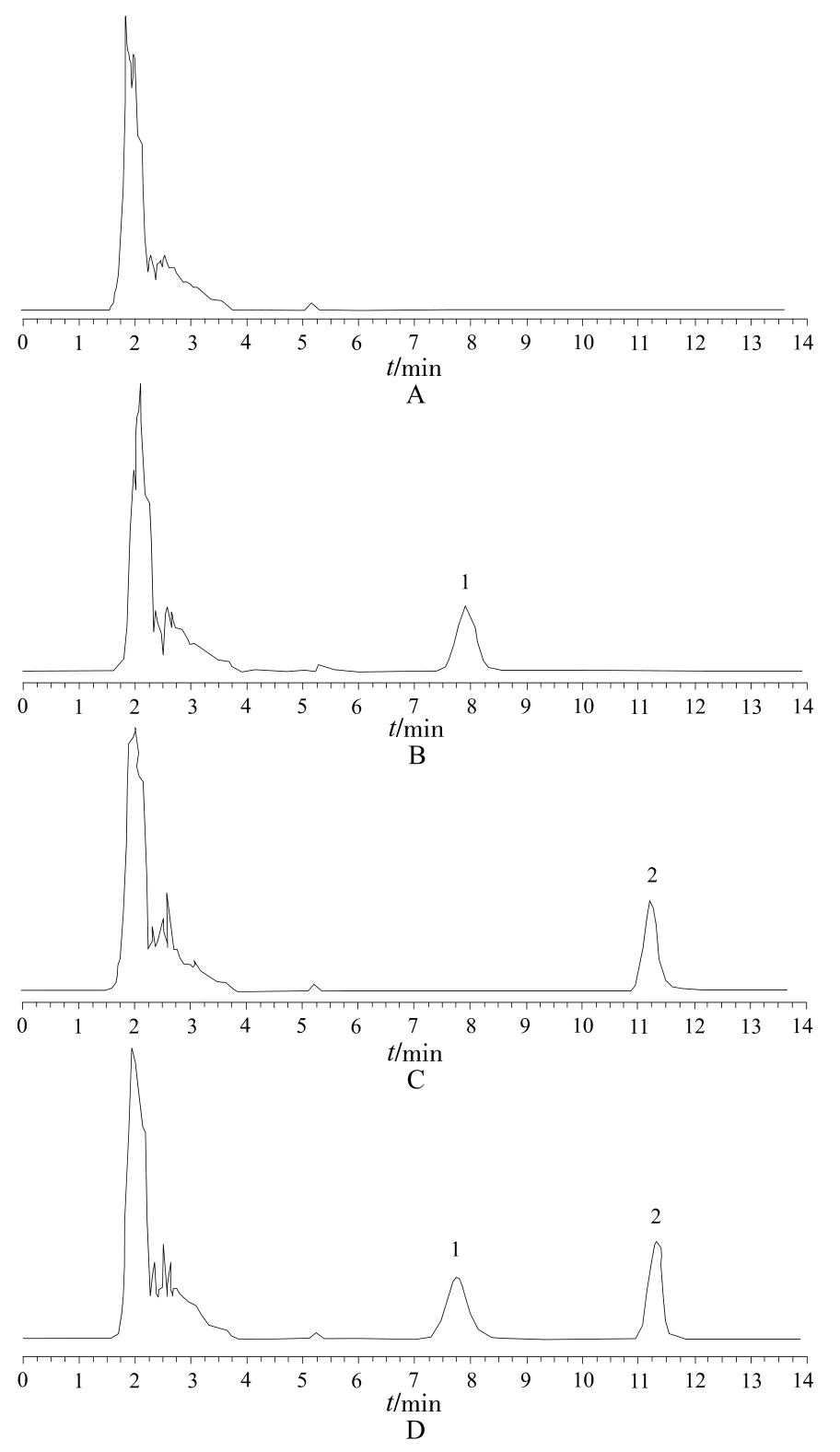
图1 高效液相色谱图A – 空白血浆,B – 空白血浆+内标,C – 空白血浆+紫杉醇,D –空白血浆+紫杉醇+内标;1 – 内标,2 – 紫杉醇Fig 1 HPLC chromatogramsA – blank plasma, B – IS in blank plasma, C – PTX in blank plasma, D – PTX plus IS in blank plasma; 1 – IS, 2 – PTX
3.2 线性范围
以紫杉醇与炔诺酮峰面积的比值(APTX/AIS)作为纵坐标(A),对紫杉醇浓度C(μg·mL-1)进行线性回归,得到回归方程:A = 0.297 C + 0.539,r = 0.999 9,紫杉醇的线性范围为0.1 ~ 100.0 μg·mL-1,线性关系良好。
3.3 精密度
日内和日间精密度测定结果详见表1。低、中、高3个浓度的相对标准偏差均在规定范围内(< 10%),表明该方法精密度良好。

表1 实验方法的精密度考察结果. n = 5Tab 1 The precision result of the method. n = 5
3.4 回收率
方法回收率和萃取回收率的测定结果见表2,血浆中低、中、高浓度样品的方法回收率和萃取回收率均在90%以上,符合规定,表明该方法准确度良好。

表2 实验方法的回收率考察结果. n = 5Tab 2 The recovery result of the method. n = 5
3.5 样品的稳定性
含紫杉醇血浆样品在– 20 ℃条件下放置稳定性和冻融稳定性结果分别见表3和表4。结果表明,紫杉醇血浆样品预处理后在– 20 ℃冰箱中保存30 d是稳定的,反复冻融3次对紫杉醇浓度测定结果无影响。
3.6 临床应用
紫杉醇的药-时曲线如图2所示。由图可见,实测血药浓度范围为0.11 ~ 3.14 μg·mL-1,均在本方法的线性范围内。在相同的给药方案条件下,4例患者体内的药物浓度无明显的个体差异,最高与最低峰浓度仅相差约1.5 倍。
4 讨论
4.1 紫杉醇体内浓度测定方法
药物在体内的分析方法有多种,如HPLC、HPLC-MS/MS、HPCE等[4-6]。关于紫杉醇在体内的分析方法,早在其临床前研究阶段,Hamel等[7]就已开发了一种生化方法来检测血中紫杉醇的含量。由于该方法步骤冗长、操作繁琐,当紫杉醇进入Ⅰ期临床试验后,HPLC法很快成为主要的分析手段。现已报道的HPLC法多采用液相萃取法或固相萃取法对生物样品进行前处理[8-10],这些方法都能有效地分离血浆中的紫杉醇。尽管与液相萃取法相比,固相萃取法具有操作简便、分离效果好等优势,但过高的成本限制了其在临床的广泛应用。本实验在参考文献基础上,选择液相萃取法作为样品前处理的方法,对提取条件等进行了优化。处理后的样品在所建立的色谱条件下,主峰与各杂质峰具有良好的分离度,方法稳定,精密度和回收率均符合规定,能够达到生物样品的分析要求。
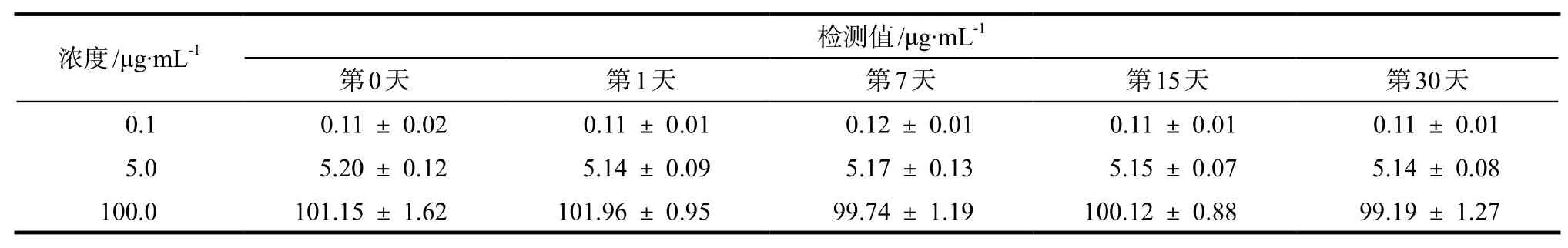
表3 血浆样品– 20 ℃下放置稳定性考察结果. n = 5Tab 3 The stability of PTX in blank plasma at – 20 ℃. n = 5
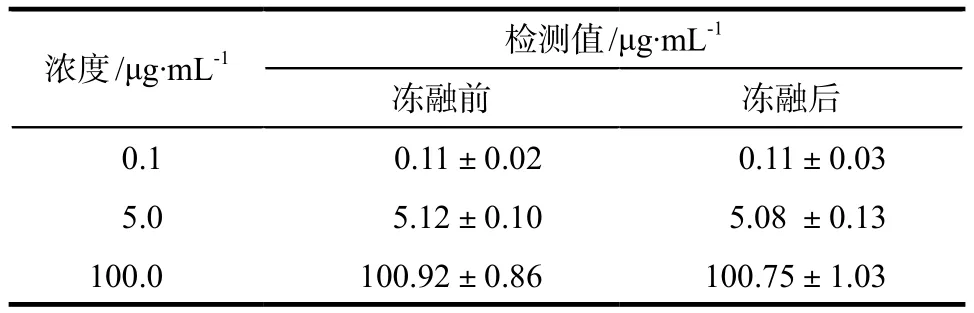
表4 血浆样品冻融稳定性考察结果. n = 5Tab 4 The stability of test samples after freeze-thaw for three times. n = 5

图2 紫杉醇的血药浓度-时间曲线Fig 2 Blood concentration-time curve of paclitaxel
4.2 提取溶剂的选择
本实验在提取溶剂的选择上分别考察了无水乙醚、乙酸乙酯和叔丁基甲基醚的萃取效率,结果发现采用无水乙醚、乙酸乙酯作萃取剂时,提取得到的血浆中的内源性杂质比较多,干扰测定结果。而采用叔丁基甲基醚作萃取剂,可以消除内源性杂质的干扰,同时取得了满意的提取率(萃取回收率在90%以上)。由于叔丁基甲基醚的极性较低,作为萃取剂能够使EP管中的增塑剂等杂质溶出,对测定造成干扰,因此使用玻璃离心管作为萃取容器。
4.3 内标物的选择
人血中紫杉醇的分析方法,国内文献报道多以地西泮为内标,采用液相萃取法[11]。而国外相关文献中,多以巴卡亭为内标,但多采用固相萃取法,其过程繁琐,稳定性和重复性较差[12]。而炔诺酮是一种孕激素甾体药物,在《中国药典》中其HPLC法测定含量的检测波长为244 nm,在水相和有机相中的分配情况、挥发性、对萃取容器的吸附性以及层析行为等均与紫杉醇相似,因此被选作内标物[13-14]。炔诺酮的浓度选择为2.5 μg·mL-1是根据其与标准曲线中段的紫杉醇(2 μg·mL-1)响应值比近似为1 而确定的。
4.4 流动相的选择
采用甲醇和水作为流动相时,高效液相色谱仪器的系统压力过大;而采用磷酸盐缓冲溶液作为流动相时,由于流动相中含有磷酸盐成分,容易导致管道堵塞,进而造成系统压力过大[15]。本检测过程中采用了甲醇 : 乙腈 : 水 = 40∶30∶30作为流动相,峰形对称,无拖尾现象。
综上,本方法快速、准确、重现性好,符合生物样品的测定要求,并实际应用于4例患者体内药物浓度的测定,适合作为体内紫杉醇含量的检测方法。
[1] Manfredi JJ, Horwitz SB. Taxol: an antimitotic agent with a new mechanism of action[J]. Pharmacol Ther, 1984, 25(1): 83-125.
[2] Howat S, Park B, Oh IS, et al. Paclitaxel: biosynthesis, production and future prospects[J]. N Biotechnol, 2014, 31(3): 242-245.
[3] Tekade RK, D'Emanuele A, Elhissi A, et al. Extraction and RPHPLC determination of taxol in rat plasma, cell culture and quality control samples[J]. J Biomed Res, 2013, 27(5): 394-405.
[4] 温爱萍,李哲,李任,等.HPLC法测定人血浆中游离亚胺培南浓度[J].中国药物应用与监测,2015,12(3):151-154.
[5] 赵冠人,彭明丽,申健,等.HPLC-MS/MS方法同时检测人血浆中异烟肼、利福平、乙胺丁醇、吡嗪酰胺和左氧氟沙星的浓度[J].中国药物应用与监测,2015,12(1):16-19.
[6] 古今,刘萍.HPCE法测定酸枣仁及其伪品中酸枣仁皂苷B的含量[J].中国药物应用与监测,2007,4(5):38-40.
[7] Hamel E, Lin CM, Johns DG. Tubulin-dependent biochemical assay for the antineoplastic agent taxol and application to measurement of the drug in serum[J]. Cancer Treat Rep, 1982, 66(6): 1381-1386.
[8] Jain A, Gulbake A, Jain A, et al. Development and validation of the HPLC method for simultaneous estimation of paclitaxel and topotecan[J]. J Chromatogr Sci, 2014, 52(7): 697-703.
[9] Choudhury H, Gorain B, Karmakar S, et al. Development and validation of RP-HPLC method: scope of application in the determination of oil solubility of paclitaxel[J]. J Chromatogr Sci, 2014, 52(1): 68-74.
[10] Gréen H, Vretenbrant K, Norlander B, et al. Measurement of paclitaxel and its metabolites in human plasma using liquid chromatography/ion trap mass spectrometry with a sonic spray ionization interface[J]. Rapid Commun Mass Spectrom, 2006, 20(14): 2183-2189.
[11] 张天英,国玉芝,张大伟,等.HPLC法测定人血浆中紫杉醇浓度方法验证[J].黑龙江医药科学,2013,36(2):54-55.
[12] Newman MJ, Rodarte JC, Benbatoul KD, et al. Discovery and characterization of OC144-093, a novel inhibitor of P-glycoprotein-mediated multidrug resistance[J]. Cancer Res, 2000, 60(11): 2964-2972.
[13] Qu G, Yao Z, Zhang C, et al. PEG conjugated N-octyl-O-sulfate chitosan micelles for delivery of paclitaxel: in vitro characterization and in vivo evaluation[J]. Eur J Pharm Sci, 2009, 37(2): 98-105.
[14] Li H, Huo M, Zhou J, et al. Enhanced oral absorption of paclitaxel in N-deoxycholic acid-N, O-hydroxyethyl chitosan micellar system[J]. J Pharm Sci, 2010, 99(11): 4543-4553.
[15] 全红娜,金松子,雷勇胜,等.反相高效液相色谱中流动相选择与优化的研究进展[J].现代药物与临床,2014,29(10):1190-1194.
Determination of paclitaxel in human plasma by HPLC
ZHANG Yang, YU Jun-xian
(Department of Pharmacy, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China)
Objective:To establish a method for analyzing the concentration of paclitaxel (PTX) in human plasma.Methods:PTX was measured by high performance liquid chromatography (HPLC) with Phenomenex C18column (250 mm × 4.6 mm, 5 μm) at 40 ℃. Norethisterone was used as the internal standard. The mobile phase was consisted of methanol, acetonitrile and water (40 : 30 : 30), the flow rate was 1.0 mL·min-1and the detection wavelength was 227 nm.Results:The peak of impurities and component could be well separated, the retention time of paclitaxel and norethisterone were 11.4 min and 7.8 min, respectively. Excellent linear calibration curve of paclitaxel was obtained within the concentration range of 0.1 – 100.0 μg·mL-1(r = 0.999 9). The intra- and interday precision for low, middle and high concentration (0.1, 5.0, 100.0 μg·mL-1) showed that RSD were 2.06% – 5.72% and 2.44% –6.12%, respectively. The recovery of the method was in the range of 90.76% – 97.36%, and the extraction recovery of the method was in the range of 92.11% – 98.13%. Paclitaxel in human plasma was stable after storage at – 20 ℃ or freeze-thaw for three times.Conclusion:This method is rapid, accurate and reproducible, which is consistent with the requirement for determining biological specimen and suitable for detection of paclitaxel concentration in human plasma.
Paclitaxel; HPLC; Plasma; Norethisterone
R917
A
1672 – 8157(2015)06 – 0343 – 05
2015-07-14
2015-10-09)
2015年度首都中医药研究专项(15ZY14)
张杨,男,硕士,药师,主要从事临床药学工作。E-mail:david19872005@163.com
