新型抗Her-2药物曲妥珠单抗共轭复合物治疗乳腺癌安全性的系统评价
2015-12-29郭子寒焦园园范丽萍张艳华
郭子寒,焦园园,范丽萍,张艳华
(1.北京大学肿瘤医院暨北京市肿瘤防治研究所药剂科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.北京大学医学部临床药学与药事管理系,北京 100191)
新型抗Her-2药物曲妥珠单抗共轭复合物治疗乳腺癌安全性的系统评价
郭子寒1,2,焦园园1,范丽萍1,2,张艳华1
(1.北京大学肿瘤医院暨北京市肿瘤防治研究所药剂科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;2.北京大学医学部临床药学与药事管理系,北京 100191)
目的:系统评价曲妥珠单抗共轭复合物(ado-trastuzumab emtansine,T-DM1)不良反应的发生率。方法:检索PubMed、Clinicaltrials.gov和CNKI数据库,收集2015年2月前发表的T-DM1临床研究,采用RevMan 5.3软件分析。结果:共纳入3项随机对照试验,共计1700例患者。Meta分析结果显示,所有程度不良反应发生率:T-DM1组血小板减少的发生率高于对照组[RR = 6.76,95%CI(3.47,13.17),P = 0.12,I2= 53%];T-DM1组AST升高的发生率高于对照组[RR = 2.68,95%CI(1.40,5.14),P = 0.04,I2= 69%];T-DM1组中性粒细胞减少的发生率低于对照组[RR = 0.35,95%CI(0.18,0.71),P = 0.003,I2= 83%];T-DM1组腹泻的发生率低于对照组[RR = 0.34,95%CI(0.25,0.47),P = 0.12,I2= 52%];两组贫血的发生率差异无统计学意义[RR = 0.87,95%CI(0.51,1.49),P = 0.05,I2= 66%]。3-4度不良反应发生率:T-DM1组中性粒细胞减少的发生率低于对照组[RR = 0.20,95%CI(0.08,0.50),P = 0.02,I2= 75%];T-DM1组腹泻的发生率低于对照组[RR = 0.10,95%CI(0.05,0.18),P = 0.53,I2= 0%];两组血小板减少的发生率差异无统计学意义[RR = 6.93,95%CI(0.80,59.80),P = 0.004,I2= 82%];两组贫血的发生率差异无统计学意义[RR = 1.21,95%CI(0.65,2.26),P = 0.59,I2= 0%];两组AST升高的发生率差异无统计学意义[RR = 3.13,95%CI(0.77,12.70),P = 0.07,I2= 63%]。结论:与传统化疗方案相比,T-DM1具有良好的安全性。
曲妥珠单抗共轭复合物;Her-2阳性;转移性乳腺癌;安全性;Meta分析;系统评价
乳腺癌是女性最常见的恶性肿瘤之一,在女性癌症患者中,约有1/4为乳腺癌患者。据世界卫生组织国际癌症研究中心发布的2012年全球肿瘤流行病统计数据显示,2012年全球女性乳腺癌新发病例约为167.7万例,有52.2万人死于乳腺癌,是死亡率第一的肿瘤[1]。中国乳腺癌的发病率和死亡率也呈逐年上升趋势,有研究[2]显示2010年中国女性乳腺癌新诊断病例约为20.8万例,居女性肿瘤发病率的第1位,死亡约5.6万例,居女性肿瘤死亡率的第5位。
Her-2过度表达是乳腺癌患者的一个独立预后因子,约有15%的患者Her-2过度表达。曲妥珠单抗是一种抗Her-2的单克隆抗体,该药物在Her-2过度表达的转移性乳腺癌中发挥了重要作用,但对于应用曲妥珠单抗治疗出现原发耐药和继发耐药导致疾病进展的患者,继续应用曲妥珠单抗对延长患者无进展生存期(progression free survival,PFS)无意义。最新的研究显示,曲妥珠单抗共轭复合物(ado-trastuzumab emtansine,T-DM1)可显著延长患者的PFS[3-5]。
美国食品药品管理局(FDA)于2013年2月26日批准T-DM1用于治疗Her-2阳性晚期乳腺癌。T-DM1是一种曲妥珠单抗与细胞毒药物美坦辛(maytansine,DM1)的偶联物,可将抗肿瘤药物定向地送达到靶细胞中,同时发挥曲妥珠单抗的靶向作用和DM1的抗肿瘤作用,在加强杀灭瘤细胞作用的同时降低对正常组织的杀伤作用。
作为新型抗肿瘤药物,T-DM1对Her-2阳性晚期乳腺癌疗效确切,但其毒副作用也越来越受到人们的关注。因此,笔者对T-DM1主要的不良反应进行荟萃分析,评价T-DM1的安全性,为临床安全合理用药提供参考依据。
1 资料与方法
1.1 纳入标准
(1)研究类型:随机对照试验(randomized controlled trial,RCT),无论发表与否。(2)研究对象:①年龄18岁以上;②组织学或细胞学上诊断为局部晚期或转移性乳腺癌患者;③人表皮生长因子受体Her-2阳性患者;④之前是否接受过化疗或靶向治疗不限;⑤试验组患者仅接受T-DM1单一药物治疗。(3)干预措施:试验组每3周给予T-DM1 1次,每次3.6 mg·kg-1,30 ~ 90 min内静脉滴注。(4)结局指标:试验组或对照组3-4度药品不良反应(adverse drug reactions,ADRs)发生率大于2%的不良反应发生例数,包括血小板减少、贫血、中性粒细胞减少、腹泻、AST升高。
1.2 排除标准
(1)无法提取数据的试验;(2)重复发表或同一研究的临床试验;(3)Ⅰ期临床试验;(4)患者合并使用其他药物。
1.3 检索策略
计算机检索PubMed、Clinicaltrials.gov和CNKI数据库,检索时间截止到2015年2月,收集所有关于T-DM1的Ⅱ期和Ⅲ期的临床试验。检索词为:kadcyla、trastuzumab emtansine、trastuzumab-MCCDM1、T-DM1、ado-trastuzumab emtansine。检索均采用全文检索的方式。
1.4 文献筛选、资料提取与质量评价
文献筛选、资料提取和质量评价均由2名研究人员独立完成,出现疑问或意见不一致时,通过讨论或征求第三方专家意见协助解决。资料提取内容主要包括:研究特征(临床试验注册号、完成年份、研究类型、样本量),研究对象基本特征(疾病类型),治疗方案(药物、剂量)和各种不良反应的发生例数。
对于RCT研究,用Cochrane风险偏倚评估工具对每篇纳入文献进行质量评价,包括6个方面,即选择偏倚、实施偏倚、测量偏倚、随访偏倚、报告偏倚和其他偏倚[6]。
1.5 统计学分析
采用Cochrane协作网提供的RevMan 5.3软件进行相对危险度(relative risk,RR)的统计分析。当各研究结果间有统计学同质性(P≥0.10,I2≤50%)时,采用固定效应模型进行Meta分析;当各研究结果间存在统计学异质性(P < 0.10,I2> 50%),在无明显临床异质性或差异无统计学意义时,采用随机效应模型进行Meta分析。Meta分析的检验水准为α = 0.05[7-8]。按NCI-CTC 3.0[9]不良反应的分级进行亚组分析,探讨患者对T-DM1的耐受性。
2 结果
2.1 文献检索结果
共检索到相关研究62项,经逐层筛选后,最终纳入分析的有3项研究,共计1700例患者。筛选流程及结果如图1所示。

图1 文献筛选流程及结果Fig 1 The process and results of the literature screening
2.2 纳入研究的基本特征
3项RCT从试验分期分为:2项为Ⅲ期试验,1项为Ⅱ期试验。3项研究中,样本量最小为135例,最大为978例,合计1700例;给药剂量为3.6 mg·kg-1·3w-1;结局指标为不良反应的发生例数。3项研究的基本特征见表1(其中,传统治疗方案包括化疗,激素疗法,针对Her-2的靶向治疗)。
2.3 纳入研究的质量评价
3项RCT研究采用Cochrane风险偏倚评估工具进行质量评价,结果见表2。

表1 纳入研究的基本特征Tab 1 Characteristics of included studies

表2 纳入研究的RCT质量评价Tab 2 The quality evaluation of methodology of included RCTs
2.4 不良反应发生率分析
2.4.1所有程度不良反应发生率 Meta分析结果显示,T-DM1组血小板减少的发生率高于对照组,其差异有统计学意义[RR = 6.76,95%CI(3.47,13.17),P = 0.12,I2= 53%]。T-DM1组AST升高的发生率高于对照组,其差异有统计学意义[RR = 2.68,95%CI(1.40,5.14),P = 0.04,I2= 69%]。T-DM1组中性粒细胞减少的发生率低于对照组,其差异有统计学意义[RR = 0.35,95%CI(0.18,0.71),P = 0.003,I2= 83%]。T-DM1组腹泻的发生率低于对照组,其差异有统计学意义[RR = 0.34,95%CI(0.25,0.47),P = 0.12,I2= 52%]。两组贫血的发生率差异无统计学意义[RR = 0.87,95%CI(0.51,1.49),P = 0.05,I2= 66%],详见表3。
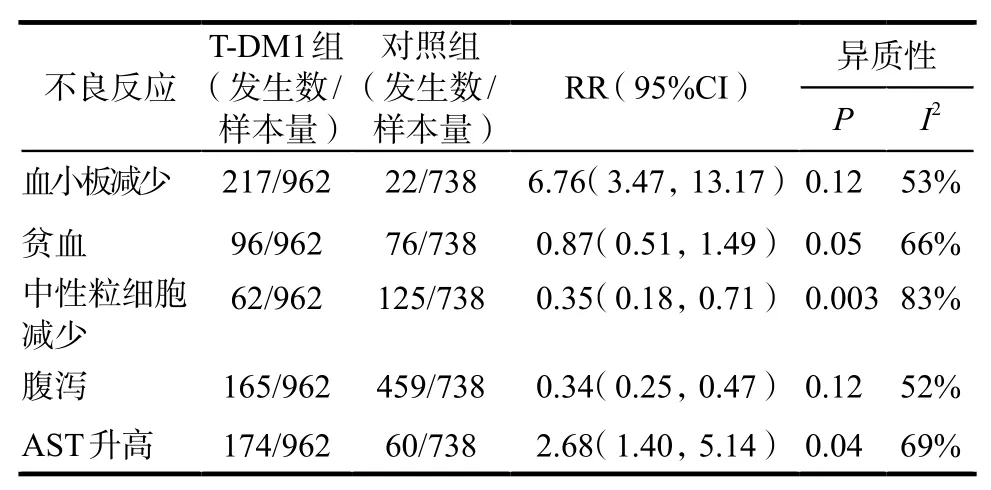
表3 所有程度不良反应发生率的Meta分析Tab 3 Meta-analysis on the incidence rate of all-grade ADRs
2.4.2 3-4度不良反应发生率 Meta分析结果显示,T-DM1组中性粒细胞减少的发生率低于对照组,其差异有统计学意义[RR = 0.20,95%CI(0.08,0.50),P = 0.02,I2= 75%]。T-DM1组腹泻的发生率低于对照组,其差异有统计学意义[RR = 0.10,95%CI(0.05,0.18),P = 0.53,I2= 0%]。两组血小板减少的发生率差异无统计学意义[RR = 6.93,95%CI(0.80,59.80),P = 0.004,I2= 82%]。两组贫血的发生率差异无统计学意义[RR = 1.21,95%CI(0.65,2.26),P = 0.59,I2= 0%]。两组AST升高的发生率差异无统计学意义[RR = 3.13,95%CI(0.77,12.70),P = 0.07,I2= 63%],详见表4。

表4 3-4度不良反应发生率的Meta分析Tab 4 Meta-analysis on the incidence rate of 3-4 grade ADRs
此外,常见的不良反应还有恶心,呕吐,发热,ALT升高,低钾血症,周围神经病变,鼻衄,咳嗽,呼吸困难和皮疹等。临床中还观察到左心室功能障碍,间质性肺炎和过敏反应等严重的不良反应。
3 讨论
与传统抗Her-2靶向治疗联合全身化疗的治疗方案相比,T-DM1可显著延长Her-2阳性晚期乳腺癌患者的无进展生存期及总生存期,同时未增加额外的不良事件,患者耐受性良好。
3.1 T-DM1大部分不良反应发生率较低的机制
T-DM1是一类新型抗体-药物偶联物,由人源化的抗Her-2 IgG1,曲妥珠单抗与微管抑制剂DM1(美坦辛衍生物)通过稳定的SMMC连接共价结合[10]。T-DM1进入体内后与肿瘤细胞表面的Her-2受体结合后,发生受体介导的细胞内吞作用,在肿瘤细胞内释放细胞毒药物DM1从而引发肿瘤细胞死亡。稳定性较强的SMMC连接部分,保证T-DM1在被Her-2过表达的肿瘤细胞内化后才释放细胞毒性药物,使DM1的全身性暴露最小化,从而使药物对正常细胞的杀伤作用较小,因此具有相对较小的不良反应[11-12]。
3.2 T-DM1血小板减少发生率较高的机制
相比于传统的治疗方案,T-DM1血小板减少的发生率高达24%,在亚裔人群中更高达45.1%[13]。T-DM1对血小板的激活和聚集没有直接影响,但它可以通过细胞毒效应阻止巨核细胞的分化。T-DM1进入体内后,不依赖于Her-2受体,被巨核细胞内吞后释放细胞毒性药物DM1,成熟的巨核细胞长期暴露于T-DM1会导致细胞骨架结构的破坏,而巨核细胞是正常骨髓中的一种能生成血小板的成熟细胞,成熟的巨核细胞边缘部分破裂脱落后形成血小板,T-DM1通过破坏巨核细胞骨架结构而导致血小板生成的减少[14]。
3.3 本研究的优势和不足
本研究结果表明,T-DM1大部分不良反应发生率较低,患者耐受性良好,但血小板减少、AST升高的发生率较高,应重视对不良反应的防治。本研究的优势:①对中英文数据库进行了充分的检索,较为全面的纳入了多项临床试验,相对于单个试验增加了样本量,使数据更有说服力;②对常见的不良反应(发生率> 2%)进行荟萃分析,全面的了解T-DM1的不良反应。本研究的不足:①检索资料时只纳入了正式发表的研究,未能检索到未发表的阴性结果的研究,有可能使一些研究不能被纳入,这在一定程度上会导致发表偏倚的产生;②纳入研究的3篇RCT随机化方法不清楚,且未使用盲法,导致试验质量存在一定问题,可能会夸大T-DM1的安全性,因此研究的结果仍需要大样本、高质量的研究进行验证和补充。
[1] Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No.11[EB/OL]. France, Lyon: International Agency for Research on Cancer, 2013[2015-02-14]. http://globocan.iarc.fr/Default.aspx.
[2] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3] Krop IE, Kim SB, Gonzalez-Martin A, et al. Trastuzumab emtansine versus treatment of physician's choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2014, 15(7): 689-699.
[4] Hurvitz SA, Dirix L, Kocsis J, et al. PhaseⅡrandomized study of trastuzumab emtansine versus trastuzumab plus docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer[J]. J Clin Oncol, 2013, 31(9): 1157-1163.
[5] Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer[J]. N Engl J Med, 2012, 367(19): 1783-1791.
[6] Higgins JPT, Altman DG, Sterne JAC, et al. Cochrane Handbook for Systematic Reviews of Interventions[EB/OL]. [2015-02-14]. http://www.cochrane-handbook.org.
[7] DerSimonian R, Laird N. Meta-analysis in clinical trials[J]. Control Clin Trials, 1986, 7(3): 177-188.
[8] Higgins JP, Thompson SG. Quantifying heterogeneity in a metaanalysis[J]. Stat Med, 2002, 21(11): 1539-1558.
[9] Cancer Therapy Evaluation Program. Common Terminology Criteria for Adverse Events v3.0 (CTCAE) [EB/OL]. (2006-09-09)[2015-02-14]. http://ctep.cancer.gov/protocolDevelopment/electronic_ applications/docs/ctcaev3.pdf.
[10] Junttila TT, Li G, Parsons K, et al. Trastuzumab-DM1 (T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer[J]. Breast Cancer Res Treat, 2011, 128(2): 347-356.
[11] 岳健,徐兵河.新型抗Her-2药物T-DM1[J].中国肿瘤临床,2013,40(19):1203-1206.
[12] Lewis Phillips GD, Li G, Dugger DL, et al. Targeting HER2-positive breast cancer with trastuzumab-DM1, an antibodycytotoxic drug conjugate[J]. Cancer Res, 2008, 68(22): 9280-9290.
[13] Beeram M, Krop IE, Burris HA, et al. A phaseⅠstudy of weekly dosing of trastuzumab emtansine (T-DM1) in patients with advanced human epidermal growth factor 2-positive breast cancer[J]. Cancer, 2012, 118(23): 5733-5740.
[14] Uppal H, Doudement E, Mahapatra K, et al. Potential mechanisms for thrombocytopenia development with trastuzumab emtansine (T-DM1)[J]. Clin Cancer Res, 2014, 11(4): 1-40.
Systematic review on the safety of the new type Her-2 positive targeted drugs T-DM1 in breast cancer
GUO Zi-han1,2, JIAO Yuan-yuan1, FAN Li-ping1,2, ZHANG Yan-hua1
(1. Department of Pharmacy, Peking University Cancer Hospital & Institute, Key Laboratory of Carcinogenesis and Translational Research (Ministry of Education), Beijing 100142, China; 2. Department of Pharmacy Administration and Clinical Pharmacy, School of Pharmaceutical Sciences, Peking University Health Science Center, Beijing 100191, China)
Objective:To systematically evaluate the incidence of adverse reactions about ado-trastuzumab emtansine (T-DM1).Methods:We searched medical literature from the PubMed, Clinicaltrials.gov and CNKI. Our meta-analysis included clinical trials published before February 2015. All statistical analyses were performed by RevMan 5.3 software.Results:A total of 3 randomized controlled trials involving 1700 patients were included. The results of meta-analysis showed that in all-grade adverse reactions, when compared with control group, the incidence of thrombocytopenia was higher in T-DM1 group [RR = 6.76, 95%CI(3.47, 13.17), P = 0.12, I2= 53%]; the incidence of increase of AST was higher in T-DM1 group [RR = 2.68, 95%CI(1.40, 5.14), P = 0.04, I2= 69%]; the incidence of neutropenia was lower in T-DM1 group [RR = 0.35, 95%CI(0.18, 0.71), P = 0.003, I2= 83%]; the incidence of diarrhea was lower in T-DM1 group [RR = 0.34, 95%CI (0.25, 0.47), P = 0.12, I2= 52%]; while, no significant difference was found in anaemia between the two groups [RR = 0.87, 95%CI(0.51, 1.49), P = 0.05, I2= 66%]. When compared with the 3-4 grade adverse reactions of control group, the incidence of neutropenia was lower in T-DM1 group [RR = 0.20, 95%CI(0.08, 0.50), P = 0.02, I2= 75%]; the incidence of diarrhea was lower in T-DM1 group [RR = 0.10, 95%CI (0.05, 0.18), P = 0.53, I2= 0%]; however, no significant difference was found between the two groups in thrombocytopenia [RR = 6.93, 95%CI(0.80, 59.80), P = 0.004, I2= 82%], anaemia [RR = 1.21, 95%CI(0.65, 2.26), P = 0.59, I2= 0%] and increase of AST [RR = 3.13, 95%CI(0.77, 12.70), P = 0.07, I2= 63%].Conclusion:T-DM1 has a good safety compared to the traditional chemotherapy.
Ado-trastuzumab emtansine (T-DM1); Her-2 positive; Metastatic breast cancer; Safety; Meta-analysis; Systematic review
R969.4
A
1672 – 8157(2015)06 – 0339 – 04
2015-05-21
2015-08-02)
北京药学会2014年临床药学研究项目:肿瘤患者紫杉醇三周方案给药后关键药代动力学参数Tc > 0.05与临床毒性相关性研究
张艳华,女,主任药师,研究方向:医院药学、药物经济学及血药浓度监测等。E-mail:zyh8812@163.com
郭子寒,女,在读硕士研究生,研究方向:循证药学。E-mail:13391567440@163.com
