胎盘胶原样凝集素1研究进展
2015-12-28,
,
(中南大学药学院药理系,湖南 长沙 410078)
·文献综述·
胎盘胶原样凝集素1研究进展
夏丽莎,胡长平*
(中南大学药学院药理系,湖南 长沙 410078)
胎盘胶原样凝集素1(collectin placenta-1)即C型凝集素样清道夫受体,是一种Ⅱ型膜蛋白,其蛋白结构域融合胶原样凝集素和A型清道夫受体的结构特征,包括螺旋卷曲区、胶原样区、糖识别区(C型凝集素糖识别区)、颈区、胞浆区和跨膜区。胎盘胶原样凝集素1不仅能通过糖识别区和胶原样区的负电荷位点与病原微生物的糖类抗原结合直接发挥宿主防御功能,还能激活旁路补体途径间接参与机体固有免疫。此外,胎盘胶原样凝集素1通过摄取ox-LDL和清除β-淀粉样蛋白分别参与动脉粥样硬化和阿尔茨海默病的病理过程。
胶原样凝集素; 胎盘胶原样凝集素1; 免疫防御
胶原样凝集素(collectins)是一组含胶原序列的可溶性寡聚蛋白,属于C-型凝集素家族[1-2]。目前发现的胶原样凝集素共有6个亚组,分别为甘露聚糖结合凝集素(mannan-binding lectin,MBL)组,包括了血清型MBL(MBL-A)和肝型MBL(MBL-c);表面活性蛋白A(surfactant protein A,SP-A)组;表面活性蛋白D(surfactant protein D,SP-D)组,包括了SP-D、胶固素(conglutinin)、43千道尔顿胶原样凝素(collectin of 43 kDa,CL-43)、46千道尔顿胶原样凝素(collectin of 46 kDa,CL-46);肝胶原样凝集素(collectin liver 1,CL-L1)组;肾胶原样凝集素(collectin kidney 1,CL-K1)组以及胎盘胶原样凝集素(collectin placenta 1,CL-P1)组。胶原样凝集素家族成员在蛋白结构和生物学功能有共同之处,结构上共有胶原样区(collagen-like region,CLR)、N端富含半胱氨酸区、α螺旋区和糖识别区(carbohydrate recognition domain,CRD),而CRD决定胶原样凝集素识别微生物表面糖原从而发挥作用;功能上胶原样凝集素共有免疫防御作用,通过中和作用、凝集作用、调理作用和补体激活作用等抵抗病原微生物对机体的侵袭。在机体中,MBL主要通过激活补体途径,或是调理素作用起着免疫保护作用;SP-A和SP-D能与Toll样受体结合,参与调节肺部炎症反应[3];胶固素是甲型流感病毒的抑制剂,能够中和病毒并抑制红细胞凝聚而发挥抗病毒感染的作用。关于CL-P1的研究甚少,本文就CL-P1的分子结构、组织分布以及生物学功能进行综述。
1 CL-P1基因序列、蛋白结构及组织分布
CL-P1最先由Nakamura K等人发现,是从人类胎盘cDNA库里筛选出来的一个新型清道夫受体,依据其蛋白结构特点CL-P1最初被命名为C型凝集素样清道夫受体(scavenger receptor with C-type lectin,SRCL)。紧接着作者在鼠类胚胎cDNA库里找到了与人类CL-P1同源的蛋白,随后不同的研究者相继在斑马鱼等不同物种中发现CL-P1同源蛋白的存在,且CL-P1基因在人类、鼠类和斑马鱼等不同种属中的同源性极高,人鼠的Cl-P1基因同源性达到了91%[4]。在蛋白结构上,CL-P1融合A型清道夫受体(scavenger receptor class A,SR-AI)和胶原凝集素家族的蛋白结构特征,是含有螺旋卷曲区、胶原样区的Ⅱ型膜糖蛋白(图1)。CL-P1蛋白结构与SR-AI蛋白结构相比较,唯一的区别是SR-AI有富含半胱氨酸区域而CL-P1没有,将SR-AI富含半胱氨酸区域用CRD区替换,即转变为CL-P1。但是由于CL-P1有着胶原样凝集素家族典型的CRD结构,且其与巨噬细胞诱导的C型凝集素和枯否细胞受体具有高度同源性,CL-P1被归入了胶原样凝集素家族,CL-P1的名字也由此而来,也有研究者称其为COLEC12(collectin subfamily member 12),现在习惯称其为CL-P1。
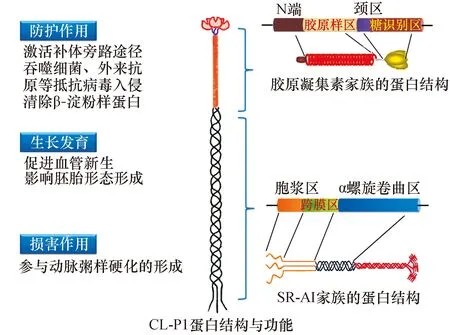
图1 胎盘胶原凝集素的结构及功能
CL-P1的基因位于18号染色体的p11.32区,人类CL-P1的cDNA序列总共有3058bp,开放阅读框有2226bp,翻译为742个氨基酸。其核苷序列从-3到4bp起始翻译,起始密码子是ATG,3′端有着典型的加尾信号(AATAA[A])。多肽结构包含螺旋卷曲区、胶原样区、糖识别区(C型凝集素糖识别区)、颈区、胞浆区、跨膜区,表明CL-P1蛋白质结构具有典型的胶原样凝集素的结构特点(具CLR和CRD),但是又与其他胶原样凝集素蛋白家族的结构不同,CL-P1还有着胞浆区、跨膜区,是一种Ⅱ型膜蛋白,且CL-P1的特异性糖配体与其他胶原样凝集素蛋白成员的糖配体不一样,不是甘露糖和葡萄糖(Glu-Pro-Asn)而是半乳糖(Gln-Pro-Asp)[5]。Ohtani K[6]等研究发现,CL-P1 mRNA在大部分器官织中表达,如胎盘、肺、心脏、肝脏等,对不同组织细胞的定位结果显示人或鼠的心血管内皮细胞(包括人脐静脉内皮细胞和人脐动脉内皮细胞)表达CL-P1 mRNA,而在巨噬细胞、单核细胞中不表达CL-P1 mRNA;CL-P1蛋白分子量约为140 kDa,去糖基化CL-P1分子量约为90 kDa。而Selman L等[7]研究表明,CL-P1在胎盘的细胞滋养层和合胞体滋养层中表达,还发现CL-P1在扁桃体基质细胞和肺泡的巨噬细胞中表达。虽然在CL-P1在巨噬细胞是否表达存在分歧,但不同的研究均发现CL-P1主要在胎盘表达。
2 CL-P1的生物学功能
2.1免疫防御功能免疫调节是一个高效、精细的生化过程,免疫系统能够识别和清除病原体等各种抗原,从而维护机体的正常运转。传统上,免疫过程分为两大类,一是固有免疫,通过组织屏障、固有免疫细胞、固有免疫分子(补体等)协同作用发挥清除抗原的作用;二是适应性免疫,是通过T细胞和B细胞识别特异性抗原的免疫过程。CL-P1具有免疫防御的作用,不仅参与固有免疫发挥免疫防御作用,也参与获得性免疫发挥重要作用。在固有免疫中,CL-P1促进酵母菌吞噬大肠杆菌和金黄色葡萄球菌等,能够与革兰阳性菌及革兰阴性菌、酵母菌结合,达到清除机体病原微生物的目的[8]。CL-P1亦可激活旁路补体途径,促进补体蛋白C3b、备解素以及膜攻击复合物在真菌表面的沉积[9]。真菌在补体的桥接下被巨噬细胞识别吞噬,这说明CL-P1也可以通过旁路补体途径参与固有免疫保护机体的过程。CL-P1也直接参与获得性免疫,增强机体免疫防御能力。CL-P1在骨髓微环境中呵护样细胞(nurse-like cell,促进T细胞的活化和分化)中亦有表达,其CRD区域能够与乙酰半乳糖胺、T抗体、Tn抗体结合,影响树突细胞和T细胞的抗原提呈,从而发挥宿主防御作用[10]。亲和色谱和蛋白质组学研究发现,CL-P1能够与有末端Lewis x (Lex,CD15)和N-乙酰氨基乳糖残基的中性粒细胞颗粒糖蛋白结合,当组织炎症引起中性粒细胞聚集时,内皮细胞中的CL-P1起着清除中性粒细胞颗粒糖蛋白的作用,随后这些颗粒糖蛋白被直接释放入血液中或是扩散进入血液循环;另一方面CL-P1可以间接清除水解酶和细胞因子(如基质金属酶蛋白)发挥保护作用[11]。
2.2参与动脉粥样硬化形成动脉粥样硬化是由脂蛋白、自由基、感染性微生物、剪切力等多因素诱导内皮功能紊乱进而在受累动脉内膜形成粥样斑块的过程。其病理过程的始动因素是内皮损伤,诱发单核-巨噬细胞、T细胞和平滑肌细胞募集到病变局部,这三种细胞共同参与动脉粥样硬化形成,T细胞能够识别ox-LDL等并释放促炎细胞因子;单核-巨噬细胞能表达大量清道夫受体,并通过清道夫受体摄取ox-LDL形成巨噬源性泡沫细胞;而血管平滑肌细胞迁入内膜后不仅能发生增殖、迁移形成纤维帽,还能吞噬ox-LDL形成泡沫细胞,最终ox-LDL负荷的泡沫细胞会坏死崩解,形成糜粥样的坏死物,即是粥样斑块的形成[12]。Doi T等[13]发现,转染CL-P1的中国仓鼠CHO细胞能摄取ox-LDL,但不能与Ac-LDL、LDL结合,表明CL-P1有可能与植物血凝集素样氧化型低密度脂蛋白受体(lectin-like oxidized low density lipoproteinrecaptor-1,LOX-1)一样在动脉粥样硬化形成和发展中起着调节ox-LDL的作用。LOX-1属于清道夫受体E家族,是内皮细胞功能障碍和动脉粥样硬化形成的关键因素,介导内皮细胞、单核细胞和巨噬细胞摄取、内吞和降解ox-LDL,导致泡沫细胞形成、平滑肌细胞纤维化和迁移以及斑块的形成[14-15]。Koyama S等[16]证明,人脐静脉内皮细胞在缺氧/复氧条件下以及小鼠颈动脉内膜在缺血再灌注时CL-P1表达显著增加。有趣的是,人脐静脉内皮细胞复氧72 h时CL-P1 mRNA表达开始上调,可持续至复氧后120h;小鼠颈动脉内膜复灌72 h后CL-P1 mRNA表达达到峰值,而7 d后CL-P1蛋白表达水平达到高峰。在人脐静脉内皮细胞,LOX-1 mRNA表达则是在复氧24 h时达到峰值。提示,CL-P1与LOX-1在动脉粥样硬化的形成中扮演着不同的角色。
最新研究发现,CL-P1摄取ox-LDL是通过其胞浆区的第三段酪氨酸基序Yxxφ与接头蛋白2(adaptor protein 2,AP2)的中亚基μ2结合募集网格蛋白,是一条依赖发动蛋白2(dynamin 2)的网格蛋白介导的内吞途径。进一步研究发现,转染CL-P1的中国仓鼠CHO细胞对不同氧化度(用CuSO4进行氧化,氧化时间分别为3、6、10、24 h)的ox-LDL结合率是不一样的,其与氧化3h的ox-LDL结合率明显低于氧化24 h的ox-LDL,但转染CL-P1的中国仓鼠CHO细胞摄取氧化3h和24 h的ox-LDL的量是相当的,这表明可能由于LDL氧化过程中其负电荷量或是化学结构发生了变化而造成其结合率不一致,且CL-P1摄取ox-LDL的位点应该不止是一个结构域,很可能四个功能结构域(CRD、颈区、胶原样区域、螺旋卷曲区)都参与了ox-LDL的摄取,从而造成了摄取量与ox-LDL的氧化度无关。更深入的研究发现,CL-P1通过两个功能结构域,螺旋卷曲区和胶原样区去摄取ox-LDL,且胶原样区域中的R496K499K502正电荷位点是发挥其生理学功能的主要位点[17-18]。
2.3抗阿尔茨海默病作用阿尔茨海默病(Alzheimer’s disease)是一种进行性神经变性痴呆症,其神经病理学主要特征是神经元内神经纤维缠结的形成和β-淀粉样蛋白(β-amyloid protein,Aβ)的沉积,其病理机制主要是淀粉样肽假说。该假说认为凝聚态Aβ在脑沉积启动病理过程,导致神经纤维缠绕、神经元丢失、老年斑形成和淀粉样血管病变。Nakamura等[19]在体内实验发现,APP/PS1双转基因阿尔茨海默病模型小鼠和阿尔茨海默病患者的脑组织中CL-P1表达上调;在体外实验中,星形胶质细胞、小胶质细胞、血管/血管周细胞中表达CL-P1,且用Aβ处理后,CL-P1的表达呈时间依赖性上升。而后,作者通过在CHO-K1细胞上定位CL-P1和纤维状β-淀粉样蛋白(fAβ1-42,人工合成的Aβ)发现CL-P1可以结合fAβ,提示CL-P1可能参与Aβ的清除。也有研究发现,SR-AI影响小胶质细胞和单核细胞粘附到β淀粉样蛋白,从而造成氧自由基的产生,使小胶质细胞内β淀粉样蛋白内化[20]。
2.4其他作用CL-P1除了发挥上述功能外,还与机体的生长发育及肿瘤的迁移相关。Fukuda等[21-22]在CL-P1基因敲除的斑马鱼研究发现,CL-P1与血管生成相关,其部分生物学功能与血管内皮生长因子(vascular endothelial growth factor,VEGF)类似,CL-P1基因敲除的斑马鱼出现形态学畸变,表现为体形短小、背主动脉和间血管缺少,甚至是完全缺失,而敲除VEGF及其受体的斑马鱼也会出现相似畸变。为了验证CL-P1与VEGF功能的相似性,在CL-P1基因敲除的斑马鱼过表达VEGF mRNA,结果斑马鱼的畸变减轻,这些结果提示CL-P1在斑马鱼胚胎时期影响血管生成[20]。Elola等[23]发现CL-P1选择性结合Lewis x (Lex,CD15),而Lex是在中性粒细胞和大部分肿瘤细胞(如肺癌和胸腺肿瘤)的糖复合物中特异性表达的一种细胞粘附分子,CL-P1与Lex结合能够介导肿瘤细胞粘附到新血管内皮细胞,发挥促肿瘤细胞黏附血管的作用,介导肿瘤细胞的迁移。
3 结论与展望
CL-P1的特殊蛋白结构决定其不仅有胶原样凝集素和A型清道夫受体的双重生物学功能,即在免疫防御以及动脉粥样硬化和阿尔茨海默病等疾病发生、发展中充当重要角色,而且其具有与胶原样凝集素或A型清道夫受体不同的功能,其有A型清道夫受体没有的MBL相关的丝氨酸蛋白酶(MASP)结合位点,能够激活旁路补体途径[24]。CL-P1具有多种生物学功能,能否作为新的药物治疗靶点值得深入研究。日本学者发现[25],CL-P1具有5个单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点:一个位于5′端上游区、两个位于内含子2区段、一个位于外显子5区段内、另外两个位于外显子6区段内,位于外显子6区段内的两个SNPs有着显著的连锁不平衡(r2>0.5),是否可用于疾病的预测和诊断也有待进一步的研究。
[1] Drickamer K.Two distinct classes of carbohydrate-recognition domains in animal lectins[J].J Biol Chem,1988,263(20):9557-9560.
[2] Hoppe HJ,Reid KB.Collectins--soluble proteins containing collagenous regions and lectin domains--and their roles in innate immunity[J].Protein Sci,1994,3(8):1143-1158.
[3] Ariki S,Nishitani C,Kuroki Y.Diverse functions of pulmonary collectins in host defense of the lung[J].J Biomed Biotechnol,2012,2012:7.
[4] Nakamura K,Funakoshi H,Tokunaga F,et al.Molecular cloning of a mouse scavenger receptor with C-type lectin (SRCL)(1),a novel member of the scavenger receptor family[J].Biochim Biophys Acta,2001,1522(1):53-58.
[5] Nakamura K,Funakoshi H,Miyamoto K,et al.Molecular cloning and functional characterization of a human scavenger receptor with C-type lectin (SRCL),a novel member of a scavenger receptor family[J].Biochem Biophys Res Commun,2001,280(4):1028-1035.
[6] Ohtani K,Suzuki Y,Eda S,et al.The membrane-type collectin CL-P1 is a scavenger receptor on vascular endothelial cells[J].J Biol Chem,2001,276(47):44222-44228.
[7] Selman L,Skjodt K,Nielsen O,et al.Expression and tissue localization of collectin placenta 1 (CL-P1,SRCL) in human tissues[J].Mol Immunol,2008,45(11):3278-3288.
[8] Jang S,Ohtani K,Fukuoh A,et al.Scavenger receptor collectin placenta 1 (CL-P1) predominantly mediates zymosan phagocytosis by human vascular endothelial cells[J].J Biol Chem,2009,284(6):3956-3965.
[9] Ma YJ,Skjoedt MO,Gaeerd P.Soluble collectin-12 (CL-P1) triggers activation of the alternative complement pathway[J].Mol Immunol,2013,240(56):316.
[10] Yoshida T,Tsuruta Y,Iwasaki M,et al.SRCL/CL-P1 recognizes GalNAc and a carcinoma-associated antigen,Tn antigen[J].J Biochem,2003,133(3):271-277.
[11] Graham SA,Antonopoulos A,Hitchen PG,et al.Identification of Neutrophil Granule Glycoproteins as Lewisx-containing Ligands Cleared by the Scavenger Receptor C-type Lectin[J].J Biol Chem,2011,286(27):24336-24349.
[12] Kzhyshkowska J,Neyen C,Gordon S.Role of macrophage scavenger receptors in atherosclerosis[J].Immunobiology,2012,217(5):492-502.
[13] Doi T,Kurasawa M,Higashino K,et al.The histidine interruption of an alpha-helical coiled coil allosterically mediates a pH-dependent ligand dissociation from macrophage scavenger receptors[J].J Biol Chem,1994,269(41):25598-25604.
[14] Ulrich-Merzenich G,Zeitler H.The lectin-like oxidized low-density lipoprotein receptor-1 as therapeutic target for atherosclerosis,inflammatory conditions and longevity[J].Expert Opin Ther Targets,2013,17(8):905-919.
[15] Taye A,El-Sheikh AA.Lectin-like oxidized low-density lipoprotein receptor 1 pathways[J].Eur J Clin Invest,2013,43(7):740-745.
[16] Koyama S,Ohtani K,Fukuzawa J,et al.The induction of human CL-P1 expression in hypoxia/reoxygenation culture condition and rat CL-P1 after ischemic/reperfusion treatment[J].Biochim Biophys Acta,2011,1810(9):836-842.
[17] Jang S,Ohtani K,Fukuoh A,et al.Scavenger receptor CL-P1 mediates endocytosis by associating with AP-2μ2[J].Biochim Biophys Acta,2014,1840(11):3226-3237.
[18] Mori K,Ohtani K,Jang S,et al.Scavenger receptor CL-P1 mainly utilizes a collagen-like domain to uptake microbes and modified LDL[J].Biochim Biophy Acta,2014,1840(12):3345-3356.
[19] Nakamura K,Ohya W,Funakoshi H,et al.Possible role of scavenger receptor SRCL in the clearance of amyloid-beta in Alzheimer’s disease[J].J Neurosci Res,2006,84(4):874-890.
[20] Cornejo F,von Bernhardi R.Role of scavenger receptors in glia-mediated neuroinflammatory response associated with Alzheimer’s disease[J].Mediators Inflamm,2013,2013:895651.
[21] Fukuda M,Ohtani K,Jang SJ,et al.Molecular cloning and functional analysis of scavenger receptor zebrafish CL-P1[J].Biochim Biophys Acta,2011,1810(12):1150-1159.
[22] Ohtani K,Suzuki Y,Wakamiya N.Biological functions of the novel collectins CL-L1,CL-K1,and CL-P1[J].J Biomed Biotechnol,2012:8.
[23] Elola MT,Capurro MI,Barrio MM,et al.Lewis x antigen mediates adhesion of human breast carcinoma cells to activated endothelium.Possible involvement of the endothelial scavenger receptor C-type lectin[J].Breast Cancer Res Treat,2007,101(2):161-174.
[24] Degn SE,Thiel S.Thiel,Humoral pattern recognition and the complement system[J].Scand J Immunol,2013,78(2):181-193.
[25] Ohmori H,Makita Y,Funamizu M,et al.Haplotype analysis of the human collectin placenta 1 (hCL-P1) gene[J].J Hum Genet,2003,48(2):82-85.
10.15972/j.cnki.43-1509/r.2015.04.029
2015-04-28;
2015-05-06
*通讯作者,E-mail:huchangping@yahoo.com.
R364.5
A
(此文编辑:秦旭平)
