Apelin-13促进骨髓间充质干细胞增殖
2015-12-28,,,,,
, , ,,,
(南华大学药物药理研究所,湖南 衡阳421001)
·基础医学·
Apelin-13促进骨髓间充质干细胞增殖
李兰芳,何璐,吴娣,伍乐乐,黄仕芳,陈临溪
(南华大学药物药理研究所,湖南 衡阳421001)
目的探讨apelin-13是否促进骨髓间充质干细胞增殖。方法分离和培养大鼠骨髓间充质干细胞,用不同浓度apelin-13(0.1 μmol/L、1.0 μmol/L和10.0 μmol/L)处理细胞24 h后,分别用流式细胞术和噻唑蓝比色法(MTT),观察apelin-13对骨髓间充质干细胞增殖的影响。结果倒置显微镜下观察到apelin-13促进大鼠骨髓间充质干细胞增殖,流式细胞术检测结果表明,apelin-13刺激后处于S期和G2-M期的细胞数目显著增加,G0-G1期的细胞数目显著减少。进一步MTT结果表明,apelin-13处理后大鼠骨髓间充质干细胞增殖显著增加,并呈浓度依赖性。结论apelin-13能促进骨髓间充质干细胞增殖。
apelin-13; APJ; 骨髓间充质干细胞; 增殖
1993年O’Down等[1]首次发现7次α螺旋的跨膜区段组成的G蛋白偶联受体APJ(apelin-angiotensin receptor-like,APJ)。1998年,Tatemoto等[2]从牛的胃蛋白提取并纯化APJ的内源性配体apelin。Apelin/APJ系统组织分布广泛,生物学功能多样。研究发现,Apelin具有舒张血管、降低血压、增强心肌收缩力、调节下丘脑—垂体激素释放、抑制抗利尿激素的释放、调节摄食摄水以及抵抗艾滋病毒侵入细胞等多种生物学效应。Apelin/APJ系统还参与糖尿病肾病、大血管并发症、视网膜新生血管的发展,是一种重要的生理调节肽。
Apelin/APJ系统具有促进细胞增殖的作用。Apelin在人的成骨细胞大量表达,可刺激成骨细胞的增殖。在鼠的胃上皮细胞含有大量Apelin,并证明在体外Apelin刺激胃上皮细胞的增殖。Apelin具有血管生成因子的作用,研究发现在视网膜血管内皮细胞中,Apelin-13和Apelin-36呈浓度依赖性促进细胞迁移、增殖和毛细血管形成。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)主要来源于骨髓组织,具有多向分化潜能,增殖迅速、可塑性、可移植性及自我更新能力强。在体外可被诱导分化为成骨细胞、脂肪细胞、血管内皮细胞、神经元样细胞等,这正是其多向分化潜能特点的体现。文献[3]报道apelin能够参与多种细胞增殖的过程,但apelin是否能影响骨髓间充质干细胞的增殖尚不清楚,也未见相关报道。本文旨在探究apelin是否促进骨髓间充质干细胞的增殖。
1 材料与方法
1.1试剂与材料Sprague-Dawley(SD)大鼠购自湖南农业大学动物部;Apelin-13多肽(057-19)购自美国Phoenix Biotech公司;培养基、血清、胰酶等均购自美国Gibco公司;MTT购自美国Sigma公司;GNP-9080隔水式恒温培养箱(上海精宏实验设备有限公司);流式细胞仪(美国Becton Dickinson公司);酶标仪(美国Labsystem Dragon公司)。
1.2大鼠骨髓间充质干细胞的分离与培养将SD大鼠浸泡于75%医用酒精中15 min,在无菌条件下切开大鼠组织,取股骨,去除表面软组织,冲出骨髓,接种于培养瓶。用含10%FBS的DMEM高糖培养基,37 ℃ 5%CO2培育箱中孵育培养。当培养的原代细胞生长密度达到70%~ 80%以上后,弃去原培养液,用PBS洗2次,加入0.05%胰蛋白酶消化液,放置于 CO2培养箱中孵育 5 min;用巴式吸管吸取培养基反复吹打培养瓶壁,当贴壁的细胞悬浮后,取悬浮液800 r/min离心8 min;弃去上清液,加入培养基,继续培养至细胞重新悬浮时,分瓶进行传代培养。倒置显微镜观察细胞生长状态。
1.3流式细胞术检测细胞周期将细胞以1×106cells/L接种于六孔板,直到细胞生长至70%~80%状态时,用含有0.1%胎牛血清胞培养24 h(细胞同步化),然后分别加入不同浓度apelin-13继续孵育24 h后用胰酶消化并收集细胞,PBS洗两遍,弃上清,加入1 mL 70%预冷乙醇中,吹打均匀,4℃固定12 h。PBS洗涤去乙醇,1 000 r/min,5 min,洗两遍。0.5 mL PBS重悬细胞,加入PI和 RNaseA至终浓度50 μg/mL,37℃ 温浴30 min,上流式细胞仪测定细胞周期。
1.2.3 MTT比色法测定细胞增殖 将细胞以1×106cells/L的浓度接种在96孔板中,直到细胞生长至70%~80%状态时,再用含有0.1%胎牛血清胞培养24 h(细胞同步化),然后分别加入不同浓度apelin-13继续孵育24 h,每孔加入浓度为5 g/L的MTT 20 μL,继续培养3 h,然后吸出孔内培养液后,加入DMSO在37℃中孵育15 min以后将其震荡混匀,再经酶联免疫检测仪测定OD值(570 nm处的检测波长)。

2 结 果
2.1倒置显微镜观察apelin-13对骨髓间充质干细胞增殖的影响分别采用不同浓度apelin-13(0.1 μmol/L、1.0 μmol/L和10.0 μmol/L)处理大鼠骨髓间充质干细胞24 h后,倒置显微镜下观察细胞增殖,结果提示:apelin-13显著促大鼠骨髓间充质干细胞的增殖(见图1)。
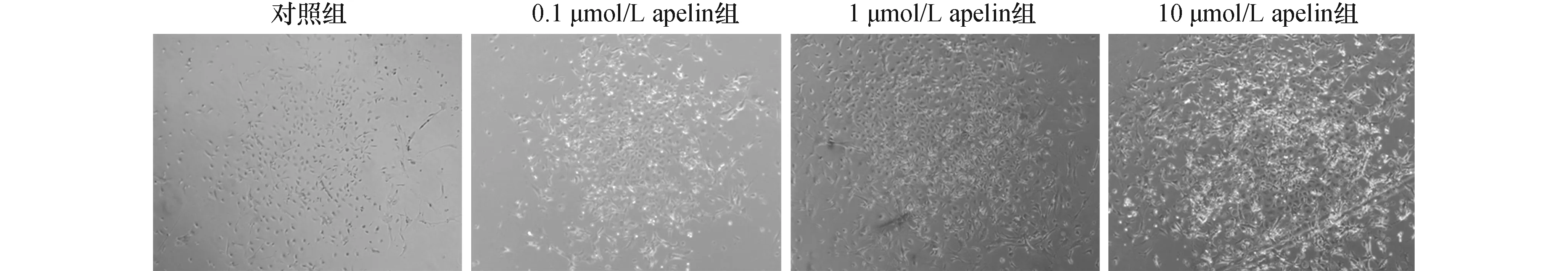
图1 不同浓度apelin-13对大鼠骨髓间充质干细胞增殖的影响
2.1流式细胞术检测apelin-13对骨髓间充质干细胞增殖的影响表1表明,与对照组相比较,apelin-13刺激后处于S期和G2-M期的细胞数目显著增加,G0-G1期的细胞数目显著减少。apelin-13刺激后增殖指数(PI)显著增加。提示: apelin-13显著促进大鼠骨髓间充质干细胞的增殖。
2.2 MTT法观察apelin-13对大鼠骨髓间基质干细胞增殖的影响图2表明apelin-13(0.1 μmol/L、1.0 μmol/L和10.0 μmol/L)处理大鼠骨髓间充质干细胞后,呈浓度依赖性促进细胞的增殖,且在apelin-13浓度为1 μmol/L时,与对照组比较差异有显著性,在apelin-13浓度为10 μmol/L时促增殖作用最显著。
表1不同浓度apelin-13对大鼠骨髓间充质干细胞增殖的影响(n=6)

组别G0~G1(%)S(%)G2~M(%)PI对照组94.60±0.252.80±0.122.60±0.360.054±0.0100.1μmol/LApelin组91.20±0.446.60±0.28a3.50±0.550.099±0.020a1.0μmol/LApelin组87.90±0.368.80±0.49b5.20±0.690.141±0.030b10.0μmol/LApelin组84.30±0.6211.90±2.37b6.90±0.820.182±0.060b
与对照组比较,a:P<0.05,b:P<0.01
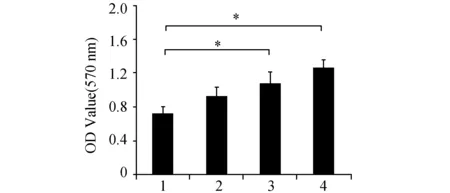
图2 apelin-13对大鼠骨髓间充质干细胞增殖的影响(n=6) 1:对照组;2~4分别为0.1、1.0和10.0 μmol/L apelin组. 与对照组比较,*:P<0.05
3 讨 论
血管紧张素受体样受体APJ是一种孤儿G蛋白偶联受体[1]。Apelin是APJ受体目前已知的唯一内源性配体[2]。大量实验表明,apelin促进血管平滑肌细胞、视网膜血管内皮细胞、胃腺上皮细胞、脂肪细胞、成骨细胞等增殖过程。这些线索提示apelin可能参与骨髓间充质干细胞的增殖。
骨髓间充质干细胞具有多向分化潜能,具有快速增殖的能力,可以在体外可被诱导分化为成骨细胞、脂肪细胞、血管内皮细胞、神经细胞等。骨髓间充质干细胞已在退行性及缺损性疾病、心血管疾病、肝移植、肺纤维化等疾病治疗方面取得良好效果。骨髓间充质干细胞的植入物具有修复动物骨缺损的能力。将人骨髓间充质干细胞在体外培养,并贴附于生物材料上修复大鼠股骨干骨缺损也取得了好的效果。骨髓间充质干细胞在心梗后既能促进新血管的形成又有分化为心肌细胞的能力。
Apelin促进细胞增殖[4-5],但apelin与骨髓间充质干细胞关系尚不清楚,本实验采用不同方法初步证明apelin-13促进骨髓间充质干细胞增殖。分别给予apelin-13(0.1 μmol/L、1 μmol/L、10 μmol/L)处理细胞24 h后,用流式细胞术和MTT比色法检测到apelin-13显著促进大鼠骨髓间充质干细胞的增殖,且在apelin-13浓度为1 μmol/L时,与对照组比较有显著性差异,10 μmol/L时增殖最显著。以上结果表明apelin-13呈浓度依赖性促骨髓间充质干细胞的增殖。
骨髓间充质干细胞具有易获得、易培养、低免疫原性、易于外源基因的转入和表达等特性,且具有自我更新能力,并能迅速增殖,在组织器官移植中具有重要的应用价值[6]。Apelin能促进骨髓间充质干细胞的增殖,因此,高表达apelin的骨髓间充质干细胞或许能作为理想的种子细胞被广泛应用于组织工程、细胞移植、基因治疗及器官移植等领域。但apelin是如何影响骨髓间充质干细胞增殖,其分子机制还有待将来的进一步探讨。
[1] O’Dowd BF,Heiber M,Chan A,et al.A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11[J].Gene,1993,136(1-2):355-360.
[2] Tatemoto K,Hosoya M,Habata Y,et al.Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J].Biochem Biophy Res Comm,1998,251(2):471-476.
[3] Li F,Li L,Qin X,et al.Apelin-induced vascular smooth muscle cell proliferation:the regulation of cyclin D1[J].Front Biosc,2008,13(5):3786-3792.
[4] Li L,Xie F.Jagged-1/Notch3 signaling transduction pathway is involved in apelin-13-induced vascular smooth muscle cells proliferation[J].Acta Bio Biophy Sin,2013,45(10):875-881.
[5] Yang L,Su T,Lv D,et al.ERK1/2 mediates lung adenocarcinoma cell proliferation and autophagy induced by apelin-13[J].Acta Bio Biophy Sin,2014,46(2):100-111.
[6] Wislet-Gendebien S,Hans G,Leprince P,et al.Plasticity of cultured mesenchymal stem cells:switch from nestin-positive to excitable neuron-like phenotype[J].Stem Cells,2005,23(3):392-402.
Apelin-13PromotesRatBoneMarrowMesenchymalStemCellsProliferation
LI Lanfang,HE Lu,WU Di,et al
(InstituteofPharmacyandPharmacology,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveApelin is the ligand of G-protein coupled receptor APJ.We aim to explore the effect of apelin-13 on the proliferation of rat bone marrow mesenchymal stem cells.MethodsRat bone marrow mesenchymal stem cells were isolated and cultured,and treated by different concentrations of apelin-13(0.1 μmol/L,1.0 μmol/L,10.0 μmol/L) for 24 hours.Cell proliferation was observed by flow cytometry and 3-(4,5-Dimethy lth iazol-2 -yl)-2,5-diphen yltetrazolium bromide (MTT) assay.ResultsApelin-13 decreased the proportion of cells in G0/G1 phase while increasing the number of cells in S and G2-M phases.MTT results showed that apelin-13 can significantly stimulate the proliferation of rat BMSCs in a concentration-dependent manner.ConclusionWe determine that apelin-13 stimulates the proliferation of rat BMSCs.
apelin-13; APJ; BMSCs; proliferation
10.15972/j.cnki.43-1509/r.2015.04.001
2014-07-31;
2014-11-22
国家自然科学基金(81270420),湖南省自然科学基金(青年基金)(14JJ3102)资助.
R96
A
(此文编辑:朱雯霞)
