细菌sRNA与抗菌药物的药理作用及耐药性
2015-12-28,
,
(中南大学药学院药理学系,湖南 长沙 410078)
·专家论坛·
细菌sRNA与抗菌药物的药理作用及耐药性
张旺,李元建*
(中南大学药学院药理学系,湖南 长沙 410078)
sRNA; 抗菌作用; 耐药性
非编码微小RNA即microRNA在细胞生长、增殖、分化、凋亡等生命过程中起重要的调控作用,几乎参与所有疾病的病理生理过程,为近年研究的热点课题。原核细胞也存在非编码RNA,称为小RNA(small non-coding RNA,sRNA)。sRNA作为一种应答元件,通过与靶mRNA碱基互补配对抑制靶基因mRNA翻译或(和)降解mRNA,在转录后水平调控细菌多种功能,影响细菌生长与繁殖[1,2]。虽然sRNA的发现(1967年)早于microRNA(1993年),但其功能研究却晚于后者。新近研究发现,细菌sRNA与抗菌药物的作用和耐药性密切相关。
1 sRNA的生物学特性
sRNA是一类广泛存在于原核生物,长度为50~300 nt的核苷酸。自1967年从大肠杆菌(Escherichia coli,E.coli)中分离出第一个sRNA(6SRNA)以来[3],经过半个世纪的研究,该细菌中已发现约100种sRNA[4],随后的研究证明其他细菌如沙门氏菌(salmonella)、金黄色葡萄球菌(Staphylococcus aureus,S.aureus)、铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)、单核细胞增生李斯特菌(Listeria monocytogenes,L.monocytogenes)、幽门螺旋杆菌(Helicobacter pylori,H.pylori)等同样存在sRNA[5-11]。
细菌sRNA的编码区主要位于基因间区(intergenic region,IGR),某些位于编码基因5′和3′非翻译区(untranslated regions,UTR)[12]。根据sRNA的调节作用不同可将sRNA分为4类:调节蛋白活性sRNA,顺式非编码sRNA(cis-encoded sRNA),反式非编码sRNA(trans-coded sRNA)和规律成簇的间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPRs)[8,13,14]。目前研究较多的为顺式非编码sRNA和反式非编码sRNA,其中顺式非编码sRNA由靶mRNA的反义链编码,存在一段序列与靶mRNA完全互补配对(配对碱基通常大于75 nt),具有高特异性、高亲和力的特点,而反式非编码sRNA其编码基因与靶mRNA相距较远[10,13,14]。原核生物中的sRNA作用方式类似于真核生物microRNA,通过不完全互补配对降解mRNA或(和)抑制mRNA的翻译[10,13,14],从而参与调节细菌的生长、繁殖。然而,细菌sRNA的结构、功能及作用机制与真核生物miRNA不完全相同(表1)。
表1真核生物miRNA与细菌sRNA的比较
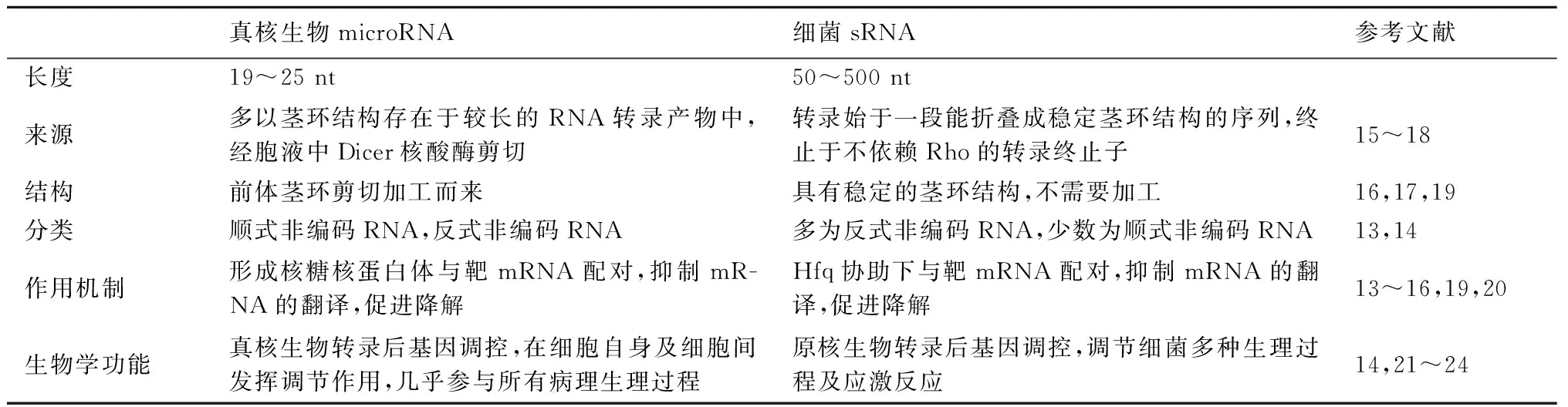
真核生物microRNA细菌sRNA参考文献长度19~25nt50~500nt来源多以茎环结构存在于较长的RNA转录产物中,经胞液中Dicer核酸酶剪切转录始于一段能折叠成稳定茎环结构的序列,终止于不依赖Rho的转录终止子15~18结构前体茎环剪切加工而来具有稳定的茎环结构,不需要加工16,17,19分类顺式非编码RNA,反式非编码RNA多为反式非编码RNA,少数为顺式非编码RNA13,14作用机制形成核糖核蛋白体与靶mRNA配对,抑制mR-NA的翻译,促进降解Hfq协助下与靶mRNA配对,抑制mRNA的翻译,促进降解13~16,19,20生物学功能真核生物转录后基因调控,在细胞自身及细胞间发挥调节作用,几乎参与所有病理生理过程原核生物转录后基因调控,调节细菌多种生理过程及应激反应14,21~24
研究发现,细菌sRNA的主要生物学功能之一是感应外界环境刺激,通过调控细胞代谢及应激反应以适应环境变化。例如,鲍曼不动杆菌(Acinetobacterbaumannii,A.baumannii)对温度和渗透压刺激的反应可能受AbsR25调节[25],而大肠杆菌对低温(低于25℃)刺激的反应则通过反式非编码的sRNA DsrA所调节[26];在ryhB基因敲除的伤寒沙门菌(Salmonella Typhimurium,S.Typhimurium),H2O2诱导的氧化应激显著增强,并证明OxyR能直接与ryhB相互作用,从而调节ryhB的表达[27]。有趣的是,sRNA还能参与抗菌药物的作用,并与细菌的耐药性密切相关,如阿奇霉素(2 μg/mL)能直接和间接抑制铜绿假单胞菌rsmY/Z的表达,阻断细菌的群体感应及生物被膜的形成[28];鲍曼不动杆菌AbsR25能调节药物外流蛋白编码基因的表达[25]。
2 sRNA介导抗菌药物的杀菌作用
抗菌药物可特异性地干扰细菌的生长代谢过程(包括阻断DNA复制和RNA合成,抑制蛋白合成与代谢酶活性),破坏其结构与功能,产生杀菌或抑菌效应。基于sRNA对细菌生长与繁殖起重要的调控作用,人们推测sRNA可能是寻找抗菌药物的新靶点。研究发现,洋葱伯克霍尔德杆菌(Burkholderia cenocepacia,B.cenocepacia)sRNA mtvR过表达能显著降低阿米卡星和庆大霉素的最小抑菌浓度(分别降低了7倍和4倍)以及显著提高β-内酰胺类抗生素(头孢他啶和亚胺培南)的敏感性(分别提高了3倍和4倍)[29]。大肠杆菌sRNA ryhB能促进CirA表达,后者与其配体大肠菌素Ia结合诱导靶细胞死亡;研究发现,ryhB及cirA缺失突变菌株,大肠菌素Ia处理诱导细菌死亡的作用被取消[30]。在金黄色葡萄球菌,sRNA SprX过表达显著提高金黄色葡萄球菌对糖肽类抗生素的敏感性,其机制是通过L3环调节第V阶段产孢蛋白G(stage V sporulation protein G,SpoVG)而发挥作用[31]。阿奇霉素(2 μg/mL)能直接和间接抑制铜绿假单胞菌rsmY/Z的表达,阻断细菌的群体感应及生物被膜的形成,可能是该药的杀菌机制之一[29]。上述研究表明,某些抗菌药物通过影响细菌sRNA的表达而调控相关基因的表达,从而提高细菌对药物的敏感性,发挥抗菌作用。sRNA介导抗菌药物的作用加深了对某些药物作用机制的认识,并为寻找抗菌药物提供新思路。例如,主要影响蛋白质合成的阿奇霉素也能下调sRNA(RsmY/Z)的表达而损伤细胞膜的功能[29]。已知多种杀菌药物(氨苄西林,卡那霉素,诺氟沙星及万古霉素)杀菌机制涉及氧化应激反应[32],但其确切机制尚未明了。鼠伤寒沙门菌(Salmonella enterica sv.Typhimurium)sRNA ryhB-1和ryhB-2缺失可导致细菌内活性氧(Reactive oxygen species,ROS)水平增加[27]。治疗伤寒的氨苄西林等药物诱导氧化应激是否通过影响sRNA表达而发挥作用有待研究。抗菌药物依据作用机制不同分为干扰细菌细胞壁的合成,改变细胞膜通透性,抑制蛋白合成,影响核酸及叶酸代谢5大类,sRNA是否独立于上述抗菌药物的作用机制,以及与这些抗菌机制的关系值得研究。
许多抗菌药物如抗生素为细菌的二级代谢产物,约2/3的天然抗生素从天蓝色链霉菌(Streptomyces coelicolor,S.coelicolor)中获得。另一方面,某些细菌的二级代谢产物能杀灭与其寄生于同一宿主的其他细菌,例如荧光假单胞菌(Pseudomonas fluorescens,P.fluorescens)能分泌氰化氢、AprA外切蛋白酶和2,4-二乙酰基间苯三酚,这些二级代谢产物能杀灭寄生于同一植物根际的真菌。sRNA能调控二级代谢产物的表达,可能是寻找抗菌药物的新途径。例如,在天蓝色链霉菌过表达sRNA scr239和cnc2189.1可显著减少二级代谢抗生素放线紫红素的生成,而敲除菌株中生成则增加[33]。三羧酸循环的中间产物能有效调节荧光假单胞菌GacS-GacA二元信号系统依赖的sRNA(RsmX、RsmY和RsmZ),进而调节二级代谢产物的生成和抗菌活性[34]。
3 sRNA与细菌耐药性
无论是真核细胞还是原核细胞,对外界刺激产生适应性变化是其固有特性,而sRNA在调节细菌适应性中起重要作用。细菌耐药性是细菌对抗菌药物的自然反应,长时间高浓度接触抗菌药物,细菌可通过改变自身结构或状态(改变药物作用靶位结构,影响生物被膜通透性及提高药物转运蛋白活性)产生获得性耐药。sRNA作为细菌广泛存在的调节元件,调节细菌对抗生素的适应性而介导细菌耐药。Jing Y,等[6]首次报道了抗菌药物对细菌sRNA表达的影响,基因芯片结果显示,利奈唑胺等四种药物处理多重耐药金黄色葡萄球菌(Multidrug-Resistant Staphylococcus aureus,MRSA)后,39个sRNA表达变化显著。其他学者也证明多种抗菌药物的耐药性与sRNA表达变化有关,如替加环素处理诱导伤寒沙门菌sRNA表达,其中sYJ20可能参与伤寒沙门菌对替加环素的耐药[5];生物信息学预测,鲍曼不动杆菌sRNA AbsR25的靶基因中有3个与药物转运相关[25]。在大肠杆菌中,sRNA ralR及其靶基因ralA双缺失突变菌株对磷霉素的敏感性显著高于野生型菌株[35];两性霉素B的耐药涉及PhoP/PhoQ二元信号系统,后者通过sRNA mgrR负性调节耐药相关基因eptB[36];氨苄西林诱导sRNA sdsR的表达,后者与DNA错配修复基因mutS碱基互补配对而抑制细菌的错配修复,从而导致大肠杆菌耐药[37]。然而,sRNA调控某些细菌耐药的确切机制尚未完全阐明,且与已知的耐药机制之间的关系也尚待研究。
4 结 语
新近研究表明细菌sRNA不但在细菌的生长、繁殖等生物学过程中发挥重要作用,也介导了抗菌药物的杀菌作用,这为进一步研究抗菌药物的作用机制及寻找抗菌新药提供了思路。另一方面,sRNA在细菌对外界适应性变化中起重要调节作用,为阐明细菌耐药性提供了新的解释。然而,有关sRNA介导抗菌药物的作用及耐药性的研究目前仍处于起步阶段,还有许多问题有待深入探讨:① sRNA介导抗菌药物的作用及细菌耐药机制尚未完全阐明,包括sRNA的种类及其上、下游的调控机制;② sRNA的生物学效应依赖于分子伴侣Hfq,sRNA与Hfq相互作用的认识还有存在争议,Hfq能促进sRNA与靶mRNA的结合并形成稳定sRNA-mRNA复合物,另有学者认为,Hfq能与sRNA竞争结合靶mRNA而抑制靶mRNA的表达和翻译[30],阐明两者相互作用有助于认识sRNA的作用机制;③已知真核细胞能主动分泌miRNA,发挥临近细胞与远程调节作用[22]。细菌也能分泌sRNA[38,39],但分泌型sRNA的生物学意义尚不清楚。随着研究的深入,对sRNA的生物学及药理学的认识必将获得更大进步。
[1] Storz G,Vogel J,Wassarman KM.Regulation by Small RNAs in Bacteria:Expanding Frontiers[J].Mol Cell,2011,43(6):880-891.
[2] De Lay N,Schu DJ,Gottesman S.Bacterial small RNA-based negative regulation:Hfq and its accomplices[J].J Biol Chem,2013,288(12):7996-8003.
[3] Wassarman KM.6S RNA:a small RNA regulator of transcription[J].Curr Opin Microbiol,2007,10(2):164-168.
[4] Lalaouna D,Simoneau-Roy M,Lafontaine D,et al.Regulatory RNAs and target mRNA decay in prokaryotes[J].Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms,2013,1829(6-7):742-747.
[5] Papenfort K,Vogel J.Regulatory RNA in bacterial pathogens[J].Cell Host Microbe,2010,8(1):116-127.
[6] Yu J,Schneiders T.Tigecycline challenge triggers sRNA production in Salmonella enterica serovar Typhimurium[J].BMC Microbiol,2012,12(1):195-208.
[7] Howden BP,Beaume M,Harrison PF,et al.Analysis of the small RNA transcriptional response in multidrug-resistant staphylococcus aureus after antimicrobial exposure[J].Antimicrob Agents Chemother,2013,57(8):3864-3874.
[8] Sonnleitner E,Romeo A,Bläsi U.Small regulatory RNAs in Pseudomonas aeruginosa[J].RNA Biol,2012,9(4):364-371.
[9] Sharma CM,Hoffmann S,Darfeuille F,et al.The primary transcriptome of the major human pathogen Helicobacter pylori[J].Nature,2010,464(7286):250-255.
[10] Wen Y,Feng J,Sachs G.Helicobacter pylori 5′ureB-sRNA,a cis-encoded antisense small RNA,negatively regulates ureAB expression by transcription termination[J].J Bacteriol,2013,195(3):444-452.
[11] Pernitzsch SR,Tirier SM,Beier D,et al.A variable homopolymeric G-repeat defines small RNA-mediated posttranscriptional regulation of a chemotaxis receptor in Helicobacter pylori[J].Proc Natl Acad Sci USA,2014,111(4):501-510.
[12] Kawano M,Reynolds AA,Miranda-Rios J,et al.Detection of 5′-and 3′-UTR-derived small RNAs and cis-encoded antisense RNAs in Escherichia coli[J].Nucleic Acids Res,2005,33(3):1040-1050.
[13] Waters LS,Storz G.Regulatory RNAs in Bacteria[J].Cell,2009,136(4):615-628.
[14] Michaux C,Verneuil N,Hartke A,et al.Physiological roles of small RNA molecules[J].Microbiology,2014,160(Pt6):1007-1019.
[15] Bartel DP.MicroRNAs:eenomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[16] 张炜,童贻刚,冯福民.细菌非编码小 RNA 研究进展[J].微生物学通报,2009,36(7):1025-1030.
[17] 生秀梅,徐顺高,张海方,等.细菌小 RNA 的研究[J].生命的化学,2010,30(6):815-820.
[18] Ishiguro H,Kimura M,Takeyama H.Role of microRNAs in gastric cancer[J].World J Gastroenterol,2014,20(19):5694-5699.
[19] Olson EN.MicroRNAs as Therapeutic Targets and Biomarkers of Cardiovascular Disease[J].Sci Transl Med,2014,6(239):239ps3.
[20] Brantl S,Brückner R.Small regulatory RNAs from low-GC Gram-positive bacteria[J].RNA Biol,2014,11(5):443-456.
[21] Chivukula RR,Shi G,Acharya A,et al.An Essential Mesenchymal Function for miR-143/145 in Intestinal Epithelial Regeneration[J].Cell,2014,157(5):1104-1116.
[22] Liang H,Zen K,Zhang J,et al.New roles for microRNAs in cross-species communication[J].RNA Biol,2013,10(3):367-370.
[23] 战嵛华,马尧,邓志平,等.非编码 RNAs 在细菌代谢网络调控中的研究进展[J].生物技术进展,2012,1(6):413-420.
[24] Balasubramanian D,Schneper L,Kumari H,et al.A dynamic and intricate regulatory network determines Pseudomonas aeruginosa virulence[J].Nucleic Acids Res,2013,41(1):1-20.
[25] Sharma R,Arya S,Patil SD,et al.Identification of novel regulatory small RNAs in acinetobacter baumannii[J].PLoS One,2014,9(4):e93833.
[26] Hämmerle H,Vcˇerek B,Resch A,et al.Duplex formation between the sRNA DsrA and rpoS mRNA is not sufficient for efficient RpoS synthesis at low temperature[J].RNA Biol,2013,10(12):1834-1841.
[27] Calderón IL,Morales EH,Collao B,et al.Role of salmonella typhimurium small RNAs RyhB-1 and RyhB-2 in the oxidative stress response[J].Res Microbiol,2014,165(1):30-40.
[28] Pérez-Martínez I,Haas D.Azithromycin inhibits expression of the GacA-Dependent small RNAs RsmY and RsmZ in pseudomonas aeruginosa[J].Antimicrob Agents Chemother,2011,55(7):3399-3405.
[29] Ramos CG,Grilo AM,da Costa PJ,et al.MtvR Is a Global small noncoding regulatory RNA in burkholderia cenocepacia[J].J Bacteriol,2013,195(16):3514-3523.
[30] Salvail H,Caron MP,Bélanger J,et al.Antagonistic functions between the RNA chaperone Hfq and an sRNA regulate sensitivity to the antibiotic colicin[J].EMBO J,2013,32(20):2764-2778.
[31] Eyraud A,Tattevin P,Chabelskaya S,et al.A small RNA controls a protein regulator involved in antibiotic resistance in Staphylococcus aureus[J].Nucleic Acids Res,2014,42(8):4892-4905.
[32] Kohanski MA,Dwyer DJ,Hayete B,et al.A common mechanism of cellular death induced by bactericidal antibiotics[J].Cell,2007,130(5):797-810.
[33] Vockenhuber MP,Suess B.Streptomyces coelicolor sRNA scr5239 inhibits agarase expression by direct base pairing to the dagA coding region[J].Microbiology,2012,158(Pt2):424-435.
[34] Takeuchi K,Kiefer P,Reimmann C,et al.Small RNA-dependent expression of secondary metabolism Is controlled by krebs cycle function in pseudomonas fluorescens[J].J Biol Chem,2009,284(50):34976-34985.
[35] Guo Y,Quiroga C,Chen Q,et al.RalR (a DNase) and RalA (a small RNA) form a type I toxin-antitoxin system in Escherichia coli[J].Nucleic Acids Res,2014,42(10):6448-6462.
[36] Moon K,Gottesman S.A PhoQ/P-regulated small RNA regulates sensitivity of Escherichia coli to antimicrobial peptides[J].Mol Microbiol,2009,74(6):1314-1330.
[37] Gutierrez A,Laureti L,Crussard S,et al.β-lactam antibiotics promote bacterial mutagenesis via an RpoS-mediated reduction in replication fidelity[J].Nat Commun,2013,4:1610-1618.
[38] Ando T,Suzuki H,Nishimura S,et al.Characterization of extracellular RNAs produced by the marine photosynthetic bacterium rhodovulum sulfidophilum[J].J Biochem,2006,139(4):805-811.
[39] 唐立,凌宗欣,文姝.乳杆菌对数生长期培养基滤液核酸组分分析[J].中国微生态学杂志,2011,23(2):104-106.
10.15972/j.cnki.43-1509/r.2015.01.001
2014-08-26;
2014-09-20
国家自然科学基金(81273513).
*通讯作者,E-mail:yuan_jianli@yahoo.com.

李元建 教授
专家简介: 李元建,男,药理学教授,博士生导师。享受政府特殊津贴,卫生部有突出贡献的中青年专家。兼任湖南省心血管研究重点实验室主任。《国际病理科学与临床杂志》主编,《中国药理学与毒理学杂志》、《中国动脉硬化杂志》、《中南大学学报—医学版》等杂志编委。主编与参编教材或专著11部。先后获卫生部青年科研基金、美国心脏学会博士后资助、教育部优秀年轻教师基金及重点跟踪资助、教育部跨世纪优秀人才培养计划基金、教育部重大项目、国家自然科学基金面上与重点项目、973项目子课题、湖南省自然科学基金、湖南省重点实验室基金等20余项基金。科研方向为心血管药理,主要研究内容为心血管新药研发及药物作用机制。先后获省部级科研成果16项。指导的研究生获全国博士论文奖1人,全国优秀博士论文提名奖5人。发表科研论文260余篇,其中被SCI收录论文210篇。
R966
A
(此文编辑:秦旭平)
