金黄色葡萄球菌tst-1基因敲除菌株的构建
2015-12-27李胜军张晓清吕昌龙
李胜军, 张晓清, 尉 冰, 张 荻, 吕昌龙
(1. 中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2. 中国医科大学口腔医学院 口腔修复学教研室 辽宁 沈阳 110001)
金黄色葡萄球菌tst-1基因敲除菌株的构建
李胜军1, 张晓清1, 尉 冰1, 张 荻2, 吕昌龙1
(1. 中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2. 中国医科大学口腔医学院 口腔修复学教研室 辽宁 沈阳 110001)
抽提金黄色葡萄球菌834菌株的基因组DNA,PCR克隆扩增tst-1及tst-1的上、下游基因,通过将tst-1上、下游基因分别重组到载体质粒pAULA中,形成同源重组质粒pAULA-Δtst-1,将pAULA-Δtst-1电转入细菌内,进行同源重组,以PCR、Western blot鉴定tst-1基因敲除菌株无tst-1基因片段,且无TSST-1蛋白表达,表明已成功构建金黄色葡萄球菌tst-1基因的敲除菌株。
金黄色葡萄球菌;tst-1;基因敲除
金黄色葡萄球菌(Staphylococcusaureus,SA)是人类的主要致病菌[1],可引起各种类型的化脓性感染,如蜂窝组织炎、肺炎、骨髓炎、感染性心内膜炎、败血症、中毒性休克综合征、肠炎等[2-3]。 金黄色葡萄球菌可产生多种与致病力有关的毒素,如肠毒素(enterotoxin)、毒性休克综合征毒素I(toxic shock syndrome toxin I,TSST-1)、葡萄球菌溶血素(staphylolysin)等[4]。TSST-1是由噬菌体I群金黄色葡萄球菌产生的超抗原外毒素,属于致热原性超抗原家族,分子量约22 ku[5-6]。TSST-1能引起中毒性休克综合征(toxic shock syndrome,TSS),导致患者发热、低血压、多器官衰竭,有必要加深对TSST-1在SA感染中的致病机理的了解。本研究提取金黄色葡萄球菌的基因组,以PCR方法扩增TSST-1编码基因tst-1及其上游基因SAB0359、下游基因SAB0361,构建基因敲除质粒,进而以同源重组方法构建金黄色葡萄球菌834菌株的tst-1敲除菌株,以研究金黄色葡萄球菌的致病机制及TSST-1的功能。
1 材料与方法
1.1 材料
1.1.1 动物 8周龄的雌性C57BL/6小鼠20只(辽宁长生生物技术有限公司,动物许可证号:SCXK辽2010-0001),随机分为金黄色葡萄球菌834菌株组和金黄色葡萄球菌834菌株的tst-1敲除菌株组,每组10只。
1.1.2 菌株、质粒及培养基 金黄色葡萄球菌834标准株(SA 834), 大肠埃希菌DH5α菌株, pCRII质粒、pAULA质粒(中国医科大学免疫学教研室)。TSB (Tryptic Soy broth) 培养基、LB (Luria-Bertani)培养基 (BD 公司)。
1.1.3 实验试剂BamHI、KpnI、SalI (限制性内切酶,TaKaRa公司),DM2000、DM10000(DNA Marker,北京康为世纪生物科技有限公司),T4 DNA ligase(Promega公司),碱性磷酸酶(TaKaRa公司),基因组DNA小量抽提试剂盒(碧云天生物技术研究所), 细菌PCR试剂盒(GENERON公司),DNA凝胶回收试剂盒(碧云天生物技术研究所), Plasmid mini kit I(Omega公司),Western blot试剂盒(蓝基生物科技)。
1.1.4 实验仪器 PTC-200型PCR仪(MJ RESEARCH公司),MUPID电泳仪(Advance公司), GDS-8000型全自动凝胶成像分析仪(UVP公司)。
1.2 方法
1.2.1 制备金黄色葡萄球菌834标准株基因组DNA SA 834经TSB培养基37 ℃恒温振荡过夜培养,收集菌体,使用基因组DNA抽提试剂盒抽提基因组DNA。
1.2.2 克隆、扩增tst-1及其上下游基因片段(SAB0359、SAB0361) 以基因组DNA为模板, 采用正向引物和反向引物(表1)进行PCR扩增,反应条件: 94 ℃ 4 min, 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 55 s, 72 ℃ 4 min,共29个循环。PCR产物电泳后,回收目的基因片段。连接回收的基因片段与载体质粒pCRII,转化入大肠埃希菌DH5α菌株, 在平板培养后筛选阳性克隆,在37 ℃恒温振荡条件下培养24 h, 从培养后的大肠埃希菌中提取质粒,并分别命名为pCRII-tst-1、pCRII-SAB0359、pCRII-SAB0361。分别以限制性内切酶KpnI、BamHⅠ和BamHⅠ、SalI双酶切3种质粒,电泳后回收目的基因片段。
1.2.3 构建敲除质粒 以限制性内切酶KpnI、BamHⅠ双酶切载体质粒pAULA, 在pAULA线性化后,以碱性磷酸酶使pAULA线性化载体质粒尾端去磷酸化,回收、纯化pAULA线性化载体质粒。连接SAB0359片段与pAULA线性化载体质粒。回收连接物,常规转化大肠埃希菌DH5α,以KpnI、BamHⅠ限制性内切酶双酶切鉴定连接成功的质粒,并命名为pAULA-SAB0359。以同样的方法,在用BamHⅠ、SalI限制性内切酶双酶切pAULA-SAB0359后,连接SAB0361片段与pAULA-SAB0359线性化载体质粒,获得pAULA-Δtst-1敲除质粒。

表1 研究中所用引物序列
1.2.4 构建基因敲除菌株 将pAULA-Δtst-1敲除质粒电转入SA 834,反应条件为2.5 kV、5 ms,以LB-Em培养基筛选出温度敏感突变株(Δtst)[7]。
1.2.5 蛋白质的提取与鉴定 以TSB培养基在37 ℃下振荡培养SA 834、Δtst,24 h后回收细菌,细菌裂解后,离心并取上清液,进行蛋白定量,然后以Western blot方法鉴定TSST-1。
1.2.6 生存率分析 将SA 834、Δtst浓度调整为2×107cfu/mL,分别尾静脉注射0.1 mL至小鼠体内,观察小鼠14 d生存率。
2 结果与分析
2.1tst-1及其上下游基因片段的克隆、扩增及鉴定
将PCR扩增的tst-1、SAB0359、SAB0361与 pCRII连接后,常规转化大肠埃希菌DH5α,从LB-Amp-X-gal选择性平板上挑取单个生长的白色菌落,扩增后小量抽提质粒,双酶切后以琼脂糖凝胶电泳检测基因片段。检测结果证明已成功地克隆出tst-1(678 bp)、SAB0359(570 bp)、SAB0361(327 bp)基因片段 (见图1)。
2.2 敲除质粒的构建、鉴定
以KpnⅠ和SacⅠ酶切鉴定敲除质粒,在琼脂糖凝胶上可见敲除质粒的2个条带:897 bp条带和未切完全的原质粒(约9 kb) 条带(见图2) 。
2.3 敲除菌株的鉴定
采用tst基因正向、反向引物,PCR扩增SA 834、Δtst基因组DNA,PCR产物的电泳结果显示:SA 834有tst基因片段,Δtst无tst基因片段(图3)。收集并裂解过夜培养的SA 834、Δtst,离心并取上清液,蛋白定量后以Western blot方法检测TSST-1,检测结果显示SA 834有TSST-1表达,Δtst无TSST-1表达(图4)。

图1 PCR扩增的tst-1、SAB0359、SAB0361序列Fig.1 PCR amplification of tst-1, SAB0359, and SAB03611:DM2 000 marker; 2:tst-1; 3:SAB0359; 4:SAB0361
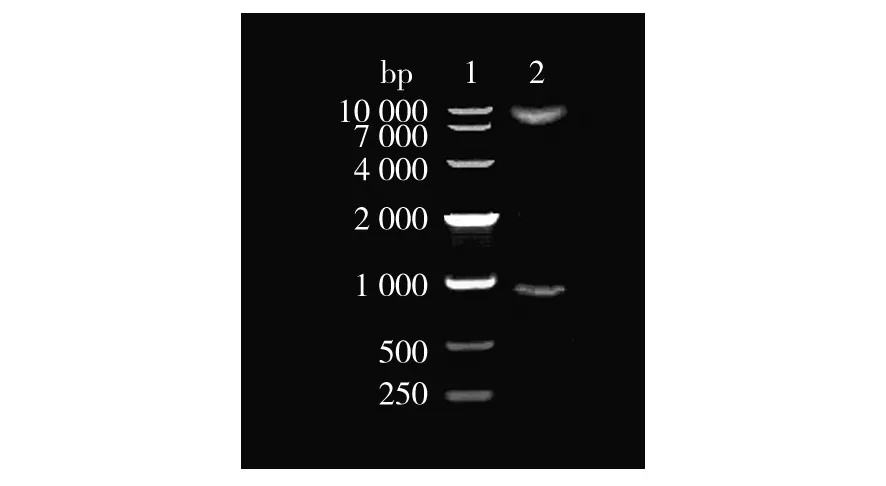
图2 对敲除质粒pAULA-Δtst-1的限制性酶切分析Fig.2 Restriction enzyme digestion analysis of pAULA-Δtst-11:DM10 000 marker; 2:pAULA-Δtst-1

图3 PCR扩增的SA 834、Δtst-1的tst-1序列Fig.3 PCR amplification of tst-1 in SA 834 orΔtst-1

图4 SA 834、Δtst-1的TSST-1表达的Western blot检测Fig.4 Western blot analysis of TSST-1 in SA834 or Δtst-1
2.4 敲除菌株生长特性的鉴定
过夜培养SA 834、Δtst,调整培养液的浓度至OD600为1.0,取5 mL接种到100 mL TSB培养基中,37 ℃恒温振荡培养24 h,分别在0、1、2、4、6、12、24 h检测菌体的生长情况,敲除菌株与标准菌株生长趋势基本一致(图5)。
2.5 敲除菌株生存率的观察
过夜培养SA 834、Δtst,调整菌液的浓度至2×107cfu/mL,分别取0.1 mL菌液,尾静脉注射至小鼠体内,观察小鼠14 d生存率(图6)。

图5 SA 834、Δtst-1的生长曲线Fig.5 Growth curve of SA 834,Δtst-1

图6 SA 834、Δtst-1感染小鼠的生存率Fig.6 Survival rate of mice infected with SA 834,Δtst-1
3 讨 论
许多研究指出,在金黄色葡萄球菌的感染过程中,金黄色葡萄球菌黏附宿主细胞,金黄色葡萄球菌逃避宿主免疫机制,以及金黄色葡萄球菌在宿主细胞内的生存和增殖都发挥着重要的作用[7-9]。
鉴于TSST-1是SA的重要致病因子,有必要阐明TSST-1在SA侵袭细胞中所发挥的作用。为此,本研究在已经表达、提纯重组TSST-1蛋白的基础上,以PCR的方法扩增SA 834的tst-1基因及其上、下游的SAB0359、SAB0361基因,并构建pAULA-Δtst-1基因敲除质粒, 将pAULA-Δtst-1转入SA 834后,以同源重组方法构建了金黄色葡萄球菌的tst-1基因敲除菌株(Δtst-1)。本研究有助于将来进一步阐明TSST-1在金黄色葡萄球菌感染机制中所发挥的作用。
[1] Deleo FR, Otto M, Kreiswirth BN, et al. Community-associated meticillin-resistantStaphylococcusaureus[J]. Lancet,2010, 375:1557-1568.
[2] Lowy FD.Staphylococcusaureusinfections[J]. N Engl J Med,1998,339(8):520-532.
[3] Kulhankova K1, King J, Salgado-Pabón W. Staphylococcal toxic shock syndrome: superantigen-mediated enhancement of endotoxin shock and adaptive immune suppression[J]. Immunol Res,2014, 59(1-3):182-187.
[4] Dinges MM, Orwin PM, Schlievert PM. Exotoxins ofStaphylococcusaureus[J].Clin Microbiol Rev,2000, 13(1):16-34.
[5] Li SJ, Hu DL, Maina EK, et al. Superantigenic activity of toxic shock syndrome toxin-1 is resistant to heating and digestive enzymes[J]. J Appl Microbiol,2011, 110(3):729-736.
[6] Thomas D, Dauwalder O, Brun V, et al.Staphylococcusaureussuperantigens elicit redundant and extensive human Vbeta patterns[J]. Infect Immun,2009, 77(5):2043-2050.
[7] Schaefers MM, Breshears LM, Anderson MJ, et al. Epithelial proinflammatory response and curcumin-mediated protection from staphylococcal toxic shock syndrome toxin-1[J]. PLoS One,2012, 7(3):e32813.
[8] Sachse F, Becker K, von Eiff C, et al.Staphylococcusaureusinvades the epithelium in nasal polyposis and induces IL-6 in nasal epithelial cellsinvitro[J]. Allergy,2010, 65(11):1430-1437.
[9] Foster TJ. Colonization and infection of the human host by staphylococci: adhesion, survival and immune evasion[J]. Vet Dermatol,2009, 20(5-6):456-470.
Construction oftst-1-deletion mutant ofStaphylococcusaureus
LI Sheng-jun1, ZHANG Xiao-qing1, WEI Bing1, ZHANG Di2, Lü Chang-long1
(1.Teach. &Res.Div.ofImmun.,Coll.ofBasicMed.Sci.,Shengyang110122; 2.Teach. &Res.Div.ofProstheticDentistry,Coll.ofDentalMed.,ChinaMed.Uni.,Shenyang110001)
The genomic DNA ofStaphylococcusaureusstrain 834 was extracted. Thetst-1 gene and it ’s upstream, downstream genes ofS.aureuswere amplified with PCR and cloned into plasmid pCRII. The upstream, downstream genes oftst-1 gene were inserted into plasmid pAULA to form homogenous recombinant plasmid pAULA-Δtst-1. The pAULA-Δtst-1 was electroporated intoS.aureusto carry out homogenous recombination. Thetst-1-deletion mutant ofS.aureuswas characterized with PCR, Western blot for non-tst-1 fragment, no TSST-1 protein expression was found, suggested that the construction oftst-1-deletion mutant ofS.aureuswas successful.
Staphylococcusaureus;tst-1;gene knockout
辽宁省博士科研启动基金项目(20111109)
李胜军 男,副研究员,博士。研究方向为粘膜免疫与感染免疫。 E-mail: lsj73@hotmail.com
2014-09-23;
2014-11-06
Q939.1;R61
A
1005-7021(2015)06-0056-04
10.3969/j.issn.1005-7021.2015.06.010
