高级别宫颈鳞状上皮内病变患者宫颈环形电切术后病理阴性的相关因素分析
2015-12-27吕加敏朱雪琼
吕加敏,朱雪琼
(1.温州医科大学附属第二医院 妇产科,浙江 温州 325027;2.嘉兴市妇幼保健院 妇产科,浙江嘉兴 314000)
·论 著·
高级别宫颈鳞状上皮内病变患者宫颈环形电切术后病理阴性的相关因素分析
吕加敏1,2,朱雪琼1
(1.温州医科大学附属第二医院 妇产科,浙江 温州 325027;2.嘉兴市妇幼保健院 妇产科,浙江嘉兴 314000)
目的:探讨高级别宫颈鳞状上皮内病变(CIN2-3)患者宫颈环形电切术(LEEP)后病理阴性的相关影响因素。方法:选取自2011年3月至2012年12月间嘉兴市妇幼保健院因宫颈病变经阴道镜下活检诊断为CIN2-3而行LEEP术的患者263例,并对年龄、宫颈细胞学、HPV病毒载量、阴道镜下活检病理分级等进行回顾性分析,评价上述因素与CIN2-3患者LEEP术后病理阴性的相关性。结果:单因素分析显示HPV低病毒载量(<400 RLU/CO)、液基细胞学检查(TCT)低级别组、镜下活检CIN2与CIN2-3患者LEEP术后病理阴性结果相关(P=0.008,P=0.012,P=0.02),而年龄与阴性病理结果相关性无统计学意义(P=0.172),多因素分析显示低HPV病毒载量为术后病理阴性的独立影响因素(P=0.019,OR=3.752,95%CI 1.247~11.293)。三因素(HPV病毒载量、TCT、活检病理诊断)共同预测CIN2-3术后病理阴性发生的受试者工作特征曲线(ROC曲线)曲线下面积(AUC)为0.727。结论:HPV低病毒载量与LEEP术阴性病理结果相关。联合术前HPV低病毒载量、TCT低级别、镜下活检CIN2三因素具有较高预测术后病理阴性的效能。
高级别宫颈鳞状上皮内病变;环形电切术;病理阴性
子宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)是子宫颈上皮细胞的非典型增生或分化异常的细胞异常增生形成的增生性病变,但尚未发生浸润。2012年美国病理家学会联合美国阴道镜和宫颈病理学会关于下生殖道鳞状上皮内病变项目(LAST Project)建议组织学上和细胞学一样使用双层分类系统,将宫颈病变分为高级别宫颈鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)和低级别宫颈鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)[1]。HSIL包括CIN2和CIN3,如未经治疗,分别有5%和12%以上进展为浸润癌的可能[2],所以其成为子宫颈癌防治的重要阶段。目前经阴道镜下活检病理证实CIN2-3后多普遍采用环形电切术(loop electrosurgical excision procedure,LEEP)以进一步诊断和治疗[3],但临床工作中时常遇到LEEP术后再评估病理阴性的情况。而随着宫颈病变人群的年轻化,对这部分患者的处理更需慎重和个体化,以避免不必要的宫颈电切术。故本研究旨在探讨CIN2-3患者经LEEP术后病理阴性的相关影响因素,以期为进一步完善子宫颈癌风险评估提供一定依据。
1 资料和方法
1.1 一般资料 收集自2011年3月至2012年12月间嘉兴市妇幼保健院阴道镜活检诊断为CIN2-3而行LEEP术患者,阴道镜活检指征为:细胞学检查结果≥意义不明的不典型鳞状细胞(ASCUS)或高危型HPV检测持续阳性大于半年~1年。排除标准:①妊娠期或哺乳期;②既往有宫颈癌前病变史和宫颈癌史;③既往有宫颈手术或物理治疗史;④术后病理切缘阳性或切缘情况不明确。所有研究对象均签署知情同意书。共计263例患者符合条件纳入研究,年龄22~59岁,平均(39.22±7.70)岁。
1.2 研究方法
1.2.1 随访:所有患者于LEEP术后6个月、12个月、2年分别用高危型HPV和液基细胞学检查(TCT)联合检测至少2年,如果高危型HPV阳性或TCT报告≥ASCUS,即行阴道镜下检查和活检,后根据病理结果作相应处理,如无异常于术后1年常规行阴道镜下活检。随访截止时间为2014年12月,随访24~45个月,中位随访时间34个月。
1.2.2 TCT:用AutoCyte液基薄层细胞学技术(Tripath Imaging)行宫颈细胞学检查,采用2001年诊断性描述TBS(The Bethesda System)分类系统进行诊断。细胞学检查分为2组:低级别组包括未见上皮内病变/恶性细胞(NILM)、意义不明的ASCUS、 LSIL和不能排除高度上皮内病变的非典型鳞状细胞(ASC-H);高级别组包括HSIL及以上病变。
1.2.3 高危型HPV检测:采用Digene公司提供的杂交捕获二代技术(HC- II)检测,本检测法可同时检测13种高危型HPV(HPV 16,18,31,33,35,39,45,51,52,56,58,59,68)。阳性阈值相对吸光度/临界值(RLU/CO)≥1.0,相当于标本中检出的DNA负荷量≥1.0 ng/L(1.0 ng/L=3.7 pmol/L),反之RLU/CO<1.0为阴性。以400 RLU/CO为界值,分为低病毒载量组(<400 RLU/CO,包括HPV阴性)和高病毒载量组(≥400 RLU/CO)。
1.2.4 LEEP术:术中根据宫颈碘试验显示的不着色区外围3~5 mm完整切除病灶,切除深度一般为8~12 mm。对绝经后妇女及术前宫颈管搔刮阳性患者,予补切宫颈管部分组织,切除深度达10~15 mm。术后宫颈残端局部电凝止血,标本经标记定位后送病理学检查。
1.2.5 结果判定标准:LEEP术后病理阴性,即病理结果正常(包括黏膜炎、扁平湿疣等);反之病理阳性,即存在CIN1及以上病变。LEEP术后1年内发现CIN1及以上病变称为病变持续存在,术后1年以上发现CIN1及以上病变称为复发。所有病变持续及复发均经阴道镜下组织活检与二次锥切标本病理证实。
1.3 统计学处理方法 应用SPSS19.0统计软件进行统计学处理。以术后病理结果(1=阴性,0=阳性)为应变量,对4个可能的影响因素(年龄、术前宫颈细胞学、术前HPV病毒载量、阴道镜下活检病理分级)进行x2检验,随后针对有统计学意义的影响因素进行多元logistic回归分析(影响因素进入方程的方式为backward,纳入方程的P为0.05,剔出方程的P为0.1)。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料分析 LEEP术后病理阴性组平均年龄为(37.6±9.8)岁,术后病理阳性组平均年龄为(39.4±7.4)岁。患者的术前TCT及HPV病毒载量、镜下活检病理分布情况见表1。
2.2 LEEP术后病理阴性单因素分析 263例CIN2-3患者中,28例患者LEEP术后病理阴性,占10.65%。由表2可知,年龄对术后病理影响无统计学意义(P>0.05),低HPV病毒载量(<400 RLU/CO)、TCT低级别组、镜下活检CIN2与LEEP术后病理阴性相关(均P<0.05)。
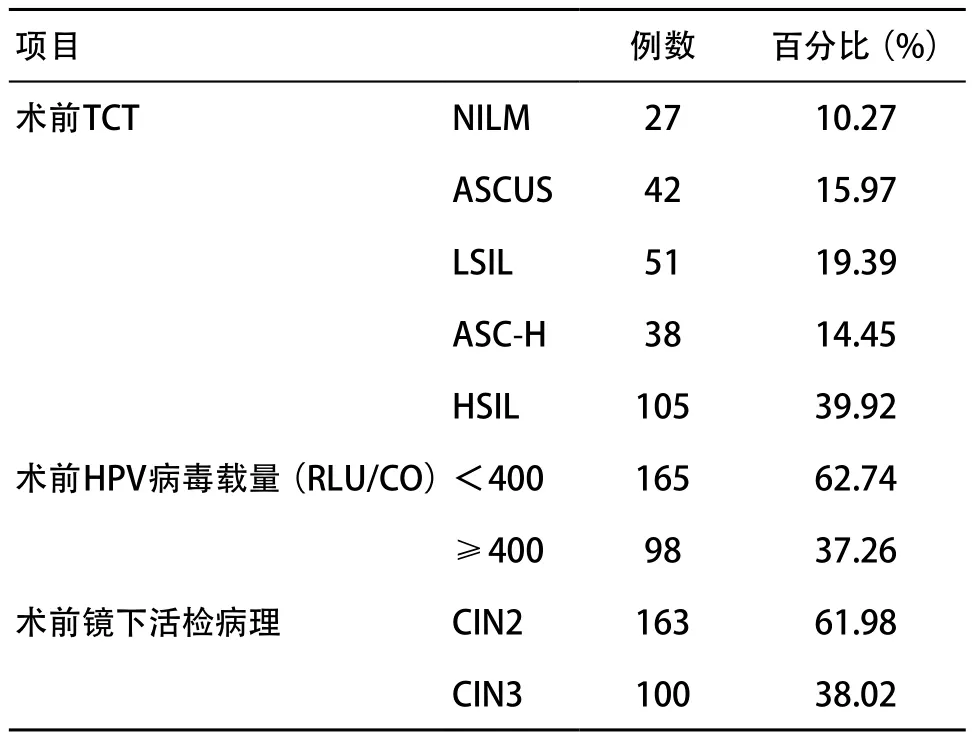
表1 CIN2-3患者LEEP术前TCT及HPV病毒载量、镜下活检情况
2.3 LEEP术后病理阴性的logistic回归分析 考虑到以上三因素之间可能存在相互影响,将三因素同时纳入logistic回归模型进行分析,结果见表3。由表3可知,仅HPV病毒载量(临界值400 RLU/CO)(P=0.019)与术后病理有良好的相关性,OR=3.752,95%CI:1.247~11.293,有统计学意义,即术前HPV低病毒载量是术后病理阴性的独立影响因素,而术前TCT和活检病理级别均不是独立影响因素。
应用受试者工作特征曲线(ROC曲线)评估以上三因素(术前HPV病毒载量、术前TCT、活检病理诊断)共同预测术后病理阴性发生的效能。结果显示:曲线下面积(AUC)为0.727,95%CI为0.648~0.806。见图1。

表2 CIN2-3患者经LEEP术后病理阴性的影响因素分析
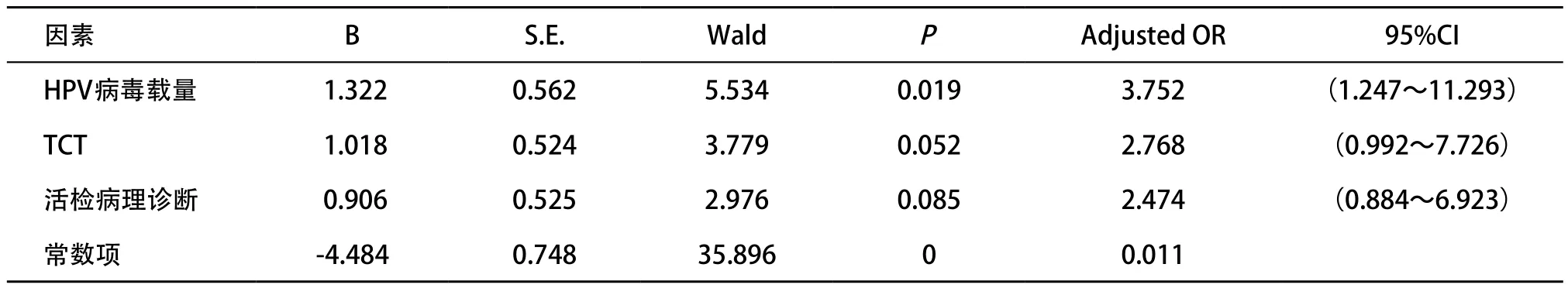
表3 CIN2-3患者经LEEP术后病理阴性的相关因素
2.4 CIN2-3患者LEEP术后持续/复发 本研究共随访发现6例镜下活检病理报告CIN2-3患者LEEP术后病变持续/复发,均为术后病理阳性患者(见表4)。表4中,5例患者因高危型HPV阳性行阴道镜病理活检发现病变,1例因TCT报告ASCUS而行阴道镜检查。6例患者中仅1例为术后病变持续,后行二次LEEP术,术后病理证实为CIN3,5例病变复发者中1例经二次LEEP术后证实复发,后行子宫全切术,其他4例均未行手术,予临床观察密切随访至今。
3 讨论
3.1 CIN2-3患者LEEP术后病理阴性的产生及原因

图1 三因素(HPV病毒载量、TCT、活检病理诊断)预测LEEP术后病理阴性的ROC曲线
细胞学和/或HPV检测-阴镜镜检查(镜下活检,必要时宫颈管内搔刮)+病理组织确诊,是目前国际公认的宫颈癌前病变诊断的“三阶梯”程序。LEEP术因具有高效、安全的优点,已成为经镜下活检诊断CIN2-3后进一步评估宫颈癌发生风险度和治疗癌前病变的普遍选择[3,5]。但一部分CIN2-3患者经LEEP术后病理发现无残余癌前病变或癌灶存在,这一现象并不少见,国内外报道在1.2%~17.7%不等[3-7],而在本研究中其发生比例达10.65%。其产生的原因可能为CIN2-3病灶本身微小,经活检已完全去除,或者小病灶未在LEEP术后采样的组织切片中,且存在移行带未完全切除可能[4],另外,多点活检本身可能刺激人体免疫功能清除了残留病灶从而起到治疗作用[7]。本研究着重于采用多元logistic回归分析CIN2-3经LEEP术后病理阴性的影响因素。
3.2 术前HPV低病毒载量对CIN2-3患者LEEP术后病理阴性的影响 本研究结果显示,HPV低病毒载量(小于400 RLU/CO)为LEEP术后标本病变阴性的独立影响因素。Ryu等[4]取界定值100 RLU/CO,发现HPV病毒载量小于100 RLU/CO与术后病理阴性相关(OR 2.951,95%CI 1.260~6.912,P=0.013)。学者们认为术前和术后的病毒载量有助于CIN病情的量化监测[8-10]。Hesselink等[11]认为较高的HPV病毒载量只有微弱的CIN3预测性,在急性HPV感染中往往有一个非常高的病毒载量,而许多小CIN3病变的妇女(其中急性感染已清除)则具有低病毒载量。故推测低病毒载量下CIN2-3病灶本身微小,可能已经阴道镜下活检去除。另外CIN并非是单向的病理生理学发展过程,而具有自然消退与发展为宫颈浸润癌的两种不同生物学行为。文献报道CIN2约40%的病变可自行消退[12],而有80%高危型HPV阳性患者平均在19个月内会自然清除[13],提示CIN自然逆转的趋势可能与HPV的自然清除趋势是一致的。而阴道镜下活检与行LEEP术有一定时间差,故随着病毒的清除,CIN存在自然逆转可能,也可能是术后病理阴性的原因之一。
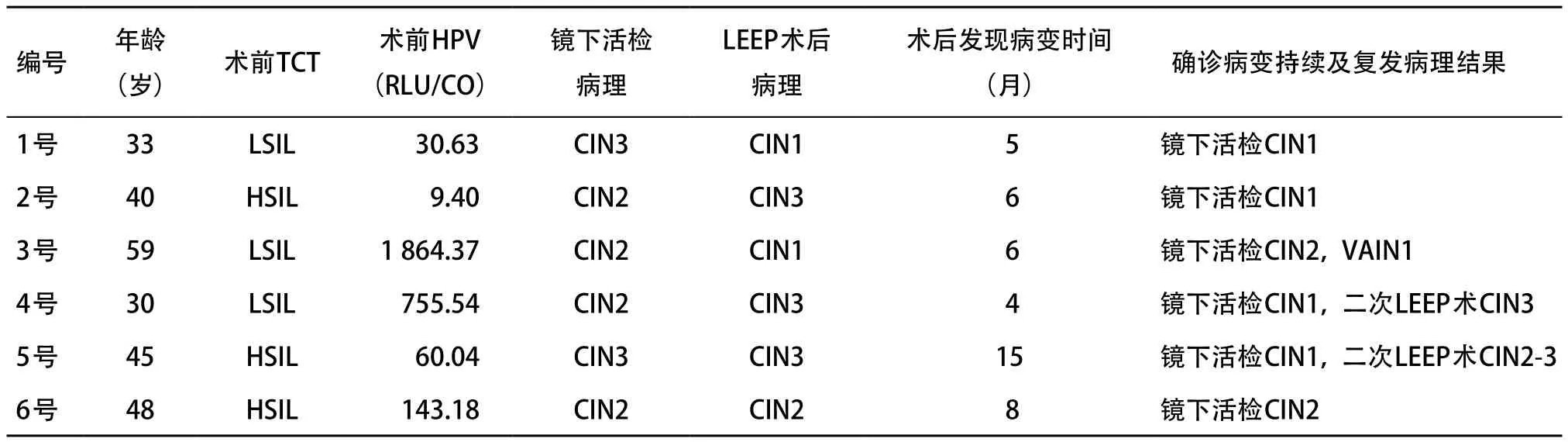
表4 6例CIN2-3患者LEEP术后病变持续/复发临床资料
3.3 病理诊断对CIN2-3患者LEEP术后病理阴性的影响 本研究中单因素分析术前TCT低级别组和镜下活检CIN2是LEEP术后病理阴性的相关因素,但多因素logistic回归分析提示两者与术后病理阴性未见有统计学意义的关联性。这可能跟病理诊断主要依据组织形态学特点主观判断,存在一定主观性有关。尤其CIN2作为中间级别,其病理一致性相对欠缺[14-15],而实际工作中,良性病变也可能存在一定不典型性,比如同样好发于子宫鳞状上皮移行区的不成熟鳞状上皮化生(atypical immature metaplasia,AM),萎缩,修复性上皮增生等,在形态上易于CIN混淆。因此引入替代的方法和具体的生物标记物,以帮助CIN病变准确分级成为近年来热点[14,16-19]。Regauer等[17]认为引入CK17有助于鉴别CIN2和AM。Lazaro等[18]通过免疫组织化学染色检测p16蛋白的表达对阴道镜下活检标本CIN2-3进行分类后发现,LEEP术后病理阴性的发生与p16基因表达阴性相关,从而认为p16检测与病理分级相结合可以显著减少LEEP术后病理阴性的比例(10%下降至5%),由此避免不必要的手术和公共医疗负担。LAST Project推荐对于CIN2中p16阳性归为HSIL,阴性者归为LSIL[1]。本研究还综合术前TCT和镜下活检病理与HPV病毒载量共同绘制ROC曲线的AUC为0.727,显示三因素具有较高术后病理阴性的预测效能。McAllum等[20]研究认为25岁以下CIN2年轻患者可能不需要常规治疗。Carcopino等[21]提出对于30岁以下镜下活检病理证实的CIN2,在阴道镜检查满意、阴道镜下发现仅一个象限存在宫颈病变且没有其他任何更严重的病变、其宫颈涂片和活检结果是一致的情况下可以采用物理治疗如消融术及密切随访。因此,结合病理定级有助于评估CIN2-3患者预后。
3.4 CIN2-3患者LEEP术后病理阴性与病变持续/复发 据报道[19]称,CIN2-3经LEEP术后病变持续/复发在5%~25%之间。Ryu等[4]的研究中对28例CIN2-3术后病理阴性患者随访最长44个月,发现1例病变复发,认为这部分患者术后与术后病理阳性患者需要按照相同模式密切随访,Livasy等[6]也有相同观点。而本研究中在随访期间未发现这部分患者有病变持续或复发。鉴于本研究属于回顾性研究,要进一步探究CIN2-3术后病理阴性的临床及预后相关因素,还需要进行更大样本和多中心的前瞻性研究。
综上所述,综合术前HPV病毒载量及TCT、阴道镜下病理结果三因素,对镜下活检病理结果进行分流,准确病理定级,有助于筛选出真正的癌前病变或高风险者,从而严格谨慎运用LEEP手术选择标准,指导制定出针对CIN2-3患者合理的治疗方案。
[1] Waxman AG, Chelmow D, Darragh TM, et a1. Revised terminology for cervical histopathology and its implications for management of high-grade squamous intraepithelial lesions of the cervix[J]. Obstet Gyneeol, 2012, 120(6): 1465-1471.
[2] 吴令英, 安菊生. 宫颈上皮内瘤变的诊治[J]. 实用妇产科杂志, 2013, 29(3): 170-172.
[3] Duesing N, Schwarz J, Jaenicke F, et a1. Assessment of cervical intraepithelial neoplasia (CIN) with colposcopic biopsy and effcacy of loop electrosurgical excision procedure (LEEP) [J]. Arch Gynecol Obstet, 2012, 286(6): 1549-1554.
[4] Ryu A, Nam K, Chung S, et a1. Absence of dysplasia in theexcised cervix by a loop electrosurgical excision procedure in the treatment of cervical intraepithelial neoplasia[J]. Gynecol Oncol, 2010, 21(2): 87-92.
[5] 杨凤云, 杨波, 顾萍, 等. 阴道镜下宫颈活检和宫颈环形电切术后病理检查对宫颈病变的诊断价值[J]. 上海交通大学学报(医学版), 2012, 32(4): 495-513.
[6] Livasy CA, Moore DT, Van Le L, et a1. The clinical signifcance of a negative loop electrosurgical cone biopsy for highgrade dysplasia[J]. Obstet Gynecol, 2004, 104(2): 250-254.
[7] Benjamin L, Rachel E, Elke A, et a1. Negative loop electrosurgical cone biopsy fnding following a biopsy diagnosis of high-grade squamous intraepithelial lesion frequency and clinical signifcance[J]. Arch Pathol Lab Med, 2012, 136(10): 1259-1261.
[8] Huang Y, Huang MN, Wu LY, et al. Association between human papillomavirus DNA load and development of cervical intraepithelial neoplasia and cervical cancer[J]. Int J Gynecol Cancer, 2008, 18(4): 755-760.
[9] 黄国琴. 人乳头瘤病毒负荷量与宫颈病变程度的相关性研究[J]. 中国妇幼保健, 2012, 27(30): 4707-4709.
[10] Alonsoa I, Tropé A, Luis M, et a1. Pre-and post-conization high-risk HPV testing predicts residual/recurrent disease in patients treated for CIN2-3[J]. Gynecol Oncol, 2006, 103(2): 631-636.
[11] Hesselink AT, Berkhof J, Heideman DA, et al. High-risk human papillomavirus DNA load in a population-based cervical screening cohort in relation to the detection of high-grade cervical intraepithelial neoplasia and cervical cancer[J]. Int J Cancer, 2009, 124 (2): 381-386.
[12] Castle PE, Schiffman M, Wheeler CM, et al. Evidence for frequent regression of cervical intraepithelial neoplasia-grade 2[J]. Obstet Gynecol, 2009, 113(1): 18-25.
[13] Rosa MI, Fachel JM, Rosa DD, et a1. Persistence and clearence of human papillomavirus infection: a prospective cohort study[J]. AM J Obstet Gynecol, 2008, 199(6): 617.el-7.
[14] Bergeron C, Ordi J, Schmidt D, et al. Conjunctive p16INK4a testing signifcantly increases accuracy in diagnosing highgrade cervical intraepithelial neoplasia[J]. Am J Clin Pathol, 2010, 133(3): 395-406.
[15] Carreon JD, Sherman ME, Guillén D, et al. CIN2 is a much less reproducible and less valid diagnosis than CIN3: results from a histological review of population-based cervical samples[J]. Int J Gynecol Pathol, 2007, 26(4): 441-446.
[16] Martin CM, O’Leary JJ. Histology of cervical intraepithelial neoplasia and the role of biomarkers[J]. Best Pract Res Clin Obstet Gynaecol, 2011, 25(5): 605-615.
[17] Regauer S, Reich O. CK17 and P16 expression patterns distinguish (atypical) immature squamous metaplasia from high-grade Cervical intraepithelial neoplasia (CINIII)[J]. Histopathology, 2007, 50(5): 629-635.
[18] Lazaro SD, Newbill C, Berlin, M, et al. Negative loop electrosurgical excision procedure biopsies following high grade dysplasia: Good news or bad?[J]. Gynecol Oncol, 2014, 135(2): 388.
[19] Kocken M, Helmerhorst TJ, Berkhof J, et a1. Risk of recurrent high-grade cervical intraepithelial neoplasia after successful treatment: a long-term multi-cohort study[J]. Lancet Oncol, 2011, 12(5): 441-450.
[20] McAllum B, Sykes PHH, Sadler L, et al. Is the treatment of CIN 2 always necessary in women under 25 years old?[J]. Am J Obstet Gynecol, 2011, 205(5): 478.e1-7.
[21] Carcopino X, Muszynski C, Mergui JL, et a1. Should CIN 2 and 3 be treated the same way?[J]. Gynecol Obstet Fertil, 2011, 39(2): 94-99.
(本文编辑:吴健敏)
Analysis on the related factors of the negative pathology results of cervical loop electrosurgical exci-sion procedure in patients with high-grade cervical squamous intraepithelial lesions
LV Jiamin1,2, ZHU Xueqiong1. 1.De-partment of Obstetrics and Gynecology, the Second Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Obstetrics and Gynecology, Jiaxing Maternity and Child Care Hospital, Jiaxing, 314000
Objective: To investigate the related factors of the negative pathological results of loop electrosurgical excision procedure (LEEP) in patients with high-grade cervical squamous intraepithelial lesions (CIN2-3). Methods: Totally 263 patients diagnosed as CIN2-3 by colposcopy-assisted biopsy and treated with LEEP in Jiaxing Maternity and Child Care Hospital from March 2011 to December 2012 were selected, and the relation of the negative pathological results of LEEP with age, cervical cytology, HPV load and pathological grading was analyzed. Results: Univariate analysis showed that low HPV load (<400 RLU/CO), low-grade of TCT, biopsyconfrmed CIN2 were associated with the prediction of the negative pathology of LEEP specimens (P=0.008, P=0.012, P=0.02), however, age was not related to the negative result of LEEP (P=0.172). Multivariate logistic analysis showed that low HPV load was the independent factor of the negative pathological results of LEEP (P= 0.019, OR=3.752, 95%CI 1.247~11.293). The area under ROC curve was 0.727 for three factors (HPV load, TCT and biopsy pathology diagnosis) predicting negative pathological result of LEEP. Conclusion: Low HPV load is related to the negative pathological results of LEEP. Combining low HPV load with low-grade of TCT and biopsy-confrmed CIN2 has a high predictive effect on negative pathological results of LEEP.
high-grade cervical squamous intraepithelial lesions; loop electrosurgical excision procedure; negative pathology
R737.33
A
10.3969/j.issn.2095-9400.2015.09.009
2015-04-19
吕加敏(1984-),女,浙江嘉兴人,主治医师,在职硕士生。
朱雪琼,主任医师,教授,硕士生导师,Email:zjwz zxq@163.com。
