汉族男性注意缺陷多动障碍儿童执行功能与单胺氧化酶A基因活性相关分析
2015-12-27王维千杜松妹杨闯陈宏赵永忠梁艳林海西张晓燕王常绿王美豪何金彩
王维千,杜松妹,杨闯,陈宏,赵永忠,梁艳,林海西,张晓燕,王常绿,王美豪,何金彩
(温州医科大学附属第一医院 精神卫生科,浙江 温州 325015)
·论 著·
汉族男性注意缺陷多动障碍儿童执行功能与单胺氧化酶A基因活性相关分析
王维千,杜松妹,杨闯,陈宏,赵永忠,梁艳,林海西,张晓燕,王常绿,王美豪,何金彩
(温州医科大学附属第一医院 精神卫生科,浙江 温州 325015)
目的:探讨单胺氧化酶A(MAOA)基因活性与注意缺陷多动障碍(ADHD)执行功能的关系。方法:采用威斯康星分类测验和Stroop词色干扰测试对37例ADHD汉族儿童与30名正常对照组进行执行功能评估,采集外周全血并应用限制性片段长度多态性的方法检测MAOA基因启动子30 bp可变数目串联重复倍数,根据重复倍数分别将ADHD组和对照组分为高活性组与低活性组。结果:组别因素对WSCT概念化水平、完成分类数、错误应答数、持续错误数、持续应答数的影响差异均有统计学意义(P<0.05);2组间对Stroop色词测验中完成卡片A和卡片C的耗时数差异有统计学意义(P<0.001),干扰效应的耗时数差异有统计学意义(P<O.05);基因活性分组因素对WSCT概念化水平、持续错误数、错误应答数的影响差异有统计学意义(P<O.05),对Stroop色词测验中的完成卡片A和卡片C的耗时数差异有统计学意义(P<0.05),干扰效应的耗时数差异有统计学意义(P<O.05);ADHD组和正常对照组间MAOA等位基因的分布差异均无统计学意义(P>0.05)。结论:本研究未发现MAOA-uVNTR各等位基因分布与ADHD存在关联,但可能与ADHD儿童部分执行功能有一定相关性。
注意缺陷多动障碍;单胺氧化A基因多态性;执行功能;Stroop词色干扰测试;威斯康辛分类卡片测验
遗传学研究发现单胺氧化酶A(monoamine oxidase A,MAOA)基因与注意缺陷多动障碍(attentiondeficit hyperactivity disorder,ADHD)的发病有一定的关系,尤其与冲动、攻击等行为相关性更明显。MAOA是多巴胺(dopamine,DA)、五羟色胺(hydroxytry-ptamine,5-HT)和去甲肾上腺素(norepi-nephrine,NE)的重要代谢酶,而这些神经递质影响认知功能[1]。已发现MAOA基因多态性(MAOA-uVNTR)与反应抑制功能、记忆功能[2]、工作记忆、视觉空间工作记忆功能[3]、启动功能[4]有关;基因影像学研究发现携带低活性基因的人群比携带高活性基因人群在右背侧前额叶皮质调控能力强;同时发现携带高活性基因人群与携带低活性基因的人群比较调控情感相关区域能力强,而调节认知功能相关区域差[5]。ADHD儿童执行功能损害与额叶-基底节功能减低有关[6],MAOA基因主要分布在中枢儿茶酚胺能神经元,研究发现个体的认知能力受到前额叶儿茶酚胺能神经递质释放水平的显著影响[7]。我们推测MAOA基因活性可能与ADHD患者认知功能有关,执行功能是ADHD研究过程中较为关注的认知功能之一;目前针对中国汉族儿童的有关MAOA基因活性与ADHD儿童执行功能的相关性研究鲜见有公开报道。本研究通过比较中国汉族ADHD患儿与正常对照组执行功能的差异,探讨MAOA基因活性与ADHD患儿执行功能的相关性。
1 对象和方法
1.1 对象 收集2013年6月至2014年1月在温州医科大学附属第一医院儿童心理科门诊就诊的ADHD患者共37例,男,汉族,年龄7~12岁,经精神科医师(2名主治或主治医师以上职称医师)确诊作为ADHD组。入组标准:①符合美国精神障碍与统计手册第5版中ADHD诊断标准;②韦氏智力测验智力商数IQ≥90;③右利手;④未经任何药物治疗;⑤排除儿童精神分裂症、情感障碍、精神发育迟滞和发育障碍等疾病,无精神疾病家族遗传史;⑥排除共患对立违拗性障碍或品行障碍、学习困难、抽动障碍等病例。选自社区和学校招募的健康儿童,男,汉族,年龄7~12岁,右利手,排除各种神经精神疾病,共30例,作为对照组。所有儿童均为右利手,视力或矫正视力正常,无学习困难及语言障碍。2组间年龄、全量表智商、言语智商、操作智商比较,差异均无统计学意义(均P>0.05),见表1。本研究经温州医科大学附属第一医院伦理委员会批准,2组受试者均获得监护人知情同意并签署知情同意书。
表1 ADHD组与正常对照组的人口学资料比较()
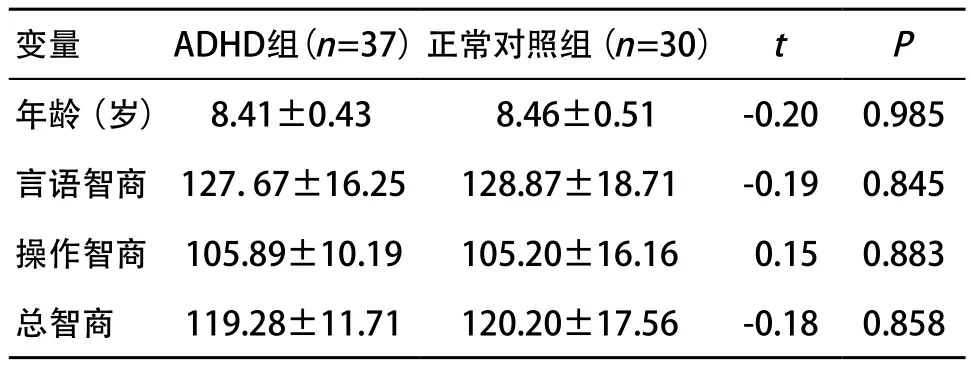
表1 ADHD组与正常对照组的人口学资料比较()
变量ADHD组(n=37)正常对照组(n=30)tP年龄(岁) 8.41±0.430 8.46±0.51-0.200.985言语智商127.67±16.25128.87±18.71-0.190.845操作智商105.89±10.19105.20±16.16-0.150.883总智商119.28±11.71120.20±17.56-0.180.858
1.2 方法
1.2.1 DNA提取和基因分型:采集被试儿童外周静脉血5 mL,收集DNA样本。PCR试剂:KAPA2G Fast Multiplex Mix(Code NO.:KM5802)购自北京天根生化科技有限公司,产品批号[DP304]提取DNA,并在-70 ℃保存。目的基因扩增及基因型鉴定:PCR扩增循环为25 μL反应体系,基因组DNA 1 μL;上下游引物各1 μL,2×GOTaq Green Master Mix(华大科技合成公司)12.5 μL,去离子水9.5 μL。MAOA引物上游:5’-ACAGCCTGACCGTGGAGAAG-3’,下游:5’-GA ACGGACGCTCCATTCGGA-3’。所有PCR都在Gene Amp PCR 2 400系统上完成。PCR扩增循环条件:94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min(共30个循环),最后72 ℃延伸5 min,-20 ℃保存待检。取上述基因产物用DuRed染色,1.8%琼脂糖凝胶电泳分析,用1 600 Gel Image System成像系统照相,读取基因型。片段大小:183 bp为2次重复(2R),213 bp为3次重复(3R),244 bp为4次重复(4R),272 bp为5次重复(5R),并记录结果。
1.2.2 韦氏智力检查:采用龚耀先1993年版的中国韦氏儿童智力量表[8](C-WISC)评定ADHD患儿的智商,分别计算言语智商、操作智商和总智商。
1.2.3 威斯康辛分类卡片测验(wisconsin-sorting test,WCST)[9]:受试者完成分类并将128张卡片分类,计算机软件自动分析得出测试结果,进行测试时采用统一的指导语,分别记录持续错误数(Rpe)、错误应答数(Re)、概念化水平(Rfp)、完成分类数(CC)和持续应答数(Rp);其中CC与转换能力有关,Re主要与抽象概括能力及执行功能有关,Rfp与概念形成及运用能力有关,Rpe与持续性操作能力有关,Rp与任务管理能力有关。
1.2.4 Stroop色词测验[10]:本测验共分3步,3张卡片,每张24个字,由红、绿、黄、蓝4种颜色组成。
第一步呈现A卡片,由4种颜色的圆点(红、绿、黄、蓝)组成,要求快速且准确地读出,并记录耗时数(s)。第二步呈现B卡片,由红、绿、黄、蓝4种颜色的汉字组成,要求快速且准确地读出汉字颜色,并记录耗时数(s)。第三步呈现C卡片,将4种表示颜色的汉字(红、绿、黄、蓝)用4种不同的颜色呈现,要求快速且准确地读出字的颜色,而非汉字的意义,并记录耗时数(s)。干扰效应=C卡片的耗时数-A卡片的耗时数;记录主要指标:干扰效应和各耗时数,测试ADHD儿童干扰抑制能力。
1.3 统计学处理方法 采用SPSS 16.0统计软件进行分析。用Shapiro-Wilk检验衡量计数资料和计量资料的正态性,Levene’s test检验方差齐性,计数资料采用例数(%)描述,符合正态分布的计量资料采用描述。2组间年龄、智商比较采用t检验,2组间基因型和等位基因频率比较采用x2检验,组别、基因活性分组因素对执行功能的影响采用无重复测验二因素方差分析等方法。P<0.05为差异有统计学意义。
2 结果
2.1 2组MAOA-uVNTR等位基因频率及分布情况 MAOA基因位于X染色体上,故男性只有等位基因数据,没有基因型数据,男性中只存在VNTR-L和VNTR-H两种等位基因。根据Abol等[11]的研究结果和分组方式,将3.5次和4次重复序列定义为MAOA高活性组,本研究未检出3.5次重复序列,高活性组只包含4次重复序列。2次、3次和5次重复序列定义为MAOA低活性组,本研究仅ADHD组检出1例2次重复序列,因数量较少不纳入分析。最终ADHD组高活性21例(占58.3%),对照组高活性13例(占43.3%),ADHD组低活性15例(占41.7%),对照组低活性17例(占56.7%)纳入研究,2组等位基因频率比较(x2=0.231),差异无统计学意义(P>0.05)。
2.2 2组WSCT和Stroop测试结果 采用2×2两因素无重复测量设计进行方差分析[组别:(ADHD组、正常对照组)×(基因活性分组:MAOA高活性组、MAOA低活性组]。见表2。
表2 ADHD组与正常对照组WSCT和Stroop测试结果比较()

表2 ADHD组与正常对照组WSCT和Stroop测试结果比较()
注:F(组别):组别分组F值;F(基因):基因活性分组F值
测验指标ADHD组(n=37)正常对照组(n=30)F(组别)P(组别)F(基因)P(基因)Stroop A卡片耗时数(s)30.12±6.83.26.74±9.3154.54<0.0014.2200.038 B卡片耗时数(s)27.82±5.90.26.76±5.02 3.09<0.0890.2900.091 C卡片耗时数(s)62.28±15.9044.90±19.961.44<0.0013.4600.042干扰效应(s)29.55±11.4723.69±6.2714.00<0.0103.6700.049 WSCT概念化水平15.92±7.83.27.33±8.8121.50<0.0015.9900.020完成分类数 1.30±0.92. 2.71±1.2617.39<0.0010.9800.331错误应答数28.95±8.54.20.73±8.3411.36<0.0025.5700.025持续错误数14.70±8.41.10.44±5.87 5.61<0.0249.7500.004持续应答数14.26±5.52.10.22±4.04 4.99<0.0330.1310.720
3 讨论
Barkley[12]提出ADHD的执行功能缺损理论,认为ADHD最主要的缺陷是行为抑制。本研究结果显示ADHD组和对照组的Stroop色词测验中完成卡片A和卡片C的耗时数、干扰效应的耗时数,WSCT概念化水平、完成分类数、错误应答数、持续错误数、持续应答数等差异有统计学意义;说明多动症儿童存在一定程度反应抑制缺陷和执行功能失调,与国内外大多数研究结果一致。本研究的结果显示按照基因活性分组因素对WSCT的概念化水平、持续错误数、错误应答数,Stroop色词测验中的完成卡片A和卡片C的耗时数,干扰效应的耗时数影响差异有统计学意义。这一结果说明MAOA基因活性因素与多动症儿童的持续性操作能力、抽象概括能力、概念形成及运用能力、干扰抑制能力等执行功能有关,且低活性组部分执行功能优于高活性组。
注意障碍和执行功能失调是ADHD的核心认知功能缺陷,也是主要的遗传内表型[13]。但关于ADHD遗传内表型与遗传基因的相关性研究较少,Biehl等[14]研究发现COMT基因Val158Met多态性与ADHD儿童工作记忆有关;国内张跃兵等[15]研究发现COMT基因rs4680多态性与ADHD的概念形成等执行功能有关;钱秋谨等[16-17]分别对238例和333例ADHD儿童的研究显示COMT基因Val158Met多态性、MAOA基因多态性与ADHD男性患儿智商有关。遗传学研究显示MAOA基因长等位基因(3.5R、4R)的转录活性是短等位基因(3R、5R)的2~10倍[18],MAOA低活性基因型能减慢DA的清除速率,从而提高脑内突触间隙DA水平,利于ADHD认知功能的发展,MAOA低活性基因型能减慢5-HT的清除速率,从而提高脑内突触间隙5-HT水平,有利于ADHD认知功能的发展[19]。越来越多的证据表明,5-HT系统对学习和记忆过程有重大影响,其相关受体均定位于与学习和记忆有关的脑区,包括海马、杏仁核和皮质[20]。5-HT1A受体激动剂8-OH-DPAT可促进动物实验中大鼠学习的获得、巩固和维持[21]。国内外关于MAOA-uVNTR与ADHD的相关性研究所得出的结论并不一致[13]。本研究未发现MAOA-uVNTR各等位基因分布与ADHD存在关联,研究结果的不一致可能与样本量小,未考虑性别和临床表型的异质性等因素有关。
研究中我们发现MAOA基因活性与ADHD儿童部分执行功能存在一定的相关性,这有助于我们对多动症的病理生理机制的进一步认识,但本研究尚不能确定所有执行功能均与MAOA基因活性因素有关。目前认为ADHD是一种多基因遗传疾病,遗传基础在易患性上起决定作用。目前研究发现与ADHD发病可能相关的遗传基因较多,研究较多的如多巴胺转运体蛋白基因(dopamine transferase,DAT1)、多巴胺D4受体基因(DRD4)、多巴胺D5受体基因(DRD5)、MAOA、5-羟色胺受体2A基因(5-hydroxy-tryptamine type 2A-receptor,5-HT2A)、儿茶酚胺氧位甲基移位酶(COMT)、多巴胺β-羟化酶(DβH)基因、5-羟色胺转运体(5-HTT)等[22]。所以某一基因对ADHD的神经内表型的影响相对有限,但如果某遗传基因与遗传内表型相关性越大可能说明此遗传基因对于疾病发病起的作用越大。由于本次实验ADHD组与对照组的例数相对较少,再加之未入组女性ADHD患儿,可能也是得出部分阴性结果的原因之一。本研究仅涉及患儿的执行功能,未涉及执行功能中的工作记忆、定势转移、计划能力等方面,有待进一步研究。
[1] Liu L, Guan LL, Chen Y, et al. Association analyses of MAOA in Chinese Han subjects with attention-defcit hyperactivity disorder: family-based association test, case-control study, and quantitative traits of impulsivity[J]. Am J Med Genet Part B Neuropsychiatr Genet, 2011, 156B(6): 737-748.
[2] Savitz J, Vander Merwe L, Solms M, et al. A linkage and family-based association analysis of a potential neurocognitive endophenotype of bipolar disorder[J]. Neuromolecular Med, 2007, 9(2): 101-116.
[3] Luciana M, Collins PF, Depue RA. Opposing roles for dopamine and serotonin in the modulation of human spatial working memory functions[J]. Cereb Cortex, 1998, 8(3): 218-226.
[4] Halperin JM, Schulz KP. Revisiting the role of the prefrontal cortex in the pathophysiology of attention-defcit/hyperactivity disorder[J]. Psychol Bull, 2006, 132(4): 560-581.
[5] Ernst LH, Lutz E, Ehlis AC. Genetic variation in MAOA modulates prefrontal cortical regulation of approach-avoidance reactions[J]. Neuropsychobiology, 2013, 67(3): 168-180.
[6] Willcutt EG, Doyle AE, Nigg JT, et a1. Validity of the executive function, theory of attention deficit/hyperactivity disorder: a meta-analytic review[J]. Biol Psychiatry, 2005, 57(11): 1336-1346.
[7] Arnsten AF, Li BM. Neurobiology of executive functions: catecholamine infuences on prefrontal cortical functions[J]. Biol Psychiatry 2005, 57(11): 1377-1384.
[8] 龚耀先, 蔡太生. 中国修订韦氏儿童智力量表手册[M]. 长沙: 湖南地图出版社, 1993: 83-240.
[9] 钱英, 王玉凤. 学龄儿童执行功能行为评定量表父母版信效度[J]. 北京大学学报(医学版), 2007, 39(3): 277-283.
[10] 纪桂萍, 焦书兰. 语义的自动加工和选择性注意对Stroop效应的影响[J]. 心理学报, 1987, 19(3): 291-296.
[11] Abol SZ, Hu S, Hamer D, et a1. A functional polymorphism in the monoamine oxidase A gene promoter[J]. Hum Genet, 1998, 103(3): 273-279.
[12] Barkley RA. Behavioral inhibition, sustained attention, and executive functions:constructing a unifying theory of ADHD [J]. Psychol Bull, 1997, 121(1): 65-94.
[13] Tannock R. Attention defcit hyperactivity disorder: advances in cognitive, neurobiological, and genetic research[J]. J Child Psycholpsychiatry, 1998, 39(1): 65-99.
[14] Biehl SC, Gschwendtner KM, Guhn A, et a1. Does adult ADHD interact with COMT val158met genotype to influence working memory performance?[J]. Atten Defc Hyperact Disord, 2015, 7(1): 19-25
[15] 张跃兵, 罗学荣, 刘霞, 等. 注意缺陷多动障碍执行功能与儿茶酚胺氧位甲基转移酶基因的关联分析[J]. 中国神经精神疾病杂志, 2010, 36(9): 521-524.
[16] 钱秋谨, 王玉凤, 杨莉, 等. 注意缺陷多动障碍患儿智商与儿茶酚-O-甲基转移酶基因及其它影响因素的研究[J]. 中国神经精神疾病杂志, 2009, 35(1): 35-39.
[17] 钱秋谨, 王玉凤, 张浩波, 等. 单胺氧化酶基因多态性与注意缺陷多动障碍智商的相关性研究[J]. 中国实用儿科杂志, 2009, 24(1): 26-30.
[18] Huang YY, Cate SP, Battistuzzi C, et a1. An association between a functional polymorphism in the monoamine oxidase a gene promoter, impulsive traits and early abuse experiences[J]. Neuropsychopharmacology, 2004, 29(8): 1498-1505.
[19] Cases O, Seif I, Grimsby J, et a1. Aggressive behavior and altered amounts of brain serotonin and norepinephrine in mice lacking MAOA[J]. Science, 1995, 268(5218): 1763-1766.
[20] Guan L, Wang B, Chen Y, et a1. A high-density single-nucleotide polymorphism screen of 23 candidate genes in attention defcit hyperactivity disorder: suggesting multiple susceptibility genes among Chinese Han population[J]. Mol Psychiatry, 2009, 14(5): 546-554.
[21] Winsauer PJ, Rodriguez FH, Cha AE, et a1. Full and partial 5-HT1A receptor agonists disrupt learning and performance in rats[J]. J Pharmacol Exp Ther, 1999, 288(1): 335-347.
[22] Gizer IR, Ficks C, Waldman ID. Candidate gene studies of ADHD: a meta-analytic review[J]. Hum Genet, 2009, 126 (1): 51-90.
(本文编辑:吴彬)
Correlative analysis between executive function of attention-deficit hyperactivity disorder in Han nationali-ty people and the activity of monoamine oxidase A gene
WANG Weiqian, DU Songmei, YANG Chuang, CHEN Hong, ZHAO Yongzhong, LIANG Yan, LIN Haixi, ZHANG Xiaoyan, WANG Changlv, WANG Meihao, HE Jincai. Department of Psychiatry, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To explore the relationship between polymorphism of MAOA gene activity and the executive function of attention-defcit hyperactivity disorder (ADHD). Methods: Choose 37 patients who was diagnosed as ADHD and 30 normal volunteers as controls. The executive function was evaluated using wisconsin card sorting test (WCST) and Stroop test. Taking peripheral blood and restriction fragment length polymorphism (RFLP) techniques were performed to detect MAOA 30 bp tandem repeats multiple of variable number, according to this repeats multiple, the case and control groups were divided into high and low activity group, respectively. Results: Group factor had signifcant effects on conceptual level, the number of completely classifcations, the number of wrong answers, the number of continually mistakes, the number of continually answers in WCST; Group factor also had statistical signifcant differences on the complete time between A and C card in Stroop test (P<0.001), the time of interference effects also had statistically signifcant (P<0.05); MAOA gene activity factor had signifcant infuence on conceptual level, the number of continually mistakes and the number of wrong answers had statistically signifcant on the difference of complete time in STROOP A card and C card (P<0.05), the time of interference effects also had statistically signifcant (P<0.05). There was no statistically signifcant in allele distribution of MAOA gene between the ADHD cases group and the control group (P>0.05). Conclusion: Our study fnd no relationship between MAOA-uVNTR allele distribution and ADHD, However, there maybe have relationship between MAOA polymorphism and part of the executive function.
attention-deficit hyperactivity disorder; MAOA-uVNTR; executive function; stroop test; wisconsin-sorting test
2015-03-20
浙江省自然科学基金资助项目(LY14H090012);温州市科技局科技计划项目(Y20130163)。作者简介:王维千(1980-),男,黑龙江哈尔滨人,住院医师。
何金彩,教授,硕士生导师,Email:hjc@wzmc.edu.cn。
R749.94
A
10.3969/j.issn.2095-9400.2015.09.004
