辛伐他汀改善神经源性肺水肿大鼠血清孵育后肺微血管内皮细胞的生长
2015-12-27,,,,,
,, , ,,
(1.南华大学附属第一医院重症医学科,湖南 衡阳 421001;2.南华大学医学院)
·基础医学·
辛伐他汀改善神经源性肺水肿大鼠血清孵育后肺微血管内皮细胞的生长
符晖1*,王桥生1,刘雁2,周斌2,彭忠田1,梁咸章1
(1.南华大学附属第一医院重症医学科,湖南 衡阳 421001;2.南华大学医学院)
目的观察辛伐他汀对神经源性肺水肿(NPE)大鼠血清孵育后肺微血管内皮细胞(PMECs)生长的影响及Bax和Bcl-2表达的影响。方法制备NPE大鼠模型的血清,将体外培养的大鼠PMECs随机分成正常对照组、NPE24 h组、NPE48 h组、辛伐他汀24 h组、辛伐他汀48 h组;NPE组予NPE大鼠模型的血清分别孵育24 h和48 h,辛伐他汀组在NPE大鼠血清孵育的基础上予1 μmol/L辛伐他汀干预24 h和48 h。通过细胞计数法描记生长曲线观察各组细胞生长情况,Western-bolt和RT-PCR分别检测各组PMECs内Bax和Bcl-2蛋白与mRNA表达情况。结果NPE24 h组及48 h组PMECs生长明显减慢,倍增时间延长,有大量漂浮的细胞碎片;辛伐他汀24 h组和48 h组PMECs数量显著增高。同正常对照组相比,NPE24 h组和48 h组PMECs内Bax蛋白和mRNA表达显著增高(P<0.05),而Bcl-2蛋白和mRNA表达降低(P<0.05)。与相应NPE组相比,辛伐他汀24 h组及48 h组Bax蛋白和mRNA表达显著降低(P<0.05),而Bcl-2蛋白和mRNA表达增高(P<0.05)。同辛伐他汀24 h组相比,辛伐他汀48 h组PMECs内Bcl-2蛋白和mRNA表达显著增高(P<0.05)。结论辛伐他汀可改善NPE大鼠血清孵育后PMECs的生长,其机制可能与上调Bcl-2和下调Bax表达有关。
辛伐他汀; 神经源性肺水肿; 肺微血管内皮细胞; Bax; Bcl-2
神经源性肺水肿(neurogenic pulmonary edema,NPE)是指在无原发性心、肺和肾等疾病的情况下,由颅脑损伤或中枢神经系统其他疾病引起的突发性颅内压增高而导致的急性肺水肿,又称中枢性肺水肿。其病程进展快,治疗困难,病死率高。到目前为止,NPE的发病机制仍然不清楚。有研究报道,继发炎症反应导致的肺血管内皮损伤、肺血管通透性增加可能是其机制之一[1-3]。最近有学者研究发现,肺部血管内皮细胞凋亡参与了NPE的形成[4-5]。可见,炎症反应等因素导致肺血管内皮细胞损伤、凋亡可能在NPE发生中起重要作用。而近年大量研究表明辛伐他汀除了其调脂作用外,还有抗炎、调节免疫、抗凋亡,具有保护内皮细胞功能的作用[6-8]。本文作者前期研究亦发现辛伐他汀可抑制脓毒症诱导的人脐静脉血管内皮细胞凋亡,其机制可能与上调Bcl-2和下调Bax有关[9]。而目前辛伐他汀对NPE肺血管内皮细胞的影响及机制还不清楚。本研究通过辛伐他汀干预NPE大鼠血清孵育的大鼠肺微血管内皮细胞(pulmonary microvascular endothelial cells,PMECs),检测PMECs生长情况及不同时间点Bcl-2、Bax蛋白和mRNA的表达变化,探讨辛伐他汀对NPE大鼠PMECs的保护机制。
1 材料与方法
1.1实验材料清洁级雄性SD大鼠,250~300 g,50只,购买于湖南斯莱克景达实验动物有限公司。PMECs(武汉原生原代生物医药科技有限公司,产品编号:MIC-CELL-0001);辛伐他汀(大连美仑生物科技有限公司,规格5 g/瓶);TRIZOL试剂(Life Technologies Corporation,USA),SYBR Green qRCR Mix(TOYOBO CO.,LTD);反转录试剂盒(Thermo Fisher Biochemical Product (Beijing) Co.,Ltd),Bax多克隆抗体(ImmunoWay Biotechnology Company,USA);Bcl-2多克隆抗体(ABZOOM BIOLABS,Inc,USA);羊抗兔Bax二抗(Jackson ImmunoResearch Laboratories,Inc.USA);羊抗兔Bcl-2二抗(Jackson ImmunoResearch Laboratories,Inc.USA);羊抗鼠β-actin二抗(Jackson ImmunoResearch Laboratories,Inc.USA)。
1.2大鼠NPE血清制备参考小脑延髓池穿刺法制作大鼠NPE模型[10],实验大鼠术前12 h禁食但不禁水,10%水合氯醛300 mg/kg腹腔注射进行麻醉固定,麻醉后气管切开行气管插管,用1 mL注射器从枕骨粗隆下0.6~0.7 cm进针,进针深度1.0~1.5 cm,穿刺进入小脑延髓池;穿刺针进入小脑延髓池后即刻在大鼠脑池内注射纤维蛋白原(100 mg/mL)和凝血酶(200 U/mL)各0.075 mL。如大鼠出现呼吸困难,气管插管内可见水肿液或粉红色泡沫痰视为模型复制成功[11]。模型复制成功1 h后处死动物,收集血清备用。
1.3实验分组及干预将体外培养的PMECs随机分成正常对照组、NPE组和辛伐他汀组;其中NPE组根据NPE大鼠血清孵育时间分成NPE24 h组和NPE48 h组两个亚组,辛伐他汀组按干预时间分成辛伐他汀24 h组和辛伐他汀48 h组两个亚组。其中对照组采用普通DMEM培养基培养,NPE24 h组和NPE48 h组采用含20%NPE大鼠血清的DMEM培养基培养,分别孵育24 h和48 h。辛伐他汀24 h组和辛伐他汀48 h组在NPE组的基础上加入1 μmol/L辛伐他汀培养,分别孵育24 h和48 h。各组到相应时间点细胞计数,检测Bax、Bcl-2蛋白和mRNA表达情况。
1.4细胞计数取PMECs接种于24孔板中,1×104/孔,同时加入含20%NPE大鼠血清或含1 μmol/L辛伐他汀的NPE大鼠血清进行孵育,对照组予普通DMEM培养基培养。分别于第24 h、48 h和72 h各组孔随机取3个,消化,吹打成单细胞悬液后,0.04%台盼蓝染色2 min,计算存活细胞数量,计数3次,实验重复2次,计算其平均数。以时间为横坐标(h),细胞数量(1×105个)为纵坐标绘制各组的细胞生长曲线。
1.5 Western-bolt检测Bax和Bcl-2蛋白表达
加入细胞裂解液,冰上裂解30 min,4 ℃ 12 000 r/min离心5 min,取上清液,Bradford法测定蛋白浓度。计算含20 μg总蛋白的溶液体积作为上样量,进行SDS-PAGE电泳,转移至PVDF膜上,5%脱脂奶粉室温封闭1 h。Bax和Bcl-2一抗室温孵育2 h后4 ℃过夜,HRP标记的二抗室温孵育1 h后,加显色液发光,显影定影。将胶片扫描后用图像分析软件IPP6.0对图像进行各条带的灰度值测定,以目的条带与内参β-actin的比值作为半定量依据,每组重复3次。
1.6实时荧光定量PCR检测Bax和Bcl-2 mRNA表达TRIZOL法提取总的RNA并定量,具体按照试剂盒说明进行。取总RNA 20 μg进行逆转录反应,合成cDNA。加入cDNA 1 μL、上游引物1 μL、下游引物1 μL 2×SYBR Green qPCR Mix 10 μL及ddH2O 7 μL,总体积 20 μL进行扩增Bax 、Bcl-2和β-actin。两步法Real-Time定量,预变性95 ℃,3 min,之后每一步变性95 ℃,10 s,58 ℃退火延伸30 s,共进行35个循环,每次在延伸阶段读取荧光值。相关引物序列及扩增片段长度如下:Bcl-2上游引物:5′TGTGGCCTTCTTGAGTTCG3′,下游引物:5′CATCCCAGCCCTCCGTTATCC3′,扩增片段长度为242 bp;Bax上游引物:5′TCCACCAAGAAGCTGAGCGAG3′,下游引物:5′GTCCAGGCCCATGATGGTTCT3′,扩增片段长度为542 bp;β-actin上游引物:5′CACGATGGAGGGGCCGGACTCATC3′,下游引物:5′TAAAGACCTCTATGCCAACACAGT3′,扩增片段长度为852 bp。2-△△CT法计算Bax mRNA和Bcl-2mRNA的相对表达量。
1.7统计学方法所有数据使用SPSS18.0进行处理。正态分布计数资料用均数±标准差表示,各组Bax蛋白和mRNA及Bcl-2蛋白和mRNA采用One Way ANOVA进行比较,组间多重比较采用LSK法,P<0.05为差异具有统计学意义。
2 结 果
2.1细胞生长曲线NPE血清干预组孔内PMECs生长明显减慢,倍增时间较正常对照组延长,细胞数量增加很少,有大量漂浮的细胞碎片。当细胞数大于1.0×105个后,细胞增长迅速。同NPE组相比,辛伐他汀干预后,在孵育24 h、48 h和72 h,PMECs数量均显著增高(P<0.05)。见图1。
2.2各组PMECs的Bax mRNA和蛋白表达同正常对照组相比,NPE24 h组和NPE48 h组PMECs的Bax mRNA表达均增高(P<0.05);同NPE24 h组和NPE48 h组相比,辛伐他汀24 h组和辛伐他汀48 h组Bax mRNA表达均减低(P<0.05),但两组之间Bax mRNA表达无差异(P>0.05)。蛋白电泳图及统计分析显示:与正常对照组相比,NPE 24 h组和NPE48 h组PMECs的Bax蛋白表达增高(P<0.05),NPE48 h组Bax蛋白表达较NPE24 h组增高(P<0.05);而辛伐他汀干预后,辛伐他汀24 h组和辛伐他汀48 h组Bax蛋白表达表达降低(P<0.05);辛伐他汀24 h组和辛伐他汀48 h组Bax蛋白表达差异无显著性(P>0.05)。见图2。

图1 各组细胞生长曲线 与NPE组比较,a:P<0.05
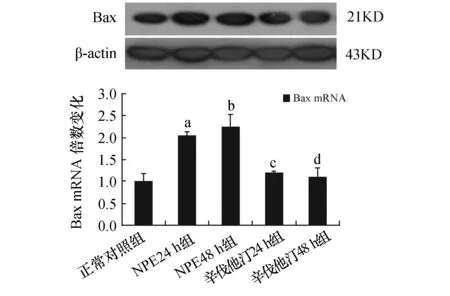
图2 各组PMECs的Bax mRNA和蛋白表达情况 与正常对照组相比,a:P<0.05,b:P<0.05;与NPE24 h组和NPE48h组相比,c:P<0.05,d:P<0.05
2.3各组PMECs的Bcl-2mRNA和蛋白表达与正常对照组相比,NPE24 h组和NPE48 h组PMECs的Bcl-2 mRNA表达均减低(P<0.05),NPE48 h组Bcl-2 mRNA表达较NPE24 h组降低(P<0.05);与NPE24 h组和NPE48 h组相比,辛伐他汀24 h组和辛伐他汀48 h组Bcl-2 mRNA表达均增高(P<0.05),两组Bcl-2 mRNA表达之间差异有显著性(P<0.05)。蛋白电泳图显示:与正常对照组相比,NPE24 h组和NPE48 h组PMECs的Bcl-2蛋白表达减少(P<0.05);而辛伐他汀干预后,辛伐他汀24 h组和辛伐他汀48 h组Bcl-2蛋白表达较NPE24 h组和NPE48 h组均增高(P<0.05);同辛伐他汀24 h组相比,辛伐他汀48 h组Bcl-2蛋白表达增高(P<0.05)。见图3。
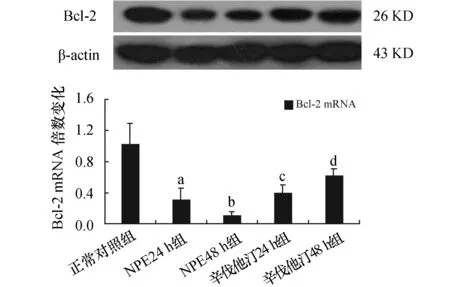
图3 各组PMECs的Bcl-2 mRNA和蛋白表达情况 与正常对照组比较,a:P<0.05,b:P<0.05;与NPE24 h组比较,b:P<0.05;与NPE24 h组和NPE48h组比较,c:P<0.05,d:P<0.05
3 讨 论
就NPE发生的病理生理机制,一是血流动力学机制,1975年,Theodore等[12]就神经源性肺水肿提出了著名的冲击伤理论,这一理论认为,中枢神经系统损伤后机体的应激反应导致血中儿茶酚胺含量显著增高,进而血流动力学急剧变化,体循环内大量血液进入肺循环内。一方面肺毛细血管床有效滤过压急剧增高,从而形成肺水肿;另一方面血流冲击造成血管内皮细胞损伤,大量血浆蛋白外渗导致急性肺水肿进一步加重。另一个是炎症反应学机制,神经中枢局部和继发的全身系统炎症反应,导致大量的细胞因子、趋化因子、神经肽物质P等释放,导致肺血管内皮通透性增加,诱发肺水肿[1]。
本研究结果显示,NPE大鼠血清孵育PMECs后,细胞生长减慢,并可见大量的细胞碎片,而予辛伐他汀干预NPE大鼠血清孵育的PMECs后,细胞生长明显改善。Skrabal等[3]用Foley气囊导管充气诱发猪脑死亡的实验研究发现,其血清TNF-a、IL-1β、 IL-6等细胞因子水平显著增高,并且心、肺和肾组织IL-1β、 IL-6、MCP-1 和TGF- β表达均有显著增高。提示严重中枢损伤可诱发机体全身系统炎症反应,导致外周器官组织损伤。本研究结果显示予辛伐他汀干预后,NPE大鼠血清孵育的PMECs生长改善。这可能与辛伐他汀明确的抗炎作用及拮抗血管内皮细胞凋亡等因素有关[13-15]。
本文辛伐他汀干预大鼠NPE血清孵育的PMECs 后24 h和48 h,PMECs内Bax蛋白和mRNA表达显著降低,而Bcl-2蛋白和mRNA则表达增高;其中Bcl-2蛋白和mRNA在辛伐他汀干预48 h后较24 h表达均增高,但对Bax蛋白和mRNA的表达抑制作用与时间无关。提示辛伐他汀改善PMECs的生长机制可能与上调的Bcl-2和下调Bax表达有关。Bc1-2 家族在细胞内凋亡信号传导中起重要作用。Bcl-2 和Bax 是Bcl-2家族中与细胞凋亡关系密切的两种基因,前者为抗凋亡基因,后者为促凋亡基因,两者间的平衡影响凋亡的发生。由此,辛伐他汀可通过调节Bcl-2和Bax变化,从而拮抗大鼠NPE诱导的细胞凋亡,改善细胞生长及活性,发挥细胞保护作用。先期研究亦发现辛伐他汀可通过上调Bcl-2和下调Bax表达抑制脓毒症诱导的人脐静脉血管内皮细胞凋亡,改善细胞生长,发挥血管内皮细胞保护作用[9]。
车忠应等[16]研究发现辛伐他汀预处理心肌缺血再灌注大鼠后,可上调心肌组织中Bcl-2、下调Bax表达,抑制心肌细胞凋亡,减少心肌梗死面积,对大鼠心肌缺血再灌注有保护作用。另有研究发现辛伐他汀可上调Bcl-2的表达和抑制caspase-3表达,减少神经细胞凋亡,发挥神经保护作用[17]。可见,辛伐他汀可通过调节Bcl-2 和Bax表达变化,抑制多种病因所致的细胞凋亡,起到保护细胞作用。
本研究仅观察了辛伐他汀对NPE大鼠血清生长情况的影响及其对凋亡蛋白Bcl-2和 Bax表达的影响。其改善大鼠血清孵育后PMECs的生长的机制比较复杂,是否与通过抑制细胞凋亡或影响其增殖分化,还是其他机制,有待进一步研究探索。
辛伐他汀可改善NPE大鼠血清孵育后PMECs的生长,其机制之一可能与上调Bcl-2表达和下调Bax表达有关,随着时间延长对Bcl-2表达影响更加明显。
[1] Baumann A,Audibert G,McDonnell J,et al.Neurogenic pulmonary edema[J].Acta Anaesthesiol Scand,2007,51(4):447-455.
[2] Domínguez-Roldán JM,García-Alfaro C,Jimenéz-González PI,et al.Brain death:repercussion on the organs and tissues[J].Med Intensiva,2009,33(9):434-441.
[3] Skrabal CA,Thompson LO,Potapov EV,et al.Organ-specific regulation of pro-inflammatory molecules in heart,lung,and kidney following brain death[J].J Surg Res,2005,123(1):118-125.
[4] Suzuki H,Sozen T,Hasegawa Y,et al Caspase-1 inhibitor prevents neurogenic pulmonary edema after subarachnoid hemorrhage in mice[J].Stroke,2009,40(12):3872-3875.
[5] Suzuki H,Sozen T,Hasegawa Y,et al.Subarachnoid hemorrhage causes pulmonary endothelial cell apoptosis and neurogenic pulmonary edema in mice[J].Acta Neurochir Suppl,2011,111:129-132.
[6] 徐茂凤,李永杰,王婉丽.辛伐他汀抑制高糖诱导人脐静脉内皮细胞的凋亡[J].中国组织工程研究与临床康复,2011,15(41):7726-7729.
[7] 李敏芝,李敏,田东莲,等.辛伐他汀对脓毒症大鼠内皮细胞功能的影响[J].中华麻醉学杂志,2011,31(4):500-502.
[8] La Mura V,Pasarin M,Meireles CZ,et al.Effects of simvastatin administration on rodents with lipopolysaccharide-induced liver microvascular dysfunction[J].Hepatology,2013,57(3):1172-1181
[9] 符晖,罗琼,谭思,等.辛伐他汀对脓毒症内皮细胞的保护作用[J].中华急诊医学杂志,2013,22(9):994-999.
[10] Hamdy O,Maekawa H,Shimada Y,et al.Role of central nervous system nitric oxide in the development of neurogenic pulmonary edema in rats[J].Crit Care Med,2001,29(6):1222-1228.
[11] 符晖,王桥生,刘雁,等.神经源性肺水肿大鼠模型的改进与评价[J].中南医学科学杂志,2015,43(2):141-144.
[12] Theodore J,Robin ED.Pathogenesis of neurogenic pulmonary oedema[J].Lancet,1975,2(7938):749-751.
[13] Du G,Song Y,Zhang T,et al.Simvastatin attenuates TNF-α induced apoptosis in endothelial progenitor cells via the upregulation of SIRT1[J].Int J Mol Med,2014,34(1):177-182.
[14] Hot A,Lavocat F,Lenief V,et al.Simvastatin inhibits the pro-inflammatory and pro-thrombotic effects of IL-17 and TNF-α on endothelial cells[J].Ann Rheum Dis,2013,72(5):754-760.
[15] Wang KW,Chen HJ,Lu K,et al.Simvastatin attenuates the cerebral vascular endothelial inflammatory response in a rat traumatic brain injury[J].Ann Clin Lab Sci,2014,44(2):145-150.
[16] 车忠应,陈还珍.辛伐他汀预处理对大鼠心肌缺血再灌注损伤Bcl-2和Bax表达的影响[J].中国医疗前沿,2011,06(2):26-27.
[17] Sun J,Xie C,Liu W,et al.The effects of simvastatin on hippocampal caspase-3 and Bcl-2 expression following kainate-induced seizures in rats[J].Int J Mol Med,2012,30(4):739-746.
SimvastatinImprovestheGrowthofPulmonaryMicrovascularEndothelialCellsIncubatedinSerumofNeurogenicPulmonaryEdemaRat
FU Hui,WANG Qiaosheng,LIU Yan,et al
(DepartmentofCriticalCareMedicine,theFirstAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveTo observe the effect of simvastatin on the growth of pulmonary microvascular endothelial cells (PMECs) incubated in the serum of neurogenic pulmonary edema (NPE) rat and expression of Bax and Bcl-2 of PMECs.MethodsThe PMECs were randomly divided into five groups,the control group,NPE 24 h group,NPE 48 h group,simvastatin 24 h group and simvastatin 48 h group.The two NPE groups were incubated in rat serum for 24 h and 48 h respectively.The two simvastatin groups were treated with 1 μmol/L simvastatin,also incubated in rat serum for 24 h and 48 h respectively.The cell growth in each group was determined by the cell growth curve of cytometry,while the expression of Bax and Bcl-2 was detected by Western-bolt and RT-PCR.ResultsIn the NPE 24 h and NPE 48 h groups,the growth rate of PMECs was significantly decreased with increased doubling time and a large amount of floating cell debris.In the simvastatin 24 h and simvastatin 48 h groups,the number of PMECs increased significantly.The expressions of Bax was significantly upregulated (P<0.05),while the expressions of Bcl-2 was significantly downregulated (P<0.05) in the NPE 24 h and NPE 48 h groups when compared with that in the control group.The expressions of Bax was significantly downregulated (P<0.05),while the expressions of Bcl-2 was significantly upregulated (P<0.05) in the simvastatin 24 h and simvastatin 48 h groups when compared with that in the control group.The expression of Bcl-2 of PMECs in the simvastatin 48 h group was significantly increased (P<0.05) compared to the simvastatin 24 h group.ConlusionsSimvastatin improves the growth of PMECs incubated with serum of NPE rat.One of the corresponding mechanisms may be related to the upregulation of Bcl-2 and downregulation of Bax.
simvastatin; neurogenic pulmonary edema; pulmonary microvascular endothelial cells; Bax; Bcl-2
10.15972/j.cnki.43-1509/r.2015.05.008
2015-03-25;
2015-05-28
湖南省科技计划项目(2014SK3088);湖南省医药卫生科研计划课题项目(B2013-040).
*通讯作者,E-mail:13973417900@163.com.
R741.02
A
(此文编辑:蒋湘莲)
