铁离子对甲磺酸高速镀锡液中锡离子氧化水解的影响
2015-12-26王志登王洺浩王熙禹黎德育李宁
王志登,王洺浩,王熙禹,黎德育,李宁*
(哈尔滨工业大学化工学院,黑龙江 哈尔滨 150001)
铁离子对甲磺酸高速镀锡液中锡离子氧化水解的影响
王志登,王洺浩,王熙禹,黎德育,李宁*
(哈尔滨工业大学化工学院,黑龙江 哈尔滨 150001)
通过监测镀液吸光度和Sn2+含量随甲磺酸(MSA)高速镀锡液中铁离子(Fe2+和Fe3+)含量的变化,分析了镀液中Sn2+氧化水解速率与铁离子的关系。结果表明,在简单盐溶液体系中,Sn2+先氧化生成Sn4+,再水解生成偏锡酸沉淀。Fe3+氧化Sn2+而生成的锡泥是影响镀液浊度的主要因素。Fe2+含量为5 ~ 15 g/L时,Fe2+对Sn2+的氧化有稳定的减缓作用;Fe2+含量为10 g/L时对Sn2+氧化水解的减缓作用最强。鼓气加速Sn2+氧化水解的试验表明,Fe2+含量为10 g/L的镀液中Sn2+质量浓度与鼓气时间呈线性关系。
高速镀锡;甲磺酸;锡离子;铁离子;氧化;水解
First-author’s address:School of Chemical Engineering and Technology, Harbin Institute of Technology, Harbin 150001, China
甲磺酸(MSA)体系作为一种新型绿色高速镀锡体系,近年来已被国内镀锡板厂推广使用,梅钢、首钢、沙钢以及中粤镀锡板等新生产线都采用该体系,占镀锡板年产量的45%左右。相对于弗洛斯坦工艺,MSA体系的环保及物化性能优于硫酸和酚磺酸,其添加剂一般为非离子表面活性剂,可增强阴极极化,抑制锡支晶生长,保证能够在宽电流密度和温度区间工作。MSA体系镀锡的相关研究主要集中在电子电镀纯锡代替铅锡合金方面,文献报道了不少MSA体系镀锡添加剂,如全氟磺酸型阳离子表面活性剂[1]、聚乙二醇(PEG)[2]、Triton X-100[3]等作为锡晶粒细化剂,羟基酚、羟基酚磺酸类、萘酚磺酸[4]、V5+和V3+、Ti5+和Ti3+[5]等用作Sn2+抗氧化剂。
酸性体系中Sn2+的稳定性也一直是研究重点。C. T. J. Low等[6]采用旋转圆盘电极研究了对苯二酚对MSA体系稳定性的影响。龙有前等[7]分析了酸性镀锡液不稳定的原因,认为Sn2+氧化和Sn4+水解是影响镀液稳定性的重要因素。S. G. Meibuhr[8]的研究认为,Sn2+在苯磺酸(PSA)体系中以简单离子形式存在,与PSA无配位作用。强酸性条件下Sn2+的配体非常少[9-10],不能通过配位键稳定Sn2+。Sn2+的氧化水解一方面导致锡流失,成本提高;另一方面,生成的锡泥会影响镀层质量[11]。这些研究成果丰富了研究人员对MSA体系高速镀锡的认识,但针对实际生产中必然产生的铁离子杂质对Sn2+氧化水解的影响,尚未见报道。本文针对MSA高速镀锡溶液体系,研究了铁离子对镀液浊度和 Sn2+氧化水解的影响,有利于提高技术人员对这一杂质的认识,更好地服务于生产应用。
1 实验
镀液组成为:Sn2+[以Sn(CH3SO3)2形式加入]15 g/L,MSA(质量分数70%,购于BASF )50 mL/L,添加剂EPE-4600(商品名Pluronic 9400)1.0 g/L,对苯二酚0.5 g/L,98%(质量分数)浓硫酸10 mL/L。实际镀液中Fe3+约占总铁离子的5%,因此铁离子按ρ(Fe2+)∶ρ(Fe3+)= 24∶1的比例,以混合硫酸盐的形式掺入镀液。实验用水为去离子水。
镀液中Sn2+的测定严格按照JB/T 7777.1-2008《银氧化锡氧化铟电触头材料化学分析方法 第1部分:碘量法测定锡量》。镀液浊度采用吸光度来表征,利用岛津UV-2550型紫外可见分光光度计测定,测定波长为400 ~1 000 nm,采样间隔为0.06 nm。
2 结果与讨论
2. 1 锡-水体系分析
简单盐体系中,Sn2+作为中间态离子,它在水溶液中的存在形态与溶液pH密切相关。由锡水体系电位-pH图[12]可知,Sn4+在pH = 1时已经完全水解生成水合SnO2,Sn2+在pH = 4时完全水解生成Sn(OH)2或碱式盐。从Sn2+和Sn4+的配合物稳定性来看,Sn2+水解形成Sn(OH)2的Ksp= 3 × 1026,Sn4+水解生成Sn(OH)4的Ksp≈ 1057,Sn4+形成碱式盐沉淀的平衡常数远大于Sn2+,表明此反应不可逆,Sn2+氧化成Sn4+时会快速水解,生成的偏锡酸沉淀难以溶解。因此,实际镀液中Sn2+浓度的变化历程是先氧化成Sn4+,再由Sn4+水解生成锡泥沉淀。MSA镀液的pH <1,所以要保证镀液稳定,必须减缓Sn2+氧化生成Sn4+的速率。
为研究含铁离子MSA镀液中Sn2+氧化水解的影响,查阅了标准状态下的标准电极电位[13],表列出了MSA体系中可能发生的反应。

表1 甲磺酸体系中可能发生的反应Table 1 Possible reactions in MSA system
反应2Fe3++ Sn2+→ 2Fe2++ Sn4+的ΔG = -119 kJ/mol,说明镀液中存在的Fe3+能与Sn2+反应生成Sn4+和Fe2+,直接导致Sn2+浓度下降。根据标准电极电位可知,溶液中Sn2+的还原性要强于Fe2+,而氧化性强弱顺序则是O2>Fe3+> Sn4+。理论上,O2首先与Sn2+发生反应,待Sn2+完全耗完后,Fe2+才发生氧化反应,溶液中亚铁离子对Sn2+氧化水解应无作用。
2. 2 铁离子对镀液浊度的影响
铁离子加入到MSA镀液中时,镀液的澄清度随着铁离子浓度升高而降低。研究比较了一系列铁离子质量浓度下,镀液静置保存0 ~ 228 h的外观变化,结果见图1。从图1可知,样品瓶底部有锡泥沉积,锡泥量随铁离子质量浓度增大而增多,且摇匀后镀液浊度随存储时间延长而逐渐加深。镀液外观变化可解释为 Sn2+和 Fe3+反应生成的Sn4+水解产物悬浮在镀液中以及Fe2+特征吸收。
采用吸光度来表征镀液的浊度,结果见图2。从中可知,波长为400 ~ 800 nm时,镀液吸光度变化曲线的趋势一致,镀液浊度随铁离子含量增大和放置时间延长而增大。锡泥沉淀物是镀液浊度变化的主要原因。选择波长800 nm处的吸光度来分析浊度与铁离子浓度之间的关系,见图2d。从图2d可知,放置0 h时,镀液吸光度与Fe3+质量浓度之间的相关系数为0.995 956,放置132 h和228 h后,镀液吸光度与Fe2+质量浓度之间的相关系数分别降至0.958 956和0.952 465。说明2种铁离子对镀液浊度的影响程度不同,Fe3+的影响较Fe2+强。

图1 铁离子含量和储存时间对MSA镀锡液浊度的影响Figure 1 Effect of iron ion content and storage time on turbidity of MSA tin plating bath
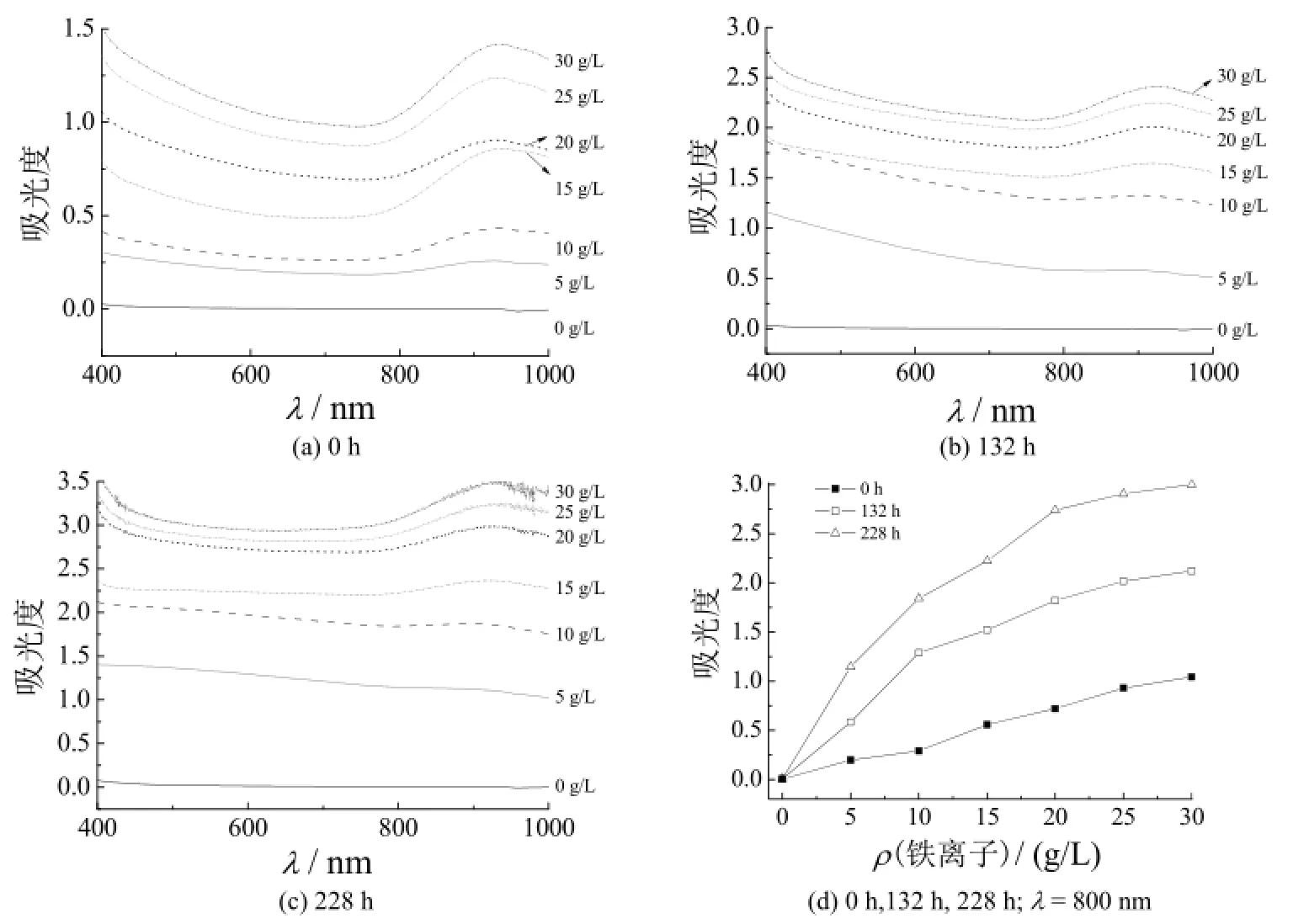
图2 铁离子含量不同时镀液吸光度随储存时间的变化Figure 2 Variation of absorbance of plating bath containing different dosages of iron ion with storage time
镀液吸光度和Sn2+质量浓度随Fe2+质量浓度的变化见图3。

图3 Fe2+含量对镀液吸光度变化速率和Sn2+氧化水解速率的影响Figure 3 Effect of Fe2+content on change rate of absorbance of the bath and oxidation-hydrolysis rate of Sn2+
从图3可知,在0 ~ 132 h、132 ~ 228 h和0 ~ 228 h时间段内,镀液吸光度的变化趋势一致,随Fe2+质量浓度增大而增大,但吸光度与Fe2+质量浓度呈非线性关系。Sn2+质量浓度在静置保存过程中的变化与吸光度的变化对应,证实了锡泥是镀液浑浊的主要因素,Fe3+初始质量浓度不同是产生锡泥差异的直接因素,而Fe2+溶液本征吸收不会造成镀液浊度变化。
2. 3 Fe2+对镀液中Sn2+氧化水解速率的影响
针对上述镀液,检测了不同状态下的Sn2+质量浓度,结果见图4。从图4a可知,Sn2+质量浓度的变化速率与 Fe3+添加量呈线性关系,符合电子守恒定律,故镀液初始锡泥含量与 Fe3+的添加量直接相关。当 Fe3+反应完全后,镀液静置储存过程中,平行样品中Sn2+质量浓度的变化速率仅受Fe2+影响(见图4b)。在研究的Fe2+质量浓度范围内,Sn2+质量浓度变化速率在0 ~ 144 h、144 ~ 480 h和0 ~ 480 h时间范围内的走向一致。镀液中无Fe2+时,Sn2+的氧化水解速率为正常的Sn2+氧化水解反应速率[约0.6 mg/(L·h)],与高Fe2+浓度(> 20 g/L)时Sn2+的氧化水解速率相近,说明高浓度Fe2+对Sn2+氧化水解速率的影响较小。溶液中Fe2+为0 ~ 10 g/L时,随Fe2+含量升高,Sn2+氧化水解速率降低,该浓度范围内,Fe2+具有减缓Sn2+氧化的作用;Fe2+含量由10 g/L进一步增大到20 g/L时,Sn2+的氧化水解速率增大;Fe2+含量在20 ~ 30 g/L时,Sn2+的水解速率随Fe2+含量增大的变化较小。依据能斯特方程可知,平衡电位φ(Fe3+/Fe2+)不随溶液中Fe2+浓度变化而变化,也就排除了Fe2+在热力学上对Sn2+氧化水解速率的影响,但可理解为Fe2+在MSA镀液中的存在形式影响了Sn2+的氧化水解速率:当Fe2+为0 ~ 10 g/L时,Fe2+胶团逐渐形成,其胶团吸附了溶液中的O2,导致O2与Sn2+反应的概率降低,同时胶团中的Fe2+与O2反应速率较慢,生成的Fe3+与氧耗呈反比,Sn2+氧化水解速率降低;Fe2+为10 ~ 30 g/L时,溶解氧与Fe2+的反应概率逐步提高,Sn2+的氧化速率开始上升,直至O2等效氧化Sn2+,此时Fe2+对Sn2+的氧化水解无影响。

图4 铁离子含量对Sn2+氧化水解速率的影响Figure 4 Effect of iron ion content on oxidation-hydrolysis rate of Sn2+
2. 4 铁离子对镀液中Sn2+氧化水解的影响
上述实验说明,在静置储存的低氧环境下,Fe2+质量浓度为5 ~ 15 g/L时,Fe2+对Sn2+的氧化水解有减缓作用,然而实际生产中镀液时刻处于高氧、强制对流环境,为确定此情况下 Fe2+对 Sn2+的氧化水解是否具有减缓作用,采用向镀液中鼓空气来模拟镀液的气场环境,研究高氧环境中 Fe2+对 Sn2+氧化水解的影响规律,结果如图5所示。
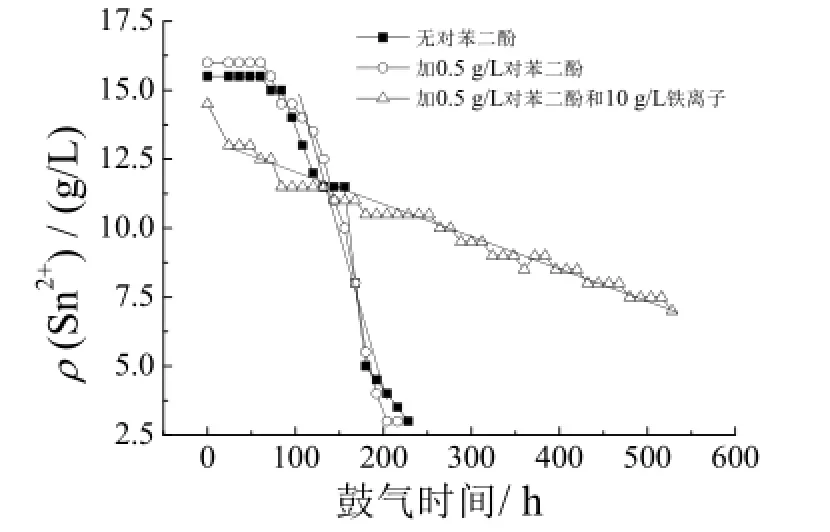
图5 铁离子对镀液中Sn2+氧化水解过程的影响Figure 5 Effect of iron ion on hydrolysis and oxidation of Sn2+
从图5可以看出,铁离子刚引入镀液后,镀液Sn2+含量显著降低,可解释为初始铁离子中所含的 4% Fe3+与Sn2+反应消耗所致,此后,铁离子以Fe2+形式对镀液产生影响。鼓气加速老化0 ~ 80 h,MSA基础镀液(15 g/L Sn2++ 50 mL/L MSA + 1 g/L EPE-4600)及含对苯二酚镀液的Sn2+质量浓度基本不变;鼓气80 ~ 200 h,MSA基础镀液和含对苯二酚镀液的Sn2+质量浓度急剧下降;相反,在整个测试周期(528 h)内,含铁离子镀液的Sn2+质量浓度以平均0.014 g/(L·h)的速率由最初的15 g/L缓慢降到7.0 g/L,Sn2+质量浓度与鼓气时间呈线性关系。因此,在高氧和剧烈对流环境中,含低浓度Fe2+(<10 g/L)MSA镀液中Fe2+对Sn2+的氧化水解有明显的减缓作用。在60 ~ 216 h内,不含Fe2+的镀液中Sn2+质量浓度呈直线下降,原因可能为锡泥胶团吸附了溶液中的O2,从而加速Sn2+氧化水解。高氧环境的铁离子作用结果与低氧环境的实验结果吻合,证实低浓度Fe2+对镀液中Sn2+的氧化水解有一定的稳定作用。
3 结论
(1) 在简单盐溶液体系中,Sn2+的损耗遵循先氧化生成Sn4+再水解形成沉淀的路径。
(2) 在MSA镀锡体系中,Fe3+和Fe2+对Sn2+氧化水解的影响不同。Fe3+不能与Sn2+共存,Fe3+直接氧化Sn2+生成锡泥是影响镀液浊度的主要因素;Fe2+在5 ~ 15 g/L时,具有减缓Sn2+氧化的作用,Fe2+为10 g/L时,其减缓作用最强。
(3) 鼓气加速Sn2+氧化水解试验结果表明,Fe2+为10 g/L时,MSA镀液中Sn2+的质量浓度与鼓气时间呈线性关系。
[1]LOW C T J, WALSH F C. Electrodeposition of tin, copper and tin-copper alloys from a methanesulfonic acid electrolyte containing a perfluorinated cationic surfactant [J]. Surface and Coatings Technology, 2008, 202 (8): 1339-1349.
[2]FUKUDA M, IMAYOSHI K, MATSUMOTO Y. Effect of adsorption of polyoxyethylene laurylether on electrodeposition of Pb-free Sn alloys [J]. Surface and Coatings Technology, 2003, 169/170: 128-131.
[3]BARRY F J, CUNNANE V J. Synergistic effects of organic additives on the discharge, nucleation and growth mechanisms of tin at polycrystalline copper electrodes [J]. Journal of Electroanalytical Chemistry, 2002, 537 (1/2): 151-163.
[4]LEE J Y, KIM J W, CHANG B Y, et al. Effects of ethoxylated α-naphtholsulfonic acid on tin electroplating at iron electrodes [J]. Journal of the Electrochemical Society, 2004, 151 (5): C333-C341.
[5]牛振江, 林飞峰, 杨防祖, 等. 钒化合物对酸性镀锡溶液的稳定作用[J]. 电化学, 2001, 7 (1): 90-95.
[6]LOW C T J, WALSH F C. The stability of an acidic tin methanesulfonate electrolyte in the presence of a hydroquinone antioxidant [J]. Electrochimica Acta, 2008, 53 (16): 5280-5286.
[7]龙有前, 肖鑫, 郭贤烙. 酸性镀锡液不稳定性研究[J]. 材料保护, 2003, 36 (3): 47-48.
[8]MEIBUHR S G. Complexing between tin ions and phenolsulphonic acid [J]. Electrochimica Acta, 1968, 13 (4): 831-834.
[9]SÉBY F, POTIN-GAUTIER M, GIFFAUT E, et al. A critical review of thermodynamic data for inorganic tin species [J]. Geochimica et Cosmochimica Acta, 2001, 65 (18): 3041-3053.
[10]方景礼. 电镀配合物——理论与应用[M]. 北京: 化学工业出版, 2007: 515-518.
[11]袁诗璞. 酸性镀锡液中的阳极与β-锡酸[J]. 电镀与涂饰, 2013, 32 (9): 34-38.
[12]杨熙珍, 杨武. 金属腐蚀电化学热力学: 电位-pH图及其应用[M]. 北京: 化学工业出版社, 1991: 121-122.
[13]LIDE D R. CRC Handbook of Chemistry and Physics [M]. 90th ed. Boca Raton, FL: CRC Press, 2010: 8-21-8-28.
[ 编辑:周新莉 ]
Effect of iron ion on oxidation and hydrolysis of tin ion in methanesulfonic acid solution for high-speed tin plating
WANG Zhi-deng, WANG Ming-hao, WANG Xi-yu, LI De-yu, LI Ning*
The relationship between oxidation-hydrolysis rate of Sn2+and iron ion in a methanesulfonic acid (MSA) bath for high-speed tin plating was analyzed by monitoring the variation of absorbance and Sn2+content of the bath as a function of iron ion (Fe2+and Fe3+) content. The results showed that Sn2+is oxidized to Sn4+followed by being hydrolyzed to metastannic acid precipitate in an aqueous solution of simple salt. The main factor affecting the turbidity of plating bath is the metastannic acid precipitate produced from the oxidation of Sn2+by Fe3+. 5-15 g/L Fe2+in the bath can slow down the oxidation of Sn2+, and the strongest retarding effect is obtained at 10 g/L. The results of accelerated oxidation-hydrolysis test under air agitation showed that there is a linear relationship between mass concentration of Sn2+and air agitation time at a Fe2+content of 10 g/L.
high-speed tin plating; methanesulfonic acid; tin ion; iron ion; oxidation; hydrolysis
TQ153.13
A
1004 - 227X (2015) 17 - 0960 - 05
2015-06-04
2015-07-29
王志登(1985-),男,江苏盐城人,在读博士研究生,研究方向为材料表面处理与腐蚀防护、电化学分析及传感器。
李宁,教授,(E-mail) lininghit@263.net。
